Électrode à quinhydrone
L'électrode à quinhydrone, mise au point en 1920 par Einar Biilmann[1] est une électrode de travail utilisée pour mesurer la concentration en ions hydrogène (pH) d'une solution contenant une substance acide[2],[3].
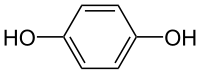

Le contact électrique est assuré par un fil de platine immergé dans une solution aqueuse saturée de quinhydrone, cette substance étant un mélange équimolaire de benzoquinone et d'hydroquinone caractérisé par l'équilibre suivant :
- C6H6O2 ⇌ C6H4O2 + 2H+ + 2e−
On détermine le potentiel hydrogène sur base de l'équation de Nernst pour cet équilibre (avec l'abréviation de la benzoquinone et l'abréviation de l'hydroquinone) :
La quinone et l'hydroquinone étant présentes en quantité équimolaire, leur rapport est unitaire et on peut réécrire l'égalité :
On constate alors que la différence de potentiel entre l'électrode de platine et une électrode de référence dépend uniquement de l'activité , des ions hydrogène en solution. Le potentiel standard de réduction du couple impliqué vaut 0,6992 V à 25 °C[4].
A l'époque de sa création, les mesures de pH étaient réalisées par analyses colorimétriques (inutilisables avec des composés colorés) ou au moyen d'une électrode à hydrogène. Cette dernière ayant une réponse lente et étant compliquée à mettre en place (nécessité d'un apport constant en dihydrogène), l'électrode à quinhydrone a été développée comme alternative[1]. Les seules limitations de cette dernière étant qu'elle n'est pas précise dans une gamme de pH supérieur à 8 et qu'elle est inutilisable en présence de composés fortement oxydants ou réducteurs[2].
Plus tard, avec l'arrivée de l'électronique moderne et de l'électrode de verre[3], l'électrode à quinhydrone a perdu en popularité à cause de ses limitations bien qu'elle soit encore utilisée actuellement.
Références
modifier- John T. Stock, « Einar Biilmann (1873-1946): pH determination made easy », Journal of Chemical Education, vol. 66, no 11, , p. 910 (ISSN 0021-9584, DOI 10.1021/ed066p910, lire en ligne, consulté le )
- Bates, Roger G. Determination of pH: theory and practice. Wiley, 1973, pp 246-252
- F. J. C. Rossotti et H. Rossotti, The Determination of Stability Constants, McGraw-Hill,
- (en) Zoski, Cynthia G., Handbook of electrochemistry, Amsterdam/Paris, Elsevier, , 892 p. (ISBN 978-0-444-51958-0 et 0-444-51958-0, OCLC 928694860, lire en ligne)




