1,1'-Bi-2-naphtol
Le 1,1'-bi-2-naphtol ou BINOL est un dérivé d'un dimère de naphtalène souvent utilisé comme ligand de métaux de transition employés comme catalyseurs en synthèse asymétrique. En effet, BINOL présente une chiralité axiale de type atropoisomérie, c'est-à-dire que la rotation autour de la simple liaison naphtyl-naphtyl est bloquée du fait de l'encombrement stérique des groupes hydroxyle en position ortho par rapport à cette liaison. Ainsi, les deux atropoisomères peuvent être vraiment séparés et sont stables vis-à-vis de la racémisation. Le pouvoir rotatoire des deux énantiomères est de +/- 35,5° (c=1 dans le THF). Le BINOL est aussi le précurseur d'un autre ligand chiral appelé BINAP.
| 1,1'-Bi-2-naphtol | |||
  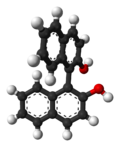 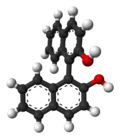 S-BINOL (à gauche) et R-BINOL (à droite) |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,1'-binaphtalène-2,2'-diol | ||
| Synonymes |
1,1'-bi-2,2'-naphtol |
||
| No CAS | (racémique) ((Ra)-(+)) ((Sa)-(–)) |
||
| No ECHA | 100.009.104 | ||
| No CE | 210-014-0 | ||
| No RTECS | DU3106000 | ||
| PubChem | 11762 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C20H14O2 [Isomères] |
||
| Masse molaire[1] | 286,324 ± 0,017 6 g/mol C 83,9 %, H 4,93 %, O 11,18 %, |
||
| Propriétés physiques | |||
| T° fusion | 205 à 211 °C[2] 214 à 217 °C (racémique)[3] 208 à 210 °C (R ou S)[4] |
||
| Propriétés optiques | |||
| Pouvoir rotatoire | [α]21/D +34°, c=1 dans THF ((R)-(+))[4] [α]22/D −34°, c=1 dans THF ((S)-(-))[4] |
||
| Précautions | |||
| SGH[3] | |||
| H301, H319, P301+P310 et P305+P351+P338 |
|||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Préparation
modifierLa synthèse organique du 1,1'-bi-2-naphtol n'est pas un défi par rapport à la préparation d'un seul de ses énantiomères.
Le (S)-BINOL peut être préparé directement via un couplage oxydatif asymétrique du napht-2-ol avec du chlorure de cuivre(II). Sa chiralité est induite grâce à la (S)-(+)-amphétamine[5].

Le BINOL racémique peut être aussi produit en utilisant du chlorure de fer(III) comme oxydant. Le mécanisme de la réaction passe par la complexation de l'ion Fe3+ par l'atome d'oxygène des hydroxyles des 2-naphtol, suivie par une réaction de couplage des radicaux naphtyl amorcés par la réduction du fer III en fer II.
Du BINOL optiquement pur peut être aussi obtenu du racémique par résolution chirale. Dans une des méthodes employées, le chlorure de N-benzylcinchonidinium, un alcaloïde chiral, forme par cristallisation avec BINOL, un composé d'inclusion chiralement trié. Le composé d'inclusion avec l'atropoisomère S est soluble dans l'acétonitrile tandis que celui avec l'atropoisomère R ne l'est pas[6].
Dans une autre méthode, le BINOL réagit avec du chlorure de pentanoyle, le chlorure de l'acide pentanoïque (CH3(CH2)3COCl), pour former le di-ester. L'enzyme cholestérol estérase est alors introduite sous forme de poudre acétonique de pancréas bovin qui est capable d'hydrolyser le di-ester (S) mais pas le di-ester (R)[6]. Le dipropanoate (R) est hydrolysé dans une seconde étape avec le méthoxyde de sodium (CH3ONa)[7].
L'HPLC avec une phase stationnaire chirale constitue une troisième méthode[8].
Dérivés
modifierBINOL a permis la synthèse de beaucoup d'autres dérivés atropoisomériques, l'un d'entre eux étant le BINAP.
Le complexe di(binaphtoxyde) d'aluminium et de lithium (ALB de l'anglais « AlLibis(binaphthoxide) ») est préparé par réaction de BINOL et du tétrahydruroaluminate de lithium (LiAlH4)[9].
Il a été utilisé dans une réaction de Michael asymétrique avec de la cyclohexénone et du malonate de diméthyle :
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 1,1'-Bi-2-naphthol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Page de données sur chemexper.com
- 1,1′-Bi-2-naphthol chez Sigma-Aldrich.
- (R)-(+)-1,1′-Bi(2-naphthol) et (S)-(−)-1,1′-Bi(2-naphthol) chez Sigma-Aldrich.
- (en) J. Brussee et A. C. A. = Jansen, « A highly stereoselective synthesis of s(–)-[1,1′-binaphthalene]-2,2′-diol », Tetrahedron Letters, vol. 24, no 31, , p. 3261–3262 (DOI 10.1016/S0040-4039(00)88151-4).
- Dongwei Cai, David L. Hughes, Thomas R. Verhoeven, and Paul J. Reider, Resolution of 1,1'-bi-2-Naphthol, Organic Syntheses Coll. vol. 10, p. 93, vol. 76, p. 1.
- Romas J. Kazlauskas, "(S)-(−)- AND (R)-(+)-1,1'-BI-2-Naphthol, Organic Syntheses Coll. vol. 9, p. 77, vol. 70, p. 60.
- G. Landek, M. Vinković, D. Kontrec and V. Vinković, Influence of mobile phase and temperature on separation of 1,1 '-binaphthyl-2,2 '-diol enantiomers with brush type chiral stationary phases derived from L-leucine, Chromatographia, 2006, vol. 64(7-8), p. 469–473. DOI 10.1365/s10337-006-0041-5.
- Youjun Xu, Ken Ohori, Takashi Ohshima, Masakatsu Shibasaki, A practical large-scale synthesis of enantiomerically pure 3-[bis(methoxycarbonyl)methyl]cyclohexanone via catalytic asymmetric Michael reaction, Tetrahedron, 2002, vol. 58(13), p. 2585–2588. DOI 10.1016/S0040-4020(02)00141-2.



