Acide 2-nitrobenzoïque
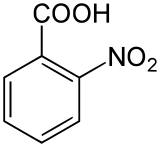
L'acide 2-nitrobenzoïque est un composé organique de formule C6H4(NO2)CO2H. Il est préparé par oxydation du 2-nitrotoluène avec de l'acide nitrique[2]. C'est l'un des trois isomères structuraux de l'acide nitrobenzoïque avec l'acide 3-nitrobenzoïque et l'acide 4-nitrobenzoïque.
| Acide 2-nitrobenzoïque | |
| |
| Identification | |
|---|---|
| Nom systématique | acide 2-nitrobenzoïque |
| Synonymes |
acide orthonitrobenzoïque |
| No CAS | |
| No ECHA | 100.008.187 |
| PubChem | 11087 |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | C7H5NO4 [Isomères] |
| Masse molaire[1] | 167,118 9 ± 0,007 4 g/mol C 50,31 %, H 3,02 %, N 8,38 %, O 38,29 %, |
| pKa | 2,22[réf. souhaitée] |
| Propriétés physiques | |
| T° fusion | 147,5 °C[réf. souhaitée] |
| Solubilité | 7,85 g L−1 (eau, 25 °C)[réf. souhaitée] |
| Masse volumique | 1,575 g cm−3 (20 °C)[réf. souhaitée] |
| Précautions | |
| SGH | |
| H315, H319 et H335 |
|
| Écotoxicologie | |
| LogP | 1,46[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Propriétés
modifierÀ température ambiante, l'acide 2-nitrobenzoïque se trouve sous forme de poudre blanche. Le composé est légèrement soluble dans l'eau et plus encore dans l'éthanol, l'éther diéthylique et l'acétone. En tant qu'acide, l'acide 2-nitrobenzoïque est plus fort que l'acide benzoïque et a une valeur de pKa de 2,2. Le composé peut être réduit par hydrogénation en acide anthranilique.
Synthèse
modifierL'acide 2-nitrobenzoïque peut être préparé par nitration de l'acide benzoïque, mais il est principalement préparé à partir du 2-nitrotoluène par oxydation avec de l'acide nitrique, de l'acide chromique ou du permanganate de potassium.
Utilisation
modifierL'acide o-nitrobenzoïque est utilisé pour fabriquer de l'acide anthranilique, des pesticides, du chlorure de 2-nitrobenzoyle et certains médicaments tels que la glafénine et la pirenzépine[3]. Il peut également être utilisé en chimie analytique pour détecter la présence d'ions mercure ou d'ions métalliques tétravalents.
Références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Takao Maki et Kazuo Takeda, Benzoic Acid and Derivatives, Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim, DOI 10.1002/14356007.a03_555.
- (en) Thomas Scott et Mary Eagleson, Concise encyclopedia chemistry, Walter de Gruyter, (ISBN 9783110114515, lire en ligne), p. 695–696
