Structure fluorine
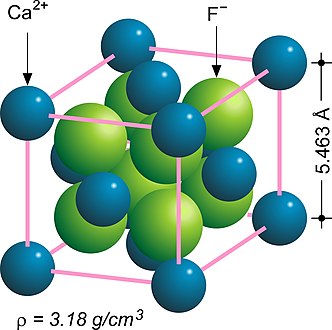
En chimie du solide, la structure fluorine fait référence à une structure cristalline couramment rencontrée dans les composés de formule chimique MX2[1],[2]. Les anions X occupent les huit sites tétraédriques interstitiels tandis que les cations M occupent les sites d'une structure cubique à faces centrées (CFC). De nombreux matériaux cristallins adoptent cette structure, notamment la fluorine, constituée de fluorure de calcium CaF2.
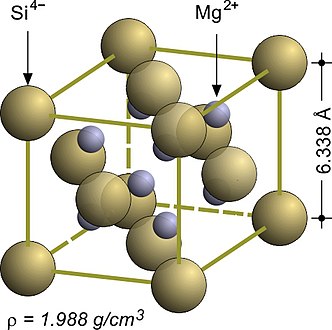
Les composés du magnésium de formule Mg2X, où X peut être du silicium Si, du germanium Ge, de l'étain Sn ou du plomb Pb, ont une structure dite antifluorite car la distribution des anions et des cations est inversée par rapport à celle d'une fluorine : les anions occupent les sites d'une structure CFC tandis que les cations occupent les sites interstitiels. Le siliciure de magnésium Mg2Si a un paramètre cristallin de 633,8 pm et une structure CFC dans laquelle chaque anion siliciure Si4− est entouré par huit cations de magnésium Mg2+[3] :
-
Fluorine CaF2.
-
Siliciure de magnésium Mg2Si.
| Matériau | Paramètre cristallin (Å) | Structure |
|---|---|---|
| BaF2 | 6,196 | Fluorite |
| β-PbF2 | 5,94 | Fluorite |
| PuO2 | 5,399 | Fluorite |
| SrF2 | 5,7996 | Fluorite |
| UO2 | 5,47065 | Fluorite |
| CaF2 | 5,463 | Fluorite |
| ZrO2 cubique | 5,14 | Fluorite |
| K2O | 6,449 | Antifluorite |
| K2S | 7,406 | Antifluorite |
| Li2O | 4,61 | Antifluorite |
| Na2O | 5,55 | Antifluorite |
| Na2S | 6,54 | Antifluorite |
| Rb2O | 6,74 | Antifluorite |
| Mg2Si | 6,338 | Antifluorite |
Notes et références
modifier- (en) Arnold Frederik Holleman et Egon Wiberg, Inorganic Chemistry, Academic Press/De Gruyter, 2001. (ISBN 0-12-352651-5)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e éd., Butterworth-Heinemann, 1997. (ISBN 978-0-08-037941-8)
- (en) Costel Rizescu et Mihaela Rizescu, Structure of Crystalline Solids, Imperfections and Defects in Crystals, 1re éd., Shutter Waves, 2018. (ISBN 978-1-947641-17-4)