Bactérie de forme L
Habituellement, les bactéries possèdent une paroi qui joue un rôle majeur pour leur intégrité (contrôle de la pression osmotique interne), protection (contre les UV, la déshydratation, les oxydants, etc.), et pour leur reproduction (par scissiparité) ; le squelette externe d'une bactérie représente habituellement de 25 à 35 % de son poids total[1]. Les bactéries de « forme L » sont des souches de bactéries ne présentant pas de parois cellulaires[2] ou une paroi quasi inexistante[3].

Vocabulaire
modifierDe manière générale, une bactérie ayant perdu sa paroi prend une forme sphérique dite :
- « protoplaste » s'il s'agit d'une bactérie à Gram positif ;
- « sphéroplaste » s'il s'agit d'une bactérie à Gram négatif. la paroi elle est élastique et rigide
On parle aussi parfois de phytoplasme.
Les anglophones nomment les bactéries viables sans parois :
- L-form bacteria ;
- L-phase bacteria ;
- L-phase variant ;
- cell wall deficient (CWD) bacteria (ne pas confondre CWD avec l'acronyme de Chronic wasting desease).
Découverte
modifierCes bactéries ont été isolées en 1935 par la biologiste Emmy Klieneberger-Nobel.
Elle les a nommées « L-form bacteria » après le Lister Institute de Londres, où elle travaillait[4].
Typologies
modifierDeux types de L-formes sont distinguées :
- Les L-formes « instables » qui sont des sphéroplastes capables de se diviser en produisant des L-formes, mais qui peuvent aussi revenir à la morphologie initiale et stable de la bactérie ;
- L-formes stables, qui ne semblent pas naturellement capables de produire dans leur descendance la forme originale de la bactérie.
Quelques espèces parasites de bactéries, dont les mycoplasmes ne présentent pas de paroi cellulaire[5], mais ne sont pas considérées comme L-formes, car non dérivées de bactéries ayant normalement des parois cellulaires.
Les molécules constituant les parois cellulaires varient fortement selon les espèces et plus encore selon les règnes considérés. Chez les plantes et les champignons, ils peuvent aussi varier selon les types cellulaires et le stade de développement.
Chez les plantes, la cellulose est le constituant principal ; chez les bactéries, ce sont des peptidoglycanes, chez les Archées, des glycoprotéine ou pseudopeptidoglycanes ou polysaccharides les constituent. Les champignons possèdent des parois cellulaires faite de la chitine alors que les algues possèdent généralement des parois faites des glycoprotéines et des polysaccharides. Les diatomées utilisent quant à elles l'acide silicique.
Il est possible que ces bactéries ou certaines d'entre elles aient quand même une paroi diaphane et très fragile. En effet, des études plus poussées en chromatographie en phase liquide ont montré qu'au moins dans un cas, des peptidoglycanes étaient quand même synthétisés par la cellule mais en très petite quantité (7 % de la quantité présente dans une bactérie normale). De plus, on a montré que la formation de colonies de mutants sans parois exige du D-glutamate, du diaminopimélate qui sont également spécifiques à la synthèse de peptidoglycanes[3].
Apparence et division cellulaire
modifier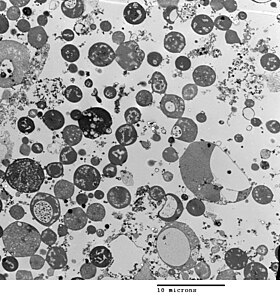

La morphologie bactérienne est déterminée par la paroi cellulaire. Les formes-L étant dépourvues de paroi cellulaire, leur morphologie est différente de la souche de bactéries dont elles sont dérivées. Typiquement les cellules de souches « L » sont des sphères ou sont sphéroïdes. Par exemple, la forme-L- de Bacillus subtilis qui a normalement une forme de tige, est une bactérie ronde[6].
Même si les L-formes peuvent se développer à partir de bactéries Gram-positives aussi bien que de bactéries Gram-négatives, la L-forme est toujours Gram-négative, en raison de l'absence de paroi cellulaire.
La paroi cellulaire joue normalement un rôle important lors de la division des cellules qui, chez la plupart des bactéries, se produit par scissiparité. L'absence de paroi cellulaire chez les formes- L-devraient rendre leur reproduction impossible. Elle est pourtant possible, bien que désorganisée, et produisant des cellules-filles d'une grande variété de tailles (de beaucoup plus petite à plus grande que la bactérie « normale »).
Chez les bactéries, la division cellulaire nécessite habituellement une paroi cellulaire et des composants spéciaux du cytosquelette bactérien telles que FtsZ. La capacité des bactéries de forme-L à croitre et se diviser en l'absence de ces deux structures est très rare et pourrait être une relique d'une forme de division cellulaire qui a été importante dans le passé, pour les premières formes de vie[2]. Ce mode de division alternatif semble impliquer l'extension de fines protubérances de la surface cellulaire qui croissent, se « pincent » et se cassent pour former de nouvelles cellules.
Cultures de Formes-L
modifierDes bactéries L-formes peuvent être artificiellement produites en laboratoire à partir de nombreuses espèces de bactéries qui ont généralement des parois cellulaires, comme Bacillus subtilis ou Escherichia coli. Cela se fait de deux manières :
- la méthode classique consiste à inhiber chimiquement la synthèse du peptidoglycane, soit avec certains antibiotiques, soit en traitant les cellules avec du lysozyme, une enzyme qui digère les parois cellulaires ;
- Une autre méthode combine des nanotechnologies aux principes de l'écologie du paysage. Des dispositifs de microfluidique peuvent être construits en vue d'inhiber la synthèse du peptidoglycane par un microconfinement spatial. Après une dispersion biologique via un micro-corridor biologique (d'échelle submicronique) reliant des microhabitats adjacents, des cellules de type L-form peuvent être constituées[7],[8].
Conditions de survie
modifierFaute de parois, les formes-L sont osmosensibles et donc vulnérables à tout changement de salinité de leur milieu de vie.
Dans tous les cas, les L-formes doivent être élevées dans un milieu de culture de même osmolarité que celle du cytosol bactérien (une solution isotonique), pour éviter la lyse des cellules par choc osmotique[4].
Les souches-L ainsi produites peuvent être instables, tendant à revenir à la forme normale de la bactérie en restaurant une paroi cellulaire, mais cela peut être empêché par la culture à long terme des cellules dans des conditions similaires à celles qui ont été utilisées pour les produire[9].
Des mutations se produisent plus souvent et plus facilement chez les souches dérivées de bactéries normales, ce qui a été montré par plusieurs études[2],[4].
Une mutation d'une enzyme impliquée dans la voie du mévalonate dans le métabolisme lipidique a augmenté la fréquence d'apparition de formes-L-de 1000 fois[2]. Le mécanisme n'est pas connu, mais cette enzyme est connue pour être importante dans la synthèse de peptidoglycanes à partir de lipides.
Enjeux et applications
modifierLes formes-L de certaines bactéries pourraient être utiles pour :
- les recherches portant sur les premières formes de vie ;
- les biotechnologies ;
- en médecine, pour mieux comprendre certains mécanismes de résistance bactérienne face à certains antibiotiques (qui détruisent les parois cellulaires), ou face au système immunitaire (si la protéine reconnue par le système immunitaire est une protéine de la paroi cellulaire, la bactérie peut provisoirement échapper aux globules blancs en se débarrassant de ses parois).
Risques ? Des laboratoires peuvent créer des souches-L n'ayant jamais été trouvées dans la nature. Certaines publications ont fait valoir que des formes-L de certaines bactéries peuvent causer des maladies chez l'homme (dont la maladie de Lyme), mais les preuves de lien de cause à effet sont encore fragmentaires et souvent contradictoires, cette hypothèse reste donc controversée[10],[11].
Deux points de vue extrêmes sont encore à départager :
- certains estiment que les bactéries-L ne sont que des curiosités biologiques et de laboratoire, sans importance clinique ;
- d'autres pensent au contraire qu'elles sont importantes, car causes probables ou méconnues de maladie ou de résistance bactérienne[12].
Les recherches sur les formes- L-de bactéries se poursuivent notamment depuis qu'on a observé dès les années 1980 (après inoculation expérimentale) des formes-L de Nocardia caviae se développer dans les poumons intacts de souris[13], et également capables de développer des mycétomes chez des souris immunodéprimées mais aussi chez des souris saines[14].
Une étude plus récente suggère que de tels organismes peuvent infecter les patients immunodéprimés ayant subi une greffe de moelle osseuse[15].
La formation de souches de bactéries dépourvues de parois cellulaires pourrait aussi jouer un rôle important dans l'apparition d'antibio-résistances bactériennes et notamment dans la résistance croissante aux bêta-lactamines de la part de différentes souches de staphylocoques dorés[16].
Ces souches sont en cours d'examen pour des utilisations possibles en biotechnologie ; comme souches hôtes pour l'expression de protéines recombinantes par exemple[17]. Ici, ce qui intéresse l'industrie est que l'absence d'une paroi cellulaire peut permettre la production de grandes quantités de protéines sécrétées qui s'accumuleraient dans le périplasme des bactéries[18],[19], sachant aussi que l'accumulation de protéines dans cet espace périplasmique peut être toxique pour la bactérie, ce qui pourrait réduire le rendement d'une production transgénique par ce type de bactéries.
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- (en) Errington Group (Université de Newcastle)
- (en) Scientists explore new window on the origins of life Communiqué de presse (2009) de l'université de Newcastle
Bibliographie
modifier- Domingue, Gerald J. Cell wall-deficient bacteria: basic principles and clinical significance ; Ed : Addison-Wesley Pub. Co ; Reading, Mass ; 1982 ; (ISBN 0-201-10162-9) ;
- Mattman, Lida H. ; Cell wall deficient forms: stealth pathogens ; Ed : CRC ; Boca Raton ; 2001 ; (ISBN 0-8493-8767-1) (Voir)
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « L-form bacteria » (voir la liste des auteurs).
- L'anatomie des bactéries élément d'un cours de bactériologie du CHU Pitié-Salpetrière (consulté : 2010/02/21)
- Leaver M, Domínguez-Cuevas P, Coxhead JM, Daniel RA, Errington J ; Life without a wall or division machine in Bacillus subtilis ; journal Nature ; volume = 457 ; issue=7231 ; pages = 849–53; février 2009 ; ; doi:10.1038/nature07742
- Danièle Joseleau-Petit, Jean-Claude Liébart, Juan A. Ayala, and Richard D'Ari ; "Unstable Escherichia coli L Forms Revisited: Growth Requires Peptidoglycan Synthesis" ; Journal of Bacteriology, September 2007, p. 6512-6520, Vol. 189, No. 18 ; doi:10.1128/JB.00273-07
- Joseleau-Petit D, Liébart JC, Ayala JA, D'Ari R Unstable Escherichia coli L forms revisited: growth requires peptidoglycan synthesis ; journal : J. Bacteriol. ; volume=189 ; issue=18 ; pages=6512–20 ; Sept. 2007 ; ; pmc:2045188 ; doi:10.1128/JB.00273-07
- Razin S, Yogev D, Naot Y ; "Molecular biology and pathogenicity of mycoplasmas" ; journal ; Microbiol. Mol. Biol. Rev. ; volume=62 ; issue=4 ; pages=1094–156 ; décembre 199 ; ; pmc=98941 ;
- Gilpin RW, Young FE, Chatterjee AN "Characterization of a stable L-form of Bacillus subtilis 168" ; journal : J. Bacteriol. ; volume 113 ; issue=1 ; pages=486–99 ; janvier 1973 ; ; pmc:251652
- micro habitat patches
- Männik J., R. Driessen, P. Galajda, J.E. Keymer, C. Dekker ; "Bacterial growth and motility in sub-micron constrictions" ; journal : PNAS ; volume=106 ; issue=35 ; pages=14861-14866 ; Sept. 2009 ; doi:10.1073/pnas.0907542106
- Allan EJ "Induction and cultivation of a stable L-form of Bacillus subtilis "journal:J. Appl. Bacteriol. ;volume=70 ;issue=4 ;pages=339–43 ; avril 1991
- Onwuamaegbu ME, Belcher RA, Soare C ; "Cell wall-deficient bacteria as a cause of infections: a review of the clinical significance" ; journal=J. Int. Med. Res. ; volume=33 ; issue=1 ; pages=1–20 ; 2005 ;
- Casadesús J ; Bacterial L-forms require peptidoglycan synthesis for cell division ; journal : Bioessays ; volume=29 ; issue=12 ; pages=1189–91 ; Dec. 2007 ; ; doi:10.1002/bies.20680
- Domingue, Gerald J. Cell wall-deficient bacteria: basic principles and clinical significance ; Ed : Addison-Wesley Pub. Co ; Reading, Mass ; 1982 ; (ISBN 0-201-10162-9)
- Beaman BL ; Induction of L-phase variants of Nocardia caviae within intact murine lungs ;journal=Infect. Immun. ;volume=29 ;issue=1 ;pages=244–51 ; juillet 1980 ; ; pmc:551102
- Beaman BL, Scates SM ; Role of L-forms of Nocardia caviae in the development of chronic mycetomas in normal and immunodeficient murine models ; journal=Infect. Immun. ; volume=33 ; issue=3 ; pages=893–907 ; septembre 1981 ; ;pmc:350795
- Woo PC, Wong SS, Lum PN, Hui WT, Yuen KY ; "Cell-wall-deficient bacteria and culture-negative febrile episodes in bone-marrow-transplant recipients" ; journal: The Lancet ; volume=357 ; issue=9257 ; pages=675–9 ; Mars 2001 ; ; doi:10.1016/S0140-6736(00)04131-3
- Fuller E, Elmer C, Nattress F et al. ; Beta-lactam resistance in Staphylococcus aureus cells that do not require a cell wall for integrity" ; journal=Antimicrob. Agents Chemother. ;volume=49 ;issue=12 ;pages=5075–80 ; Dec. 2005 ; ; pmc:1315936 ; doi:10.1128/AAC.49.12.5075-5080.2005
- Gumpert J, Hoischen C ; Use of cell wall-less bacteria (L-forms) for efficient expression and secretion of heterologous gene products ; journal:Curr. Opin. Biotechnol. ; volume=9 ; issue=5 ; pages=506–9 ; Oct 1998 ; ; doi:10.1016/S0958-1669(98)80037-2
- Rippmann JF, Klein M, Hoischen C, 'et al ; Procaryotic expression of single-chain variable-fragment (scFv) antibodies: secretion in L-form cells of Proteus mirabilis leads to active product and overcomes the limitations of periplasmic expression in Escherichia coli ; journal : Appl. Environ. Microbiol. ;volume=64 ;issue=12 ;pages=4862–9 ; 1 December 1998 ; ; pmc:90935
- Choi JH, Lee SY ; Secretory and extracellular production of recombinant proteins using Escherichia coli ; journal=Appl. Microbiol. Biotechnol. ; volume=64 ; issue=5 ; pages=625–35 ; juin 2004 ; ; doi:10.1007/s00253-004-1559-9