Bursaphelenchus xylophilus
Nématode du pin
- Aphelenchoides xylophilus Steiner & Buhrer, 1934[2]
Bursaphelenchus xylophilus, communément appelé le Nématode du pin, est une espèce de vers nématodes de la famille des Parasitaphelenchidae. Ce nématode transparent, long de moins d'un millimètre, décrit en 1934, supposé d'origine nord-américaine est aujourd'hui cosmopolite.
C'est un ver mycophage, mais qui dans certaines circonstances peut parasiter des coléoptères et attaquer certaines cellules du bois de pins vivant. Il est alors responsable d'une maladie dite « maladie du nématode du pin » (ou « pine wilting disease » pour les anglophones), destructrice de millions de Pins au Japon et en Chine depuis les années 1950.
Systématique
modifierL'espèce Bursaphelenchus xylophilus a été initialement décrite en 1934 par Gotthold Steiner (d) (1886-1961) et Edna M. Buhrer (d) sous le protonyme d’Aphelenchoides xylophilus[2],[3]
Étymologie
modifier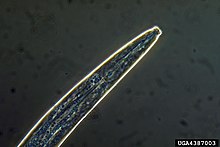
Son nom d'espèce signifie « qui aime le bois ». Il lui a été donné car c'est une espèce qu'on trouve dans le bois de certains résineux malades ou morts[4],[5].
Il a aussi été nommé :
- Bursaphelenchus xylophilus (Steiner & Buhrer) Nickle[6]
- Bursaphelenchus lignicolus (Steiner & Buhrer, 1919), Mamiya & Kiyohara
Description et identification
modifierLe Nématode du pin est translucide et mesure un peu moins d’un millimètre de long
Les premiers critères utiles sont morphologiques (forme des spicules, de la bourse, de la vulve, de l'extrémité de la queue de la femelle et du stylet), mais distinguer à l'œil nu ce nématode d'autres espèces non pathogènes du même genre (Bursaphelenchus) est impossible en raison de morphologies très semblables. Seule une analyse moléculaire basée sur les ADN permet de le différencier avec certitude[7].
Espèces proches ou sous-espèces
modifier
Plusieurs espèces proches de ce nématode sont connues. L'étude[8] d'interfertilité de différentes souches, par croisements réciproques en laboratoire, permet de distinguer quatre souches du nématode du pin (Bursaphelenchus spp) :
- une souche de B. xylophilus (à queue arrondie ou forme "R"), provenant du Japon
- une souche de B. mucronatus (à queue mucroné ou forme "M"), provenant du Japon
- une souche française morphologiquement identique à B. mucronatus, trouvée chez Pinus pinaster dans la forêt landaise
- une souche nord-américaine isolée chez Abies balsamea dans le Minnesota, proche de B. mucronatus, et qui selon Wingfield et al. (1983) peut s'hybrider avec B. xylophilus mais non pas avec B. mucronatus.

Il y a isolement reproductif de B. mucronatus et B. xylophilus. La souche française donne des hybrides fertiles avec les deux B. mucronatus et B. xylophilus, et des hybrides fertiles avec la souche du Minnesota quand les parents sont laissés à la F1, mais pas quand ils sont séparés d'elle.
Une hypothèse est que les souches japonaises et américaines sont issues d'ancêtres de l'Europe occidentale, et que les populations existantes forment désormais un « cercle des espèces »[9] qui a été fermé au début du XXe siècle par l'introduction de la souche américaine au Japon. Une supra-espèce a été proposée, pour grouper les populations actuelles du nématode du pin[8].
D'autre espèce ont été récemment décrites :
- en Europe (Bursaphelenchus sp hellenicus. n. trouvé[10] dans le bois d'un pin (Pinus brutia) mourant et également infecté par Blastophagus piniperda et une moisissure (bleuissement du bois) à Thessalonique, en Grèce, par Leoni, B., en 1996…
- en Asie[11] en Chine, à partir d'isolat de bois mort de pin :
- Bursaphelenchus aberrans n. sp.
- Bursaphelenchus thailandae n. sp.
Alimentation
modifier
Mycophage, c'est-à-dire « consommateur de champignons », ce nématode peut aussi consommer des cellules végétales vivantes. Il semble ainsi pouvoir parasiter certains résineux de deux manières :
- directement ; on le dit alors « parasite primaire » ;
- secondairement ou comme parasite associé à un champignon du bois, dont le champignon du bleuissement transmis par des insectes (scolytes en général)[12] ; on le dit alors « parasite secondaire ».
Il peut être présent dans des arbres « asymptomatiquement » porteurs :
- inoculé expérimentalement dans le tronc de Pin sylvestre d'une plantation du Vermont aux États-Unis en 1987, on le retrouve encore six ans après chez des pins apparemment en bonne santé[13] ;
- dans une autre expérience, cent Pins sylvestres âgés de 20 ans sont inoculés avec B. xylophilus (isolat extrait de Pin sylvestre) pour évaluer la persistance du nématode dans l'arbre hôte. Dix arbres sont inoculés à dix dates différentes, entre le 1er juin et le 14 septembre 1987. L'inoculation est mise en place par deux blessures perforées avec une mèche dans le tronc de chaque arbre et environ 30 000 nématodes sont inoculés dans chaque plaie. En outre, dix arbres-témoins sont inoculés sur chacune des trois dates avec une solution sans nématodes. Chaque arbre est visuellement évalué chaque année et échantillonné périodiquement entre 1987 et 1992. B. xylophilus est extrait des arbres vivants asymptomatiques jusqu'à 5 ans après l'inoculation ainsi que des arbres morts, mais pas des sujets témoins. Le nématode est le plus souvent extrait des arbres inoculés le 7 juillet et le [14].
Espèce invasive
modifier
B. xylophilus est une espèce considérée comme invasive, qui est en pleine expansion depuis plusieurs décennies et qui fait maintenant l'objet de mesures de quarantaine et désinfection obligatoire des bois. Elle est probablement favorisée et diffusée par les enrésinements, les monocultures de pins, le transport par l'Homme de grandes quantités de bois infecté et peut-être par les pollutions de l'air telles que les pluies acides, l'ozone troposphérique et, d'un point de vue général, les dérèglements climatiques ; mais certaines espèces de pins y sont nettement plus sensibles.
La maladie causée par ce ver est découverte en Amérique du Nord en 1929[15] et l'espèce scientifiquement décrite en 1953.
Aux États-Unis, il ne provoque initialement que des dégâts très limités à l'exception des pins exotiques[11]). Puis, involontairement introduit au Japon, il infecte rapidement près d'un tiers des surfaces enrésinées du pays. La maladie (mais pas son agent pathogène) y est décrite pour la première fois 1905 par Yano, à la suite d'un dépérissement de pins dans la région de Nagasaki. Plus de 26 millions de m3 de bois de résineux sont gâchés par ce nématode entre la Seconde Guerre mondiale et le début des années 2000[16],[17],[18],[19].
Cet agent pathogène est connu des États-Unis et du Canada, ainsi que du Mexique d'Asie et du Japon. Durant la décennie 1980, il colonise rapidement Taïwan, la Corée (avec une première identification en 1988 dans la région de Pusan et la Chine, où il aurait tué environ 35 millions de pins entre 1980 et 2000. Il pourrait être présent en Asie depuis le tout début du XXe siècle[20].
En 1999, il est repéré en Europe où il semble être entré via le Portugal, au sud de Lisbonne. Malgré des mesures de contrôle, des traitements nématicides et l'établissement d'une « zone tampon », ce nématode gagne tout le pays en cinq ans environ et estsignalé en Espagne dès 2007.
Habitat
modifier
Ce nématode consomme des champignons forestiers et mène également une vie parasitaire au détriment de plusieurs espèces de conifères, particulièrement les Pins. Il les infecte en circulant dans les vaisseaux de sève qu'il peut parfois bloquer, ce qui peut entraîner la mort des arbres appartenant aux espèces les plus sensibles, en moyenne en deux mois dans ce cas.
Aux États-Unis, les espèces les plus sensibles semblent être Pinus nigra, Pinus sylvestris et Pinus thunbergii[21]. Le nématode ne commet pas de gros dégâts en Amérique du Nord, même dans l'est où il est le plus présent, mais il a des conséquences économiques à cause des blocus imposés aux bois non traités par l'Europe ou certains pays asiatiques.
En Europe où il n'est pour le moment présent qu'au sud des Pyrénées, les espèces les plus sensibles seraient selon l'INRA :
- le Pin maritime (Pinus pinaster) ;
- le Pin noir (Pinus nigra) ;
- le Pin sylvestre (Pinus sylvestris), le plus répandu. C'est une espèce plutôt thermophile dont le caractère envahissant pourrait être renforcé par le réchauffement climatique et certaines pratiques sylvicoles.
Cycle de vie / reproduction
modifier
Quand les conditions sont bonnes pour l'espèce, le nombre d'individus par cm³ de bois peut être élevé. Lors d'échantillonnages de terrain faits au Portugal de 1996 à 1999, dans des pins également attaqués par des coléoptères (Curculionides, Cérambycides et Scolytes), leur nombre s'éleva jusqu'à 38 000 nématodes par 10 g de bois de pin[22].
Son cycle de vie est typique de la plupart des espèces de nématodes ; il a quatre stades vermiformes juvéniles (dits J1 à J4), suivis d'un stade adulte « amphimictique » où les mâles et les femelles sont différenciés.
Ce cycle de vie est effectué dans le bois mort ou mourant alors que le nématode est en phase dite « mycophage », c'est-à-dire qu'il se nourrit de champignons xylophages ou saproxylophages qui décomposent la lignine et la cellulose.
Le nématode du pin semble très peu mobile dans l'environnement, sensible à la déshydratation, et incapable d'atteindre de lui-même les arbres voisins, sauf peut-être très exceptionnellement quand des troncs blessés se touchent ;
Pour atteindre un autre arbre-hôte, vivant ou mort, il a deux possibilités :
- passer par le sol pour infecter des racines (et il peut être dispersé sur le sol via copeaux, rémanents et sciures infestés. On a montré qu'il peut infecter les plants de pins par leurs racines à partir de copeaux) ;
- se faire transporter (éventuellement avec des spores de champignons) par un vecteur[16],[23] animal ou même humain (outils de taille, transport de bois).
Dans sa région d'origine, il semble que les résineux sauvages aient développé une immunité contre cette espèce, comme contre la plupart des nématodes du sol, mais des résineux importés en tant qu'essences décoratives sont fréquemment tués par ce parasite. Dans la nature ce nématode peut passer d'un arbre à l'autre en étant véhiculé par des coléoptères dont il est parasite ou commensal, comme des longicornes du genre Monochamus. D'autres insectes ravageurs comme les Scolytes sont aussi vecteurs du nématode. Enfin, il est démontré[24] que les Monochamus porteurs de ce parasite volent moins bien et que leurs femelles se reproduisent moins bien.
Selon des études récentes faites par des chercheurs français et chinois, c'est le transport par l'Homme du bois sur de grandes distances qui a permis l'extension récente et rapide de ce nématode dans le monde. On en a par exemple trouvé dans des pins transportés par bateau d'Amérique en Europe[11].
Influence de la température sur la reproduction
modifierIl semble que l'isotherme de 20 °C comme température moyenne durant les mois d'été soit une limite au-delà de laquelle ce nématode peine à se développer[25]. Il est possible que la rareté des pins en climat chaud soit pour partie liée à des nématodes. On a constaté, au Japon notamment que les infestations suivaient des étés particulièrement chauds[21]. On a confirmé en laboratoire que la température influait fortement sur le cycle de développement du nématode, à chacun de ses stades[26]. Des copeaux de bois de Pinus strobus ensemencés de nématodes B. xylophilus ont été incubés à 3, 12, 30 ou 40 °C durant des périodes de 47, 82 et 130 jours. À 40 °C, les nématodes n'ont pas survécu (un bon compostage atteint et dépasse cette température). C'est à 3 °C que le plus grand nombre de nématodes a survécu[26]. Le nombre et le taux de juvéniles du cycle de multiplication était le plus élevé à 3 °C après 47 jours, mais le taux était le plus élevé à 30 °C, après 130 jours[26]. Un nombre plus élevé de larves L3 (jusqu'à 85 %), ont été extraites à 3 et 12 °C qu'à 30 °C vers la fin de l'étude. Des « larves Dauer » ont été trouvées dans les échantillons, mais toujours moins de 5 % du total. Le taux d'adultes était plus élevé à 30 °C qu'à 3 et 12 °C après 82 et 130 jours[26]. Un « traitement thermique » (exposition à 30 °C durant une semaine) a été appliqué à des échantillons préalablement incubés à 3 et 12 °C, le nombre et le taux d'adultes a alors augmenté. Le taux de "Dauer-larves" a très légèrement augmenté quand le traitement thermique a été appliqué après 47 jours[26].
Effet du taux d'humidité du bois sur la reproduction
modifierDes sacs de copeaux de bois de Pinus strobus à des taux d'humidité de 38, 92, 164 et 217 % (du poids sec) ont été inoculés avec Bursaphelenchus xylophilus et incubée à 30 °C[27]. Les nématodes en ont été extraits et étudiés après 2, 4, 8 et 12 semaines. L'expérience a montré que ce nématode se développe mieux dans le bois le plus sec. Le nombre de nématodes était le plus élevé dans les échantillons à taux d'humidité de 38 % et il diminuait au fur et à mesure que les échantillons étaient plus humides[27].
De plus la population croît quatre fois plus vite dans les bois secs qu'humides ; dans les copeaux des trois sacs les moins humides, le pic de population a culminé après 15 jours d'incubation, alors qu'à 217 % d'humidité, la population était moindre et n'atteignait son maximum qu'après 8 semaines[27]. Après 12 semaines, les populations de nématodes ont baissé dans les copeaux de bois plus humides (92 et 164 % d'humidité) [27]. Dans cette expérience, les champignons les plus fréquemment isolés dans le bois ont été des genres Alternaria, Fusarium, Gliocladium, Graphium, Penicillium, Trichoderma, et Mucorales[27].
Les canicules et le drainage (fréquent sur les parcelles cultivées) pourrait donc favoriser les infestations importantes et plus rapides, de même que l'absence de lisière végétalisée, propice à la déshydratation par le vent et le soleil.
Vecteurs animaux
modifier
Au delà des déplacements liés à l'Homme, le nématode du pin semble pouvoir être transporté par plusieurs espèces de scolytes et de coléoptères pondant dans le bois ; il semble par exemple être souvent associé à des espèces du genre Monochamus, qu'il parasite également.
Dans une étude[28] faite dans le Missouri sur le pin d'Écosse, sept espèces de coléoptères ont été trouvés porteuses du nématode du pin. Dans ce cas, celui qui transportaient le plus grand nombre de nématodes était un grand cérambycidé (Monochamus carolinensis) avec en moyenne (± écart-type) 19,152 nématodes (± 16421) par individu. Aucune des autres espèces d'insectes ne portait plus de 300 nématodes par individu.
Parmi les nématodes transportés par M. carolinensis, 85 % étaient présents dans la région thoracique, avec une majorité dans le segment métathoracique. La microscopie électronique à balayage a montré que ces nématodes étaient localisés dans le système trachéal des Monochamus sortant d'un arbre infecté. Les Monochamus sont bien plus volumineux que les scolytes, et il est donc normal qu'ils transportent beaucoup plus de vers quand ils sont infectés. Mais les scolytes sont des centaines de fois plus nombreux que les Monochamus et leurs populations semblent en forte augmentation depuis quelques décennies. Il est donc difficile à ce jour d'établir la part respective de responsabilité des gros ou petits insectes dans la propagation du nématode.
Les Monochamus pondent leurs œufs dans l'écorce du bois mort. Leur larve en grandissant se nourrit en descendant dans le bois, et en fin de cycle de vie nymphose dans une cavité qu'elle a creusée. La larve du nématode au stade J3 se rassemble dans cette cavité autour de la nymphe du coléoptère. Le nématode au stade J4 infecte alors l'insecte émergeant en migrant dans sa trachée au travers ses stigmates. Pendant cette phase « dispersive », le coléoptère peut transporter le nématode du pin et l'inoculer lorsqu'il pond ses œufs dans l'écorce. Il pourrait aussi véhiculer des nématodes en phase mycophages vers des arbres morts ou les parties mortes d'arbres dépérissant[16],[23].
Des Monochamus notatus adultes (Mn) et Monochamus scutellatus (Ms) ont été récoltés dans deux sites au centre et au nord du Vermont en début et fin d'été (le 4 juin et le ) [29] ; Le jour de récolte, le sexe des coléoptères a été identifié et les insectes ont été séparément placés dans de l'eau distillée durant 24 heures pour en extraire les larves du nématode Bursaphelenchus xylophilus.
Le taux d'infestation était presque identique pour les 2 espèces de coléoptères (51 % pour Mn et 56 % pour Ms), mais le Ms contenait un nombre moyen plus élevé de « larve dauer » (5450 contre 595). La fréquence d'infestation était indépendante du sexe, pour chaque espèce de coléoptère, et sans différence de nombre moyen de larves entre les sexes au sein de chaque espèce de Monochamus. Chez Monochamus scutellatus, la fréquence d'infestation des adultes mâles était tributaire du temps, et le nombre moyen des « dauerlarvae » chez ces mâles semble décliner après le premier mois. Par contre, il n'y avait aucune différence dans la fréquence d'infestation ou le nombre moyen de dauerlarvae effectuées pour les Ms femelles soupçonnées de contribuer à diffuser le nématode lorsqu'elles pondent.
Relation hôte parasite
modifierLa transmission primaire serait souvent initiée par un insecte qui en se nourrissant de bois de pins sensibles au nématode, y inocule le nématode.
Ce dernier pénètre l'arbre par les vaisseaux de sève et s'y nourrit des cellules épithéliales qui tapissent les conduits de résine. C'est ce qu'on appelle la phase « phytophage du nématode du pin ». Ceci se traduit par un flétrissement, parfois assez rapide (en 2 mois) du pin, avec de premiers symptômes dans les semaines suivant l'infection (brunissement et mort éventuelle de l'arbre).
En 2009, il n'y a pas de consensus sur le degré de sensibilité de nombreuses espèces ou souches de pin, mais une sensibilité particulière du pin à ce nématode a été démontrée (en utilisant des postulats de Koch) chez un petit nombre d'espèces comprenant Scotch pine, Slash pine, pin rouge japonais, et pin noir japonais. Le Slash pine est la seule espèce autochtone qui soit sensible à ce nématode en Amérique du Nord, et elle est modeste par rapport à celle des 3 autres espèces sensibles trouvées à ce jour dans le monde.
Pathogénicité
modifier
Oku et ses collègues[30] avaient exposé de jeunes pins sains à une solution de molécules extraite de pins (Pinus thunbergii) infectés par ce nématode. Certaines de ces molécules n'étaient pas trouvées chez les arbres sains. Ceci suffisait à induire les mêmes symptômes que ceux des arbres infectés, laissant supposer qu'une toxine pouvait expliquer la maladie.
Dans les années 1980, des travaux conduits sur des pins sylvestres infectés et non infectés ont effectivement suggéré que B. xylophilus sécrète une molécule (huileuse, non acide et de faible poids moléculaire) qui est phytotoxique[31]. C'est cette toxine qui pourrait être la cause du flétrissement des pins, par inhibition du transport de l'eau dans l'arbre [31], ce qui diminue également l'évapotranspiration [32] et la sécrétion de résine protectrice. Par ailleurs, d'autres expériences ont montré que ce nématode se développe mieux dans le bois plutôt sec[33]. L'arbre en état de stress hydrique émet des hormones qui peuvent attirer les scolytes, lesquels peuvent importer puis exporter d'autres nématodes.
Gestion du risque et de la maladie
modifierLa maladie du pin a un impact direct sur l'économie sylvicole, qui à ce jour et dans cette partie du monde ne trouve comme réponse qu'un autre aménagement paysager (limitation des monocultures de pins, choix d'espèces non sensibles, précautions (désinfection des matériels forestiers, surveillance et embargo sur les troncs « contaminés »[16],[23].
Des embargos de protection ont été imposés par l'Union européenne sur le bois non traité transporté depuis les États-Unis et le Canada, qui ont abouti à une diminution des gains directs pour les exportateurs américains.
On ne connaît pas à ce jour de remède à cette maladie. La gestion de cette crise sylvicole se focalise donc sur la veille et la prévention de la propagation du nématode du pin.
- Les arbres infectés sont coupés et brûlés ou en copeaux d'alimentation de chaudières ;
- le bois naturel est dépouillé de son écorce pour empêcher la ponte des vecteurs ;
- le bois expédié à l'étranger subit une fumigation nématicide[11] ou est séché au séchoir (ce qui tue les nématodes).
Malgré ces mesures de prévention le nématode du pin a récemment surgi au Portugal[22] puis en Espagne et menace de s'étendre à d'autres pays d'Europe[16],[18],[19],[23].
L'Europe exige de certains États membres concernés qu'ils prennent des mesures[34].
Impacts économiques
modifierLe seul moyen de limiter sa dispersion étant pour le moment la mise sous embargo puis le traitement des bois contaminé, il prive les pays touchés de certains revenus liés à l'exportation de résineux. L'extension de la maladie pourrait également poser problème pour les papeteries utilisant du pin comme source de fibres et pour la valorisation du « mulch » d'écorces de pins (qu'il faut éviter d'épandre près des pins dans les zones à risque).
Écoépidémiologie
modifierPour mieux comprendre et anticiper l'extension d'aire de ce nématode, des chercheurs ont cherché à modéliser ses capacités de déplacement dans l'environnement. Localement, son transport par l'homme (dans le bois coupé, les rémanents forestiers, les copeaux, etc.) ou par des insectes lui permet, selon les modèles existant de s'étendre sur des distances ne dépassant pas 7,5 km par an.
Cependant, quand il est bien installé (environ 6 ans après son arrivée), de nouveaux foyers apparaissent à des distances de 100 à 300 km des seules zones sources connues.
Les Chinois ont étudié la diffusion du nématode du pin en Chine de 1982 à 2005. Ils ont montré que probabilité d’invasion par ce parasite était corrélée à plusieurs facteurs :
- délai après une invasion initiale ou antérieure (6 ans environ) ;
- densité de population humaine ;
- présence de voies de dispersion (qui ne sont pas les rivières, mais les voies ferrées, les ports) ;
- présence d'un lac et d'une densité élevée de population humaine.
La dispersion par l'Homme serait de loin le premier facteur expliquant ces invasions, loin devant la possible responsabilité du réchauffement climatique. Les étés chauds seraient aussi un facteur favorable.
Ce nématode est également parfois présent dans le sol (où il a été montré – en conditions expérimentales – capable de facilement pénétrer le réseau de sève des jeunes arbre via leurs racines blessées ou stressées, ce qui est fréquent pour les racines superficielles dans les plantations à la suite des passages d'engins, ou à la suite du stress subi par les racines périphériques au moment de la plantation, s'il ne s'agit pas de régénération naturelle).
- Pour étudier le rôle du sol sur son cycle de vie et sur sa prolificité[35], des copeaux de bois infestés par ce nématode ont été incubés à 12 et 20 °C, seuls et mélangés avec du sol. Les nématodes ont ensuite été échantillonnés tous les 15 jours durant 12 semaines.
Résultat : Le nombre de nématodes et le taux de larves au troisième stade étaient supérieurs dans les échantillons cultivés à 12 °C, sans sol.
Le taux de juvéniles aptes à se propager était supérieur à 20 °C et dans les échantillons incubés avec de la terre. Bien que B. xylophilus ait survécu 12 semaines dans les copeaux mélangés avec du sol, le nombre de nématodes et les taux de chaque stade a dans cette expérience peu évolué au fil du temps[35]. Pour savoir si B. xylophilus pouvait aussi infecter des racines blessées, des copeaux infestés et non infestées ont été mélangés avec de la terre dans des pots contenant des plants de pins. Ces arbres ont été maintenus à 20 et 30 °C, puis étudiés (à leur mortalité ou après un délai de 12 semaines pour ceux qui ne présentaient pas de symptômes de maladie). Seuls les plants « traités » avec des copeaux infestés contenaient des nématodes. Les sciures de tronçonneuses ou copeaux et rémanents infectés laissés par les engins d'entretien, coupe ou débardage et parfois enfouis dans le sol par eux pourraient dont être source de recontamination des plants par les racines.
- Les différentes espèces de pins présentent des sensibilités différentes au nématode. Une expérience in situ a consisté à pailler des semis avec des copeaux infestés pour étudier la capacité de ces nématodes à envahir des plaies au collet de la tige. Parmi ces arbres, le pin sylvestre s'est révélé plus sensible que les pins blancs ou rouges à l'infection et son taux de mortalité a été plus élevé[35].
Espèces proches, également trouvées dans les résineux
modifierSelon Gu et al. (2006)[36]
- Bursaphelenchus aberrans
- Bursaphelenchus arthuri
- Bursaphelenchus conicaudatus
- Bursaphelenchus doui
- Bursaphelenchus fungivorus
- Bursaphelenchus hofmanni
- Bursaphelenchus hylobianum
- Bursaphelenchus lini
- Bursaphelenchus mucronatus
- Bursaphelenchus pinasteri
- Bursaphelenchus rainulfi
- Bursaphelenchus singaporensis
- Bursaphelenchus thailandae
- Bursaphelenchus vallesianus
Publication originale
modifier- (en) G. Steiner et Edna M. Buhrer, « Aphelenchoides xylophilus n. sp., a nematode associated with blue-stain and other fungi in timber », Journal of Agricultural Research, Washington, Inconnu, vol. 48, no 10, , p. 949-951 (ISSN 0095-9758, OCLC 1754420, lire en ligne).
Liens externes
modifier- (en) Référence BioLib : Bursaphelenchus xylophilus (Steiner & Buhrer, 1934) (consulté le )
- (en) Référence NCBI : Bursaphelenchus xylophilus (Steiner & Buhrer, 1934) (taxons inclus) (consulté le )
- Yasuharu Mamiya Initial Pahtological Changes and Disease Development in Pine Trees Induced by the Pine Wood Namatode ; Ann. Phytopath. Soc. Japan 51 :546-555 (1985)
- (en) Référence Fauna Europaea : Bursaphelenchus xylophilus (Steiner & Buhrer, 1934) (consulté le )
- (en) Référence GISD : espèce Bursaphelenchus xylophilus
- (en) Référence NCBI : Bursaphelenchus xylophilus (taxons inclus)
Notes et références
modifier- BioLib, consulté le 14 janvier 2022
- NCBI, consulté le 14 janvier 2022
- Steiner et Buhrer 1934, p. 949-951
- UNL.edu
- UC Davis
- NJ. Fielding et HF. Evans, The pine wood nematode Bursaphelenchus xylophilus (Steiner & Buhrer) Nickle (=B. lignicolus Mamiya and Kiyohara): an assessment of the current position ; Forestry 1996 69(1):35-46; doi:10.1093/forestry/69.1.35 ; 1996, Institute of Chartered Foresters
- Judith H. Harmey & Matthew A. Harmey « Detection and Identification of Bursaphelenchus Species with DNA Fingerprinting and Polymerase Chain Reaction » PDF ; Journal of Nematology 25(3):406-415, 1993 ; The Society of Nematologists 1993.
- Georges De Guiran et Nadine Bruguier, Hybridization and Phylogeny of the Pine Wood Nematode (b uRsaphelenchus Spp.) ; Nematologica, Volume 35, Number 3, 1989, p. 321-330(10) ; Ed: BRILLDOI: 10.1163/002825989X00421 ; Station de Recherches de Nématologie et de Génétique moléculaire des Invertébrés, INRA-Antibes.
- Ticehurst, 1938.
- Skarmoutsos, G. ; Braasch, H. ; Michalopoulou, H. ; Bursaphelenchus Hellenicus Sp. N. (Nematoda, Aphelenchoididae) From Greek Pine Wood ; Nematologica, Volume 44, Number 6, 1998, p. 623-629(7) ; Ed : BRILL.
- Yusheng, Fang; Kan, Zhuo; Jun, Zhao Description of Bursaphelenchus aberrans n. sp. (Nematoda: Parasitaphelenchidae) isolated from pine wood in Guangdong Province, China ; Nematology, Volume 4, Number 7, 2002, p. 791-794(4) ; Ed : BRILL ; DOI:10.1163/156854102760402577.
- USDA Forest Service : Identification, Biology, Control and Management Resources ; Insects and Diseases of Trees in the South ; Bursaphelenchus xylophilus (Steiner & Buhrer) ; aout 2004 (Consulté 2009 12 11).
- Halik, S. and D.R. Bergdahl. 1994. Long-term survival of Bursaphelenchus xylophilus in living Pinus sylvestris in an established plantation. European Journal of Forest Pathology 24:357-363.
- Bergdahl, D.R. and S. Halik. 1993. Persistence of Bursaphelenchus xylophilus in living Pinus sylvestris. Phytopathology 83:242 (Abstr.).
- Communiqué de presse INRA, 2009 Première estimation des dommages écologiques et des coûts économiques occasionnés par les espèces invasives en Europe
- (en) Dwinell L.D., Nickle W.R. 2004. An Overview of the Pine Wood Nematode Ban in North America. USDA www.forestpests.org
- (en) Mota M.M., Vieira P.C. 2008. Pine Wilt Disease in Portugal. NemaLab-ICAM, Department of Biology, University of Evora. Evora, Portugal
- (en) Mota M.M., et al. 2008. Pine Wilt Disease: A Worldwide Threat to Forest Ecosystems. Springer (ISBN 9781402084546)
- (en) Suzuki K. 2002. Pine Wilt Disease: a threat to pine forest in Europe. Dendrobiology, Vol. 48. 71-74.
- (en) The Pinewood Nematode in Vermont, États-Unis
- (en) Bergdahl, D.R. 1988. Impact of pinewood nematode on North America: Present and future. Journal of Nematology 20:260-265.
- (en) Mota, Manuel M.; Braasch, Helen; Bravo, Maria Antonia; Penas, Ana Catarina; Burgermeister, Wolfgang; Metge, Kai; Sousa, Edmundo First report of Bursaphelenchus xylophilus in Portugal and in Europe ; Nematology, Volume 1, Numbers 7-8, 1999, p. 727-734(8).
- (en) Cram M., Hanson J. How to Identify and Manage Pine Wilt Disease and Treat Wood Products Infested by the Pinewood Nematodes, USDA
- (en) Akbulut, Suleyman; Linit, Marc J. [Flight Performance of Monochamus carolinensis (Coleoptera: Cerambycidae) with Respect to Nematode Phoresis and Beetle Characteristics] ; Environmental Entomology, Volume 28, Number 6, December 1999, p. 1014-1020(7); Ed : Entomological Society of America.
- (en) T.A. Rutherford, JM. Webster Distribution of pine wilt disease with respect to temperature in North America, Japan, and Europe (pdf), Can. J. For. Res. 17:1050-1059 ; Canada, Oct 1986 (accepté 1er avril 1987) ;
- (en) Tomminen, J., S. Halik and D.R. Bergdahl. 1991. Incubation temperature and time effects on life stages of Bursaphelenchus xylophilus in wood chips. Journal of Nematology 23:477-484
- (en) Halik, S. and D.R. Bergdahl. 1990. Development of Bursaphelenchus xylophilus populations in wood chips with different moisture contents. Journal of Nematology 22:113-118
- (en) Linit M. Kondo J. ; Smith, M.T. Insects Associated with the Pinewood Nematode, Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae), in Missouri ; Environmental Entomology, Volume 12, Number 2, April 1983, p. 467-470(4) ; Ed : Entomological Society of America.
- Bergdahl, D.R., S. Halik, J. Tomminen, and H. Akar. 1991. « Frequency of infestation of Monochamus notatus and M. scutellatus by Bursaphelenchus xylophilus in Vermont ». Phytopathology 81:120 (Abstr.)
- (en) Oku, H., T. Shiraishe, and S. Kurozuini. 1979. Participation of toxin in wilting of Japanese pines caused by a nematode. Naturwissenschaften 66:210.
- (en) F. SHAHEEN, R. E. K. WINTER, AND R. I. BOLLA ; Phytotoxin Production in Bursaphelenchus xylophilus-lnfected Pinus sylvestris ; Journal of Nematology 16(1):57-61. 1984. (PDF, 5 pages) ; Ed : The Society of Nematologists, 1984
- (en) Mamiya, Y., and H. Tamura. 1977. Transpiration reduction of pine seedlings inoculated with the pinewood nematode Bursaphelenchus Iignicolus. J. Jap. For. Soc. 59:59-63.
- (en) Suziki, K., and T. Kiyohara. 1977. Influence of water stress on development of pine wilting disease caused by Bursaphelenchus lignicolus. Eur. J. For. Path. 8:97-107.
- Bibliographie : Décision d'exécution de la Commission du 23 mars 2012 modifiant la décision 2006/133/CE exigeant des États membres qu'ils prennent provisoirement des mesures supplémentaires contre la propagation de Bursaphelenchus xylophilus (Steiner et Buhrer) Nickle et al. (nématode du pin) à partir des zones du Portugal autres que celles où son absence est attestée ; notifiée sous le numéro C(2012) 1844.
- (en) Halik, S. and D.R. Bergdahl. 1992. Survival and infectivity of Bursaphelenchus xylophilus in wood chip-soil mixtures. Journal of Nematology 24:495-503.
- J. Gu, H. Braasch, W. Burgermeister and J. Zhang ; Records of Bursaphelenchus spp. intercepted in imported packaging wood at Ningbo, China ; PDF, 11 pages, For. Path. 36 (2006) 323–333 ; 2006 T ; Journal compilation 2006 Blackwell Verlag, Berlin
