Carbocation
Un carbocation, parfois appelé ion carbonium ou ion carbenium (en fonction de sa structure), est un ion dérivé d'un composé organique, qui possède une charge électrique positive sur un ou plusieurs atomes de carbone. Les carbocations sont des intermédiaires de réaction.
On parle de carbocation primaire, secondaire ou tertiaire selon que l'on a sur le carbone chargé respectivement un, deux ou trois groupements autres que l'hydrogène.
Historique
modifierDécouverte - Halochromie
modifierL'étude des carbocations commence en 1902 quand les chimistes James Flack Norris et Kehrman découvrent indépendamment que lorsque des alcools de triphénylméthyl, incolores, sont mis en solution dans de l'acide sulfurique concentré, la solution prend une teinte jaune profonde. De même le chlorure de triphénylméthyl forme des complexes orange avec du chlorure d'étain ou d'aluminium. Johann Friedrich Wilhelm Adolf von Baeyer découvre en 1902 que les composés formés sont des sels.
- Ph3COH + H2SO4 → Ph3C+HSO4− + H2O (Ph signifie qu'il y a un substituant phényle)
Adolf von Baeyer surnomme la relation entre la couleur et la formation du sel halochromie, dont le vert de malachite est un bon exemple.
Intermédiaire de réaction
modifierLes carbocations sont des intermédiaires de réaction, c’est-à-dire des molécules de courtes durées de vie, instables, qui apparaissent au cours des réactions chimiques. Cette idée est d'abord développée par Hans Meerwein dans son étude du réarrangement de Wagner-Meerwein. Les carbocations sont aussi impliqués dans des réactions de type SN1 (substitution nucléophile en deux étapes) et E1 (réaction d'élimination en deux étapes) et dans des réactions de réarrangement, comme le réarrangement 1,2 de Whitmore. Les chimistes furent d'abord réticents à accepter la notion de carbocation, et il fallut attendre longtemps avant que le Journal de la Société Américaine de Chimie (the Journal of the American Chemical Society) accepte les articles qui l'évoquaient. En 1962, George Andrew Olah dissout du fluorure de tert-butyl dans un superacide et observe par résonance magnétique nucléaire que le tert-butyl carbocation obtenu est stable.
Structure
modifierModèle de Lewis
modifier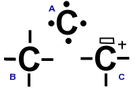
L'atome de carbone possède quatre électrons célibataires dans sa couche de valence. Ces quatre électrons lui permettent de former quatre doublets, donc d'avoir huit électrons dans sa couche de valence et ainsi respecter la règle de l'octet et avoir une stabilité maximum. Or, dans un carbocation, il manque un doublet au carbone chargé qui n'a plus que six électrons dans sa couche de valence. Ce carbone a donc une case quantique vide, une carence en électrons qui explique sa charge électrique positive. Cette carence en électrons rend le carbocation très instable et réactif.
Du fait de cette carence en électrons le carbocation se comporte comme un réactif électrophile, ou comme un acide de Lewis. Il va réagir avec des composés nucléophiles qui ont un excès d'électrons ou des bases de Lewis.
Structure spatiale
modifier
Au niveau du carbone chargé la molécule a une structure plane avec des angles de valence de 120°. Le carbone chargé est lié au reste de la molécule par trois liaisons , et possède donc une orbitale atomique 2pz vide, il est donc hybridé sp² (voir le schéma).
Stabilité
modifierLe carbocation est instable parce qu'il est chargé positivement. Il sera donc plus stable si cette charge est partiellement compensée.
Effet inductif
modifier
Lorsque deux atomes différents sont liés, les électrons sont globalement plus proches de l'atome le plus électronégatif (qui attire le plus les électrons), c'est l'effet inductif dû à la polarisation de la liaison. L'atome le plus électronégatif sera donc chargé un peu négativement, l'autre atome un peu positivement.
Ainsi le carbocation peut compenser partiellement sa charge positive, donc se stabiliser. Le carbone chargé bénéficie d'un effet inductif donneur s'il est relié à un ou plusieurs atomes (ou groupes d'atomes) moins électronégatifs : il sera stabilisé. Inversement, s'il est relié à un ou plusieurs atomes (ou groupes d'atomes) plus électronégatifs, il sera moins stable.
Les groupements alkyles sont moins électronégatifs que le carbone. Donc plus le carbone chargé est lié à un nombre important de tels groupements, plus le carbocation sera stable. Un carbocation tertiaire (le carbone chargé est lié à trois groupes alkyles) est plus stable qu'un secondaire, lui-même plus stable qu'un primaire.
À l'inverse, le carbone chargé sera fortement déstabilisé s'il est lié à un groupement nitrile (-CN), très électronégatif.
Effet mésomère
modifier
Lorsque dans un composé chimique des électrons sont délocalisés on parle de mésomérie. Dans ce cas on trouve plusieurs structures électroniques possibles, plusieurs schémas possibles. Aucun de ces schémas ne décrit à lui seul la réalité, c'est la somme de ces schémas qui s'approche le plus de la réalité.
Les carbocations peuvent être stabilisés par effet mésomère. En effet un carbocation possède une orbitale 2p vide, et c'est entre des orbitales 2p proches que les électrons peuvent se délocaliser. Et si la charge positive du carbocation profite d'un effet mésomère, elle sera elle aussi délocalisée et en quelque sorte répartie sur tout le composé, qui sera alors plus stable.
L'effet mésomère est plus important que l'effet inductif. Le composé pris en exemple est, si on se préoccupe seulement de l'effet inductif, très instable : c'est un carbocation primaire. Mais dans ce composé les électrons sont délocalisés du fait de la double liaison, le composé existe donc sous deux formes mésomères et est donc relativement stable.
Réarrangement
modifierLes carbocations peuvent se réarranger eux-mêmes pour passer d'une forme instable à une forme plus stable.
Ce réarrangement s'opère par transfert d'hydrogène, ou par transfert de groupe alkyle. Si le carbone chargé est primaire ou secondaire, donc peu stable, et qu'un carbone adjacent est tertiaire ou quaternaire, il peut y avoir transfert d'hydrogène ou de groupement alkyle du carbone non chargé (tertiaire ou quaternaire) vers le carbone chargé (primaire ou secondaire). Le carbone initialement non chargé deviendra positif, tandis que le carbone chargé deviendra neutre. Ainsi la charge positive sera située sur un carbone tertiaire (dans tous les cas), le carbocation sera plus stable puisque la charge sera partiellement compensée par les effets inductifs donneurs des groupes alkyles.
Ce réarrangement peut également se produire si le carbone chargé est déstabilisé par un groupement électronégatif (effet inductif attracteur). La charge positive cherchera en quelque sorte à "fuir" le groupement électronégatif.
Cette possibilité de réarrangement explique le fait qu'une réaction qui s'effectue par l'intermédiaire d'un carbocation peut dans certains cas conduire à deux produits différents, l'un, majoritaire, correspondant au carbocation le plus stable, et l'autre au carbocation le moins stable. La règle de Markovnikov en découle.
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier
- Notices dans des dictionnaires ou encyclopédies généralistes :
