Crésomycine
La crésomycine est un antibiotique expérimental. Il se lie au ribosome bactérien des bactéries Gram-négatives et Gram-positives, et s'est avéré efficace contre les souches multirésistantes de Staphylococcus aureus, Escherichia coli et Pseudomonas aeruginosa[2]. Il appartient aux antibiotiques oxépanoprolinamides (en) macrobicycliques pontés, qui présentent des similitudes avec les antibiotiques lincosamides (en)[2].
| Crésomycine | |
| |
| Identification | |
|---|---|
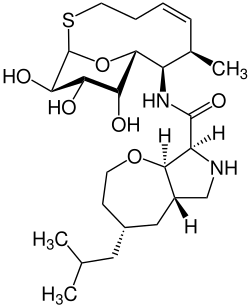
| Nom UICPA | (4S,5aS,8S,8aR)-4-Isobutyl-N-([1R,7R,8R,9R,10R,11S,12R,Z]-10,11,12-trihydroxy-7-methyl-13-oxa-2-thiabicyclo[7.3.1]tridec-5-en-8-yl)octahydro-2H-oxepino[2,3-c]pyrrol-8-carboxamide |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C25H42N2O6S |
| Masse molaire[1] | 498,676 ± 0,03 g/mol C 60,21 %, H 8,49 %, N 5,62 %, O 19,25 %, S 6,43 %, |
| Propriétés physiques | |
| Solubilité | mg L−1 |
| Masse volumique | g cm−3 |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antibiotique oxépanoprolinamide macrobicyclique ponté |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La crésomycine a été spécialement conçue pour se lier de manière préorganisée au ribosome bactérien, améliorant ainsi la liaison. Cela permet à la crésomycine de contrer les gènes de méthylase ribosomale impliqués dans la résistance bactérienne à des antibiotiques qui se lient au centre peptidyltransférase du ribosome, tels que les lincosamides[2]. La crésomycine a été synthétisée à base d'iboxamycine (en), un autre antibiotique oxépanoprolinamide, avec l'ajout d'un cycle de 10 chainons[3].
La crésomycine s'est avérée efficace contre les bactéries résistantes à plusieurs antibiotiques, y compris les lincosamides, à la fois in vitro et in vivo, surclassant l'iboxamycine[2]. Dans des études de destruction temporelle, l'antibiotique s'est révélé bactériostatique contre S. aureus. Des expériences de sécurité in vitro avec des cellules humaines ont indiqué une faible cytotoxicité[2].
La crésomycine a été développée par un groupe de recherche dirigé par Andrew G. Myers du Département de chimie et de biologie chimique de l'université Harvard et de l'université de l'Illinois à Chicago et a reçu un financement du CARB-X (en) pour un développement ultérieur[4],[5].
Notes et références
modifier- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Kelvin J. Y. Wu, Ben I. C. Tresco, Antonio Ramkissoon, Elena V. Aleksandrova, Egor A. Syroegin, Dominic N. Y. See, Priscilla Liow, Georgia A. Dittemore, Meiyi Yu, Giambattista Testolin, Matthew J. Mitcheltree, Richard Y. Liu, Maxim S. Svetlov, Yury S. Polikanov et Andrew G. Myers, « An antibiotic preorganized for ribosomal binding overcomes antimicrobial resistance », Science, vol. 383, no 6684, , p. 721–726 (DOI 10.1126/science.adk8013)
- ↑ (en) Bethany Halford, « An antibiotic built for better binding », sur Chemical & Engineering News, (consulté le )
- ↑ « CARB-X funds the Myers research group to develop enhanced oral antibiotics to treat a range of serious drug-resistant bacterial infections », CARB-X, (consulté le )
- ↑ Corinne Purtill, « Could a single synthetic molecule outsmart a variety of drug-resistant bacteria? », sur Los Angeles Times, (consulté le )
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier