Dispersion de la matrice sur phase solide
La technique de séparation de dispersion de la matrice sur phase solide (de l'anglais Matrix Solid-Phase Dispersion ou MSPD) est une méthode de séparation préparatoire qui est particulièrement appliquée pour les solides, semi-solides et les échantillons biologiques visqueux. Elle a été introduite en 1989 par Steven A. Barker[1] et elle s’est avérée efficace pour isoler une grande variété de pesticides, médicaments, constituants d’origine naturelle et beaucoup d’autres composés qui proviennent d’échantillons de plantes et d’animaux[2],[3]. La simplicité et la flexibilité de cette méthode ont contribué à ce qu'elle soit préférée à plusieurs techniques traditionnelles[2].
Description
modifierLa méthode de la dispersion de matrice sur phase solide est utilisée lorsque l’extraction sur phase solide (SPE) est trop difficile, c’est-à-dire surtout quand les échantillons sont visqueux, semi-solides ou solides. En effectuant une SPE avec des échantillons de ce type, il y a risque de bloquer la cartouche, et donc de provoquer la diminution du rendement de l’extraction. De plus, cette technique peut être considérée comme une technique de micro-extraction, car elle utilise environ un gramme d’échantillon avec peu de volume de solvant[4]. La MSPD est similaire à la SPE, bien que lors de la MSPD, on mélange l’échantillon avec un support solide, soit de la silice greffée avec du C18 ou du C8 afin de former une pâte ensuite lavée avec du solvant. Les forces de cisaillements mécaniques produites par le procédé de broyage, c’est-à-dire lors du mélange de l’échantillon avec le support solide, perturbent la structure du tissu de l’échantillon, ce qui disperse l’échantillon sur la surface du sorbant de support[5]. Le processus de broyage donne un mélange qui est semi-sec et fluide.
Étapes
modifierLa technique de la MSPD est divisée en trois étapes distinctes :

- prétraitement de l’échantillon : une petite quantité d’échantillon est placée dans un mortier de vitre et on y ajoute le sorbant. Le rapport de l’échantillon par rapport au sorbant est normalement de 1 : 4. À la fin de cette étape, le mélange obtenu devrait être lisse, sèche et devrait avoir l’apparence d’une poudre fluide. Cette étape nécessite entre trente secondes et une minute[5]. Après avoir effectué le broyage, le mélange est transféré dans une colonne de MSPD pré-frittée au fond et est compressé. On insère ensuite un deuxième fritté au sommet de la colonne ;
- élution des interférences : cette étape sert à enlever les composés non désirés du sorbant sans éluer les analytes. Le séchage de la cartouche peut être nécessaire pour enlever l’éluant s’il est immiscible dans l’eau. Le séchage peut être effectué sous vide, avec du N2 ou du CO2 ou par centrifugation[5] ;
- élution de l’analyte : cette étape s’effectue lorsque les analytes sont solubles. On recueille en dernier l’analyte afin d’effectuer les analyses désirées sur celui-ci.
Facteurs à considérer pour améliorer la performance d’une extraction MSPD
modifierGrosseur des particules du support solide
modifierLa grosseur des particules du support solide va influencer le temps d’élution du solvant. En effet, une plus grande pression ou un plus grand vide sera nécessaire afin d’éluer le solvant lorsque le diamètre des particules est inférieur à 40 μm dans la plupart des cas. En général, la taille des particules entre 40-100 μm de diamètre permet d'effectuer une extraction plus efficace et performante[2].
Nature du support solide
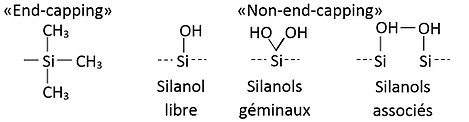
modifierNormalement, le support solide utilisé est constitué de silice greffée. La silice se retrouve majoritairement sous deux formes : soit sous la forme avec des groupements silanol (non-end-capped) ou avec un ou plusieurs blocages par des groupements triméthylsilyle sur les groupements silanol (end-capped). La silice avec les groupements silanol (non-end-capped) va permettre d’assécher davantage la matrice lors du broyage puisque les atomes d'hydrogène liés aux atomes d'oxygène de la silice peuvent établir des ponts hydrogène avec l’eau. Ainsi, le support solide sera choisi en fonction de la consistance de la matrice[2].
Nature de la phase greffée
modifierLa plupart des applications de la méthode MSPD utilise le C18 ou le C8 greffé sur la silice pour isoler des analytes peu polaires. Parfois, la silice est utilisée directement pour un composé plus polaire. La phase greffée doit être choisie en fonction de la polarité de l’analyte d’intérêt et des agents interférents dans la matrice[2].
Ratio entre l'échantillon et le support solide
modifierLe ratio normalement utilisé est de 1 : 4 (échantillon : support solide), mais il varie selon l’application de la MSPD. Si la quantité d’échantillon est trop grande pour la quantité de support solide, l’analyte ne sera pas totalement extrait et les résultats ne seront pas représentatifs de la réalité[2].
Modifications chimiques de la matrice ou du mélange matrice-support solide
modifierL’addition d’agents chélates, d’acides ou de bases lors du broyage de l’échantillon avec le support solide, influence la distribution et l’élution des analytes visés par la méthode de séparation. Ces modifications peuvent être apportées afin d’augmenter les interactions de l’échantillon avec le support solide ou avec l’éluant. Aussi, afin de modifier la polarité et l'affinité des agents interférents avec le support solide[2].
Choix du solvant d'élution et de son volume utilisé
modifierPuisque la fonction du solvant d’élution est d’éluer l’analyte ou bien de nettoyer la colonne d’agents interférents, la colonne d’une MSPD permet l’isolation de composés avec différentes polarités. Ainsi, l’éluant doit être choisi en fonction de son affinité avec l'analyte d'intérêt. Un mauvais choix d’éluant ou un volume trop petit diminuerait l’efficacité de l’extraction de l’analyte puisqu’elle ne serait pas complète. Normalement, le volume de solvant utilisé est de huit millilitres et l’analyte doit sortir dans les quatre premiers millilitres[2].
Nature de la matrice
modifierLa composition de la matrice doit être prise en considération puisque certains composés non désirés peuvent avoir des polarités relativement semblables à celle de l’analyte. Ainsi, ces composés peuvent agir comme agents interférents et être élués avec l’analyte d’intérêt. Il faut donc modifier chimiquement les agents interférents lors du broyage ou bien procéder à d'autres méthodes de séparations après l'élution afin d'isoler l'analyte d'intérêt et enfin l'analyser[2].
Inconvénients et avantages
modifierInconvénients
modifier- Méthode qui demande une grande quantité de support solide pour la quantité d’échantillon.
- Utilise des solvants nocifs pour l’environnement.
Avantages
modifier- Utilise une plus petite quantité de solvant que plusieurs autres méthodes de séparation.
- Méthode très simple et facile d’accès.
- Temps d’analyse très court.
- Requiert une petite quantité d’échantillon pour obtenir des résultats fiables.
- Permet de déterminer la présence d’analyte malgré leur faible quantité dans les échantillons.
Références
modifier- Karasova G., Brandsteterova E., Lachova M. (2003), Matrix Solid Phase Dispersion as an Effective Preparation Method for Food Samples and Plants before HPLC Analysis, Czech Journal of Food Science 21(6): 219-234
- Barker S.A. (2006), Matrix solid phase dispersion (MSPD), Journal of Biochemical and Biophysical Methods 70 (2007) : 151-162
- Dos Santos É.S., Navickiene S., Wanderley K.A., de Sa, G.F., Jr. S.A. (2013), MSPD method for the determination of clofentezine, flumetralin, and kresoxim-methyl residues in fresh and dehydrated forms of plantago major medicinal plant by HPLC/UV-DAD, J. Liq. Chromatogr. Relat. Technol., 36: 1802-1809
- Steven A. Barker (2000), Matrix solid-phase dispersion (MSPD), Louisiane, Taylor & Francis Group LLC, 20 p.
- Dr Wéber Consulting Kft. (1997), Matrix Solid Phase Dispersion [PDF] (consulté le 18 décembre 2015)