Formule structurale
Une formule structurale est une formule chimique qui apporte, au-delà de la simple composition d'un composé chimique, d'une espèce chimique ou d'un minéral, une information plus ou moins complète sur la façon dont les atomes sont reliés entre eux et disposés dans l'espace. Les groupes d'atomes formant un ensemble autonome y sont indiqués séparément, notamment en les mettant entre parenthèses, entre crochets ou entre accolades.
Règles générales
modifierConstruction des formules
modifier- Quand les atomes d'un composé chimique sont alignés (liés de proche en proche du premier au dernier), la formule structurale cite les symboles des atomes dans l'ordre de cet alignement. Les formules structurales HCNO, HNCO, HOCN et HONC représentent ainsi quatre composés différents, alors qu'ils partagent la même formule empirique (CHNO).
- Pour des structures plus complexes, il faut séparer des groupes d'atomes en les entourant de parenthèses, de crochets ou d'accolades (
(),[]ou{}). La notation a été codifiée par l'UICPA[1] :
- Les unités qui se répètent dans des composés en chaîne sont mises entre crochets.
- Les groupes latéraux d'une chaîne principale et les ligands attachés à un atome central sont mis entre parenthèses, sauf quand il s'agit d'un seul atome et qu'il n'y a pas de confusion possible sur la façon dont il est lié à la structure (H par exemple dans les hydrures en chaîne).
- Un groupe d'atomes formant une entité chimique à part entière est indiqué entre parenthèses, crochets ou accolades. Quand il s'agit de la formule tout entière, les crochets sont impératifs sauf quand la règle no 5 s'applique.
- Un groupe d'atomes répété est mis entre parenthèses ou entre crochets, avec en indice le nombre de groupes dans la formule, sauf dans le cas des composés en chaîne (règle no 1).
- Quand on veut préciser les liaisons entre les unités répétées d'un polymère, on délimite l'unité par des parenthèses barrées (barres simples, doubles ou triples selon la liaison). Si les contraintes typographiques ne le permettent pas, on place les barres (
−,=ou) avant et après les parenthèses. - Quand des entités à délimiter sont imbriquées, on utilise des crochets pour délimiter l'ensemble, et à l'intérieur des crochets on utilise les parenthèses et les accolades alternativement :
(),{()},({()}),{({()})}, etc. - Les atomes ou groupes d'atomes nécessitant un préfixe (par exemple un modificateur de structure comme µ) sont mis entre parenthèses, crochets et/ou accolades, selon l'ordre d'imbrication de la règle no 6.
Exemples
| Composé chimique | Formule empirique | Formule moléculaire | Formule structurale | Numéros des règles appliquées |
|---|---|---|---|---|
| Peroxyde d'hydrogène | HO | H2O2 | HOOH | |
| Décasilane | H11Si5 | Si10H22 | SiH3[SiH2]8SiH3 | 1 |
| SiH3[SiH2]5SiH(SiH3)SiH2SiH3 | 1, 2 | |||
| Phosphate de calcium | Ca3O8P2 | Ca3(PO4)2 | 4 | |
| Co2H36N12O12S3 | [Co(NH3)6]2(SO4)3 | 3, 4, 6 | ||
| Complexe de chlorodicarbonylerhodium(I) | C2ClO4Rh | [{Rh(µ-Cl)(CO)2}2] | 3, 6, 7 | |
| KN3Os | K[Os(N)3] | 2, 3 | ||
| Soufre solide[a] | S | 5 | ||
| BHO2 | (HBO2)n | 2, 5 | ||
| Chlorure de sodium gazeux[a] | ClNa | [NaCl] | 3 |
Mise en ordre des éléments et des formules
modifier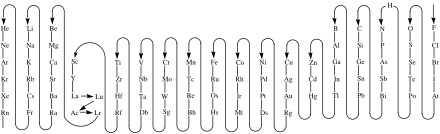
- Dans une formule (d'un composé chimique ou d'un groupe d'atomes), les symboles des éléments chimiques apparaissent de gauche à droite dans l’ordre inverse de celui indiqué sur la figure ci-contre (donc de Rn jusqu'à F). C'est approximativement l'ordre d'électronégativité croissante[1].
- Pour classer les formules entre elles (par exemple dans un index, un catalogue ou un tableau de propriétés), on utilise l'ordre alphanumérique. C'est d'abord l'ordre alphabétique des symboles des éléments, puis (pour une même succession d'éléments) l'ordre croissant des indices numériques. Exemple : B – BH – BO – B2O3.
- Une exception est généralement faite pour le groupe NH4, considéré comme un symbole unique et placé juste après Na. Exemple : N3− – NH2− – NH3 – NO2− – NO22− – NO3− – N2O22− – N3− – Na – NaCl – NH4Cl.
- On utilise parfois l'ordre alphanumérique au sein de groupes d'atomes, dans des formules globalement structurées par l'électronégativité.
Cas des composés binaires
modifierL'écriture des formules des composés binaires suit très généralement l'ordre d'électronégativité décroissante.
Exemples
- NH3
- H2S
- OF2
- O2Cl
- OCl−
- PH4+
- P2O74−
- [SiAs4]8−, RbBr
- [Re2Cl9]−
- HO− (ou OH−[b])
- Rb15Hg16
- Cu5Cd8
Cas particulier des composés de coordination
modifier- Dans la formule d'un groupe de coordination, on place en premier le symbole de l'atome central, que l'on fait suivre des formules ou des abréviations des ligands.
- S'il y a plusieurs atomes centraux on les cite dans l'ordre d'électronégativité croissante.
- Les ligands sont placés par ordre alphanumérique de leurs formules ou abréviations.
- L'ensemble du groupe de coordination peut être écrit entre crochets. C'est notamment l'usage constant quand l'atome central est un métal de transition.
Exemples
- PBrCl2
- SbCl2F ou [SbCl2F]
- [Mo6O18]2−
- [CuSb2]5−
- [UO2]2+
- [SiW12O40]4−
- [BH4]−
- [ClO4]− ou ClO4−
- [PtCl2{P(OEt)3}2]
- [Al(OH)(OH2)5]2+
- [PtBrCl(NH3)(NO2)]−
- [PtCl2(NH3)(py)]
- [Co(en)F2(NH3)2]+ mais [CoF2(NH2CH2CH2NH2)(NH3)2]+
- [Co(NH3)5(N3)]2−
Cas particulier des oxoacides
modifierLa formule chimique d'un oxoacide peut être écrite comme celle d'un composé de coordination, mais ce choix diffère du choix traditionnel, où l'on place successivement :
- le ou les atomes d'hydrogène dits remplaçables (par un métal pour former un sel), c'est-à-dire celui ou ceux qui assurent la fonction acide ;
- l'atome central ;
- le ou les atomes d'hydrogène non remplaçables (le cas échéant) ;
- le ou les atomes d'oxygène.
Exemples
| Formule traditionnelle | Composé de coordination |
|---|---|
| HNO3 | [NO2(OH)] |
| H2PHO3 | [PHO(OH)2] |
| H2PO4− | [PO2(OH)2]− |
| H5P3O10 | [(HO)2P(O)OP(O)(OH)OP(O)(OH)2] |
| (HBO2)n |
Cas particulier des composés en chaîne
modifierQuand les atomes d'un composé forment une chaîne, c'est-à-dire qu'ils sont liés de proche en proche, on abandonne généralement l'ordre d'électronégativité pour l'ordre géométrique des éléments dans la chaîne.
Exemples
- Anion nitridosulfidocarbonate : NCS− ou SCN− (et non pas CNS−)
- BrSCN (pas BrCNS)
- HOCN (acide cyanique) et HNCO (acide isocyanique)
Pour certaines discussions on peut préférer écrire la formule comme celle d'un composé de coordination. Le premier exemple précédent peut ainsi être écrit [C(N)S]−.
Cas particuliers
modifierComposés d'addition
modifierLes composés ou les minéraux résultant de l'association d'un composé chimique et d'un adduit (eau H2O, peroxyde d'hydrogène H2O2, ammoniac NH3, méthane CH4, tétrahydrofurane O(CH2)4, etc.) sont représentés par une formule constituée de[1] :
- le cas échéant, le nombre de molécules du composé chimique correspondant au nombre ci-après d'adduits (omis s'il est égal à un) ;
- la formule du composé ;
- un point centré (
·) ; - le nombre de molécules d'adduit associées à la ou aux molécules du composé (omis s'il est égal à un) ;
- la formule de l'adduit.
Cette règle vaut aussi bien pour les formules structurales que pour les formules moléculaires. En pratique cependant l'adduit, considéré comme banal, est généralement représenté par sa formule moléculaire, même quand le composé l'est par sa formule structurale.
Exemples
| Composé d'addition | Minéral | Formule structurale |
|---|---|---|
| Carbonate de sodium décahydraté | natron | Na2CO3 · 10 H2O |
| Clathrate d'hydrogène | 48 H2 · 136 H2O | |
| Triméthylborane ammonié | B(CH3)3 · NH3 |
Polymorphes
modifierPour les différentes formes allotropiques d'un corps simple ou les différents polymorphes d'un corps composé, on peut compléter la formule structurale par l'indication du type de structure cristalline. On peut le faire par l'indication :
- du système cristallin, si c'est suffisant pour lever toute ambiguïté :
- avec une abréviation en italique et entre parenthèses, par exemple « (c) » pour le système cubique ou « (h) » pour le système hexagonal,
- et/ou avec, en italique et entre parenthèses, le nom d'un composé-type ayant la même structure ;
- du symbole de Pearson si le procédé précédent n'est pas assez précis[c] ;
- par l'emploi d'une lettre grecque (pour distinguer différentes structures), mais ce n'est pas recommandé[d].
Exemples
| Composé chimique | Minéral | Formule structurale |
|---|---|---|
| Sulfure de zinc (< 1 020 °C[e]) | sphalérite | ZnS (c) |
| Sulfure de zinc (> 1 020 °C[e]) | wurtzite | ZnS (h) |
Notes et références
modifierNotes
modifier- La précision de l'état (solide, liquide ou gazeux) ne vaut que pour la formule structurale et éventuellement pour la formule moléculaire. La formule empirique et parfois la formule moléculaire restent inchangées quel que soit l'état.
- la forme correcte est HO−, mais OH− est consacré par l'usage.
- On connaît par exemple dix variétés différentes de ZnS (h).
- L'attribution des lettres grecques (α, β, γ, etc.) s'est faite, pour chaque composé, par ordre chronologique de la découverte des divers polymorphes, et ne suit donc aucune logique structurale. De plus, la mention d'une de ces lettres n'est compréhensible que si l'on connaît déjà bien le composé chimique en question.
- La gamme de température indiquée vaut pour l'équilibre thermodynamique, mais ce polymorphe peut exister en dehors, sous forme métastable.
Références
modifier- (en) « Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 » (consulté le ), surtout le chapitre IR-4.2.3 : Structural formulae and the use of enclosing marks in formulae.
Voir aussi
modifierArticles connexes
modifier- Nomenclature of Inorganic Chemistry (« Red Book »)
