Hydrogénosome
L'hydrogénosome est un organite présent dans certains organismes anaérobies tels que des ciliés, des trichomonas et certains fungi. L'hydrogénosome des trichomonas (l'organisme le plus étudié pour ce type d'organite) produit de l'hydrogène, de l'acétate, du dioxyde de carbone et de l'ATP grâce à l'action combinée de la pyruvate:ferrédoxine oxydoréductase, d'une hydrogénase, de l'acétate:succinate CoA transférase et de la succinate thiokinase.
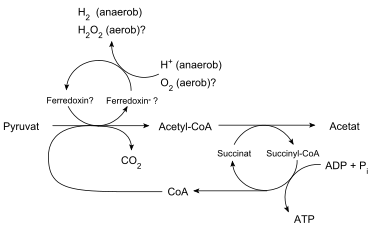
abb.: CoA = Coenzyme A
D'autres enzymes y sont aussi présentes telles que la Superoxyde dismutase, la malate déshydrogénase (décarboxylation), une ferrédoxine, une adénylate kinase et une NADH:ferrédoxine oxydoréductase.
Cet organite aurait évolué à partir d'une bactérie anaérobie ou d'une archée. En 2010, des chercheurs auraient découvert les premiers métazoaires anaérobies possédant un hydrogénosome[2]. Le nom de cet organite provient du fait qu'il produit de l'hydrogène.
Histoire
modifierLes hydrogénosomes ont été isolés, purifiés, caractérisés et nommés au début des années 1970 par D.G. Lindmark et M. Müller à université Rockefeller[3]. En plus de cette étude, ils démontrèrent également pour la première fois la présence d'une pyruvate:ferredoxin oxido-reductase et d'une hydrogénase chez les eucaryotes. D'autres études furent conduites ensuite sur la biochimie, la cytologie et l'organisation sub-cellulaire des protistes anaérobies (Trichomonas vaginalis, Tritrichomonas foetus, Monocercomonas sp., Giardia lamblia, Entamoeba histolytica, et Hexamita inflata). Grâce à ces études, ces chercheurs ont pu déterminer le mode d'action du métronidazole (Flagyl) en 1976. Le métronidazole est de nos jours considéré comme l'une des meilleures molécules pour traiter les infections dues à des organismes anaérobies procaryotes (Clostridium, Bacteroides, Helicobacter) ou eucaryotes (Trichomonas, Tritrichomonas, Giardia, Entamoeba). Le métronidazole est absorbé par diffusion. Une fois absorbé, il est réduit par les ferrédoxines réduites elle-même par la pyruvate:ferredoxin oxido-reductase. Cette réduction entraine la formation d'un produit cytotoxique et permet son accumulation dans les organismes anaérobies.
Description
modifierUn hydrogénosome mesure environ 1 µm de diamètre mais peut atteindre 2 µm en conditions de stress[4].
Comme les mitochondries, les hydrogénosomes sont entourés de deux membranes dont celle intérieure forme des projections ressemblant à des crêtes.
Certains hydrogénosomes ont pu évoluer à partir d'une mitochondrie par la perte de certaines caractéristiques comme le génome. Aucun génome d'hydrogénosome n'a pu être détecté dans Neocallimastix, Trichomonas vaginalis et Trichomonas foetus[5]. Cependant, un génome hydrogénosomal a été détecté dans le cilié Nyctotherus ovalis[6] et dans le straménopile Blastocystis[7]. Les similarités entre Nyctotherus et Blastocystis sont probablement le résultat d'une évolution convergente mais soulèvent la question sur les origines distinctes de la mitochondrie, de l'hydrogénosome et du mitosome (une sorte de mitochondrie dégénérée)[8].
Sources
modifierLes études les plus précises des hydrogénosomes ont été réalisées sur les parasites sexuellement transmissibles Trichomonas vaginalis et Tritrichomonas foetus et également chez certains chytridiomycota tel que Neocallimastix issus de la panse de ruminants.
Le cilié anaérobie Nyctotherus ovalis, vivant dans l'intestin de certaines espèces de cafards, possède de nombreux hydrogénosomes intimement associés avec une archée endosymbiotique méthanogène qui utilise l'hydrogène produit. Chez N. ovalis, les hydrogénosomes contiennent des particules ribosome-like de la même taille (70S) que celle des archées. Ceci suggère la présence d'un génome hydrogénosomale qui aurait été découvert par Akhmanova et partiellement séquencé par Boxma[6],[9].
Trois espèces multicellulaire de Loricifera — Spinoloricus nov. sp., Rugiloricus nov. sp. et Pliciloricus — utilisant un hydrogénosome pour leur métabolisme anaérobie ont été découvertes dans des couches sédimentaires de la mer Méditerranée[10].
Références
modifier- (en) Müller M, Lindmark DG, « Respiration of hydrogenosomes of Tritrichomonas foetus. II. Effect of CoA on pyruvate oxidation », J. Biol. Chem., vol. 253, no 4, , p. 1215–8 (PMID 624726, lire en ligne)
- (en) Danovaro R, Dell'anno A, Pusceddu A, Gambi C, Heiner I, Kristensen RM, « The first metazoa living in permanently anoxic conditions », BMC Biol, vol. 8, no 1, , p. 30 (PMID 20370908, DOI 10.1186/1741-7007-8-30, lire en ligne)
- (en) Lindmark DG, Müller M, « Hydrogenosome, a cytoplasmic organelle of the anaerobic flagellate Tritrichomonas foetus, and its role in pyruvate metabolism », J. Biol. Chem., vol. 248, no 22, , p. 7724–8 (PMID 4750424, lire en ligne)
- Benchimol M. (2009) "Hydrogenosomes under microscopy" Tissue and Cell 41:151–168.
- (en) van der Giezen M, Tovar J, Clark CG, « Mitochondrion-derived organelles in protists and fungi », Int. Rev. Cytol., vol. 244, , p. 175–225 (PMID 16157181, DOI 10.1016/S0074-7696(05)44005-X, lire en ligne)
- (en) Akhmanova A, Voncken F, van Alen T, et al., « A hydrogenosome with a genome », Nature, vol. 396, no 6711, , p. 527–8 (PMID 9859986, DOI 10.1038/2502310.1038/25023)
- Wawrzyniak I, Roussel M, Diogon M, Couloux A, Texier C, Tan KS, Vivarès CP, Delbac F, Wincker P, El Alaoui H., "Complete circular DNA in the mitochondria-like organelles of Blastocystis hominis" dans Int J Parasitol. 2008 Oct;38(12):1377-82
- (en) Stechmann, A, Hamblin, K, Pérez-brocal, V, Gaston, D, Richmond, Gs, Van, Der, Clark, Cg et Roger, Aj, « Organelles in Blastocystis that blur the distinction between mitochondria and hydrogenosomes », Current biology : CB, vol. 18, no 8, , p. 580–5 (PMID 18403202, PMCID 2428068, DOI 10.1016/j.cub.2008.03.037)
- (en) Boxma B, de Graaf RM, van der Staay GW, et al., « An anaerobic mitochondrion that produces hydrogen », Nature, vol. 434, no 7029, , p. 74–9 (PMID 15744302, DOI 10.1038/nature0334310.1038/nature03343)
- Janet Fang, « Animals thrive without oxygen at sea bottom », Nature, Nature Publishing Group, (DOI 10.1038/464825b, lire en ligne, consulté le )