Mastocytose
Les mastocytoses sont des maladies orphelines consistant en une prolifération locale ou générale de mastocytes. Elles touchent les enfants comme les adultes, toutes les populations sans distinction de sexe.
| Médicament | Acide cromoglicique |
|---|---|
| Spécialité | Oncologie |
| CIM-10 | Q82.2, C96.2 |
|---|---|
| CIM-9 | 757.33, 202.6 |
| ICD-O | 9741/3 |
| OMIM | 154800 |
| DiseasesDB | 7864 |
| eMedicine |
203948 med/1401 |
| MeSH | D008415 |
Physiopathologie
modifierLes mastocytoses sont un groupe hétérogène d'affections rares caractérisées par l'accumulation ou la prolifération anormale de mastocytes (MC) dans un ou plusieurs organes. Les mastocytes font partie des cellules impliquées dans la défense de l'organisme contre les infections ; elles ont un rôle utile, mais qui devient parfois néfaste si ces mastocytes se multiplient de façon exagérée (prolifération anormale) ; ils interviennent alors dans certaines réactions allergiques IgE-dépendantes et sont responsables des mastocytoses.
Étiologie
modifierLes causes des mastocytoses sont encore mal comprises et il existe probablement plusieurs causes ou cofacteurs :
- un mécanisme identifié est lié à la présence d'une mutation ponctuelle, acquise et activatrice, du récepteur appelé KIT. Ce récepteur est celui du principal facteur de croissance du mastocyte normal, le Stem Cell Factor ou SCF.
Cette mutation, présente chez plus de 85 % des patients atteints de « mastocytose systémique », entraîne une prolifération anarchique des mastocytes. C'est alors la libération de médiateurs, et notamment d'histamine, par un phénomène de dégranulation des mastocytes, qui provoque l'apparition de nombreux symptômes variables d'un individu à l'autre. - Dans d'autres cas, des anaphylaxies induites par des piqûres d'insecte ou des morsures d'acarien hématophage (tiques en particulier) se montrent étroitement associées à des troubles mastocytaires. Les liens entre ces anaphylaxies et les mastocytes sont ici spécifiques, inhabituels et - en 2019 - encore mal compris[1].
Une hypothèse est qu'une multiplication pathologique des mastocytes est dans ces cas induite par une anaphylaxie elle-même induite par des venins ou par des allergènes introduits dans l'organisme du patient via la morsure ou la piqûre[1]. Certains aspects cliniques des réactions aux piqûres ou aux morsures d'insectes devraient faire suspecter une mastocytose sous-jacente (par exemple, une chute de tension sans urticaire, en particulier chez l'homme)[1]. La mesure du taux de tryptase sérique (c'est-à-dire dans le sérum sanguin) devrait être systématique chez des patients victimes d'anaphylaxie induite par des piqûres/morsures d'insectes ou un venin, car il est corrélé à des risques importants pour eux (leur niveau de tryptase de base est souvent anormalement élevé, et ceci a été corrélé à une atteinte mastocytaire clonale mais pourrait aussi révéler un des autres syndromes sous-jacents possibles, dont : un syndrome d'activation mastocytaire, une hypertryptasémie familiale, ou une anaphylaxie dite idiopathique[1]. Ces pathologies se chevauchant en partie, une attention particulière est à porter à l'évaluation clinique lors de la présentation et aux marqueurs de laboratoire. Une biopsie de la moelle osseuse peut poser le diagnostic final et spécifique de la maladie des mastocytes clonale[1].
La présence d'IgE de venin ne prouve pas que les réactions aux piqûres précédentes du patient étaient induites par ces IgE, mais même de faibles niveaux d'IgE au venin chez les patients atteints de mastocytose les prédisposent à une anaphylaxie sévère. L'évaluation de tous ces facteurs possibles affectera la recommandation d'immunothérapie au venin[1].
Formes cliniques
modifierLa peau est le seul tissu atteint dans les mastocytoses cutanées à type d’urticaire pigmentaire (UP), affections observées surtout chez l'enfant et souvent spontanément résolutives à l'adolescence.
Les mastocytoses systémiques (MS) sont définies par l'atteinte d'un ou plusieurs organes, dont la moelle osseuse, avec ou sans atteinte cutanée. Elles représentent 10 à 30 % des mastocytoses et surviennent généralement chez l'adulte. Elles sont caractérisées par la prolifération anormale de mastocytes dans différents organes : la moelle osseuse, l'os, les muqueuses des voies digestives et parfois, dans les cas les plus graves, le foie et la rate. Elles peuvent être cliniquement stables dans le temps, sans raccourcissement de la durée de vie et on parle alors de mastocytose systémique indolente[2], ou au contraire, avoir une évolution clinique plus péjorative (mastocytose systémique agressive). Les MS sont assez fréquemment associées à une autre maladie hématologique non mastocytaire (leucémie, lymphome...).
Dans d'exceptionnels cas, on décrit une forme extrêmement agressive, la leucémie à mastocytes, qui se définit par la présence de plus de 20 % de mastocytes anormaux sur le frottis médullaire et dont le pronostic est très péjoratif.
Les formes familiales de mastocytose (au moins deux cas dans une même famille) sont plus rares, estimées à ce jour à moins de dix pour cent des malades.
Symptomatologie
modifierLes symptômes les plus fréquents sont :
- une atteinte cutanée (petites taches rouges ou brunes pouvant gonfler après avoir été frottées[3]), pouvant constituer la seule atteinte dans la mastocytose cutanée, surtout chez l'enfant. L'évolution en est favorable, s'amendant avec la puberté. Des symptômes digestifs peuvent également exister[4] ;
- des symptômes liés à la libération des substances contenues dans les mastocytes : malaises, hypotension, sueurs, douleurs abdominales, diarrhée, voire choc allergique avec perte de connaissance ; ces manifestations peuvent être provoquées par une piqure d'insecte, l'absorption de certains aliments ou médicaments, un stress, etc. ;
- une atteinte osseuse : lésions condensantes ou au contraire ostéoporose avec risque de fractures ;
- une atteinte digestive : diarrhée avec malabsorption à l'origine d'un amaigrissement, augmentation de la taille du foie ou de la rate ;
- une atteinte hématologique : anémie, thrombopénie, leucopénie.
- une étude montre que 50 % des patients atteints souffrent de dépression [5].
Épidémiologie
modifierÉtant donné les formes indolentes, les formes régressives avant l'âge adulte et les difficultés de diagnostic, l'épidémiologie précise des mastocytoses n'est qu'une évaluation et classe cette affection parmi les maladies rares et orphelines : l'estimation d'un cas pour 1 000 à 8 000 nouveaux patients consultant dans un service de dermatologie a été émise[6],[7]. L'incidence annuelle de la forme systémique serait de l'ordre de moins d'un cas pour 100 000 patients[8].
Diagnostic
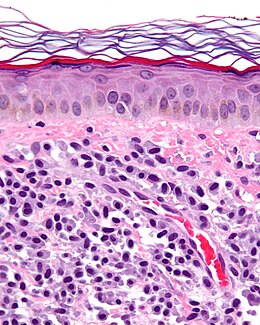
modifierLe diagnostic des mastocytoses utilise principalement des critères histologiques, la suspicion clinique de mastocytose étant confirmée par l’examen histologique de la peau et de la moelle osseuse. Des colorations comme le bleu de toluidine peuvent être utilisées pour identifier les mastocytes. De plus, des réactions immunocytochimiques mettant en évidence la tryptase sont utiles pour confirmer la nature mastocytaire de l’infiltrat cellulaire. Enfin, le diagnostic peut être étayé par l’étude immunophénotypique des MC présents dans la moelle osseuse. En effet, les MC normaux, ainsi que les cellules rencontrées au cours des mastocytoses, expriment de façon forte l’antigène CD117, tandis que des antigènes non trouvés sur le MC normal peuvent être présents de façon aberrante sur les MC anormaux, tels le CD2 et/ou le CD25.
La mesure des médiateurs mastocytaires peut aussi aider au diagnostic de mastocytose. Ainsi, l’histamine dans le sérum et dans l’urine, la tryptase sanguine, et les métabolites de la prostaglandine D2 et de l’histamine dans les urines sont élevés dans la plupart des cas de mastocytose systémique.
Une conférence de consensus internationale a défini des critères de diagnostic des mastocytoses[9] :
- critères majeurs :
- infiltrat dense multifocal de mastocytes (>15 mastocytes agrégés) détectés sur sections de biopsie médullaire et/ou sur sections d’autres organes atteints ;
- critères mineurs :
- présence de plus de 25 % de cellules fusiformes dans les sections de moelle ou d’organes extra-cutanés atteints ou plus de 25 % de mastocytes atypiques de l’ensemble des mastocytes observés sur un étalement de moelle ;
- détection d’une mutation du codon 816 du c-kit dans la moelle ou les autres organes extracutanés analysés, présente dans plus de 90 % des mastocytoses systémiques[10] ;
- détection de mastocytes CD117+ exprimant CD2 et/ou CD25 ;
- tryptase sérique contrôlée > 20ng/ml en dehors d’une autre hémopathie associée.
Si un critère majeur et un critère mineur ou trois critères mineurs sont remplis, le diagnostic de mastocytose systémique est retenu[11].
Pronostic
modifierLes mastocytoses dites « indolentes », correspondant à un peu moins de la moitié des cas, n'engagent pas le pronostic[12]. Dans moins de 1 % des cas, survient une leucémie à mastocytes, très grave, dont la survie est alors inférieure à quelques mois[13].
Traitement
modifierLe traitement des MS est symptomatique et/ou spécifique. Il est limité dans le cas de mastocytoses très indolentes (ou présentant peu de symptômes). Les traitements symptomatiques visent à diminuer les effets indésirables liés à la production de médiateurs par les mastocytes en excès.
Les principales molécules utilisées sont des antihistaminiques H1 (souvent efficaces contre le prurit et les érythèmes localisés dits flushs), et des antihistaminiques H2 (contre les troubles gastro-intestinaux).
D’autres molécules, comme les corticostéroïdes, sont employées en cas de symptômes cutanés sévères.
Des anticholinergiques traitent la diarrhée et les migraines.
Le cromoglycate de sodium traite les symptômes respiratoires.
Enfin, les biphosphonates sont efficaces chez les patients présentant de l’ostéoporose.
L’adrénaline (et une réanimation) peuvent être nécessaire en cas d'état de choc liés à une dégranulation mastocytaire massive.
Le traitement idéal des mastocytoses devrait inhiber spécifiquement la prolifération mastocytaire anormale, mais ce but n’est pas encore atteint.
- L’interféron-alpha a été utilisé seul ou en association avec des corticostéroïdes. Il a permis une amélioration clinique dans plusieurs cas[14], mais une rechute a été notée chez certains patients. De plus, il a des effets secondaires importants qui en limitent l'usage. Une question est de savoir comment traiter les sujets non répondeurs à l’interféron et présentant une maladie progressive. Pour ces patients, différentes thérapeutiques ont été proposées :
- la cladribine (2-CdA) a permis une diminution des signes cliniques et du niveau des médiateurs mastocytaires[15] mais jamais avec une rémission complète.
- l'Interféron-alpha et 2-CdA peuvent apporter un bénéfice thérapeutique dans certains cas de MS, mais ces molécules manquent de spécificité ; elles ne visent pas l’anomalie moléculaire présente dans la majorité des cas de MS, à savoir la mutation activatrice de KIT.
- la midostaurine, un inhibiteur de kinase actif sur le KIT. Il a une certaine efficacité contre les formes agressives de mastocytoses, même en cas de leucémie[16]. L'autorisation de mise sur le marché a été obtenue en 2017[17].
- la transplantation de cellules souches sanguines allonge la survie dans les formes agressives[18].
- Le masitinib améliore les symptômes[19]. Le laboratoire AB Science a déposé une demande d'AMM [20]auprès de l'EMA est également à l'étude [21]. Malgré le refus de celle-ci[22],AB Science a décidé de reprendre ses essais cliniques depuis le début.
Personnalités atteintes de la mastocytose
modifierChristopher Reeve (1952-2004), interprète de Superman
Notes et références
modifier- Golden D.B & Carter M.C (2019) Insect sting anaphylaxis — or mastocytosis—or something else ? . The Journal of Allergy and Clinical Immunology: In Practice, 7(4), 1117-1123.
- Lim KH, Tefferi A, Lasho TL et al. Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors, Blood, 2009;113:5727-5736
- Castells M, Metcalfe DD, Escribano L, Diagnosis and treatment of cutaneous mastocytosis in children: practical recommendations, Am J Clin Dermatol, 2011;12:259-270
- Theoharides TC, Valent P, Akin C, Mast cells, mastocytosis, and related disorders, N Engl J Med, 2015;373:163-172
- "le monde science, 03-03-2016: une maladie rare éclaire les mécanismes de la dépression"
- (en) J Longley, TP Duffy et S Kohn, « The mast cell and mast cell disease », J Am Acad Dermatol., vol. 32, no 4, , p. 545-561; quiz 562-4. (PMID 7896943)
- (en) WA Alto et L Clarcq, « Cutaneous and systemic manifestations of mastocytosis », Am Fam Physician, vol. 59, no 11, , p. 3047-54, 3059-60. (PMID 10392589, lire en ligne)
- Cohen SS, Skovbo S, Vestergaard H et al. Epidemiology of systemic mastocytosis in Denmark, Br J Haematol, 2014;166:521-528
- Horny MP, Metcalfe DD, Bennett JM. Mastocytosis. In: Swerdlow SH, Campo E, Harris NL, eds. WHO classification of tumors of hematopoietic and lymphoid tissues. Lyon, France: International Agency for Research and Cancer, 2008:54-63.
- Kristensen T, Vestergaard H, Møller MB, Improved detection of the KIT D816V mutation in patients with systemic mastocytosis using a quantitative and highly sensitive real-time qPCR assay, J Mol Diagn, 2011;13:180-188
- B. Guillot, N. Kluger, « Mastocytoses », sur www.therapeutique-dermatologique.org, (consulté le )
- Lim KH, Tefferi A, Lasho TL, et al. Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors, Blood, 2009;113:5727-5736
- Georgin-Lavialle S, Lhermitte L, Dubreuil P, Chandesris MO, Hermine O, Damaj G, Mast cell leukemia, Blood, 2013;121:1285-1295
- Delaporte E, Piérard E, Wolthers BG et al. Interferon-alpha in combination with corticosteroids improves systemic mast cell disease, Br J Dermatol, 1995;132:479-482
- Barete S, Lortholary O, Damaj G et al. Long-term efficacy and safety of cladribine (2-CdA) in adult patients with mastocytosis, Blood, 2015;126:1009-1016
- Gotlib J, Kluin-Nelemans HC, George TI et al. Efficacy and safety of midostaurin in advanced systemic mastocytosis, N Engl J Med, 2016;374:2530-2541
- (en) « Rydapt | European Medicines Agency » (consulté le )
- Ustun C, Reiter A, Scott BL et al. Hematopoietic stem-cell transplantation for advanced systemic mastocytosis, J Clin Oncol, 2014;32:3264-3274
- Lortholary O, Chandesris MO, Bulai Livideanu C et al. Masitinib for treatment of severely symptomatic indolent systemic mastocytosis: a randomised, placebo-controlled, phase 3 study, Lancet, 2017;389:612-620
- (en) « demande d'AMM »,
- (en) « Masitinib pour la mastocytose », sur The Lancet,
- (en) « Refus d'AMM », sur AB Science,
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- L'Afirmm, Association Française pour les Initiatives de Recherche sur le Mastocyte et Les Mastocytoses
- Fiche Orphanet
Bibliographie
modifier- Valent P (2020) KIT D816V and the cytokine storm in mastocytosis: production and role of interleukin-6. haematologica, 105(1), 5.