O-Acétylsérine
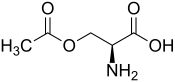
La O-acétylsérine est un composé organique de formule chimique CH3COOCH2CH(NH2)COOH. Il s'agit d'un acide α-aminé non protéinogène dérivé de la sérine par acétylation à partir de l'acétyl-CoA sous l'effet de la sérine O-acétyltransférase. C'est un intermédiaire de la biosynthèse de la cystéine chez les bactéries et les plantes, qui la convertissent en cystéine par la cystéine synthase[2]. Sa présence chez l'homme résulte du métabolisme du microbiote intestinal ou de l'absorption directe par l'alimentation.
| O-Acétylsérine | |
| |
| Structure de l'O-acétyl-L-sérine | |
| Identification | |
|---|---|
| Nom UICPA | O-acétyl-L-sérine |
| Synonymes |
acétate de L-sérine |
| No CAS | (chlorhydrate) |
| DrugBank | DB01837 |
| PubChem | 99478 |
| ChEBI | 17981 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H9NO4 [Isomères] |
| Masse molaire[1] | 147,129 3 ± 0,006 g/mol C 40,82 %, H 6,17 %, N 9,52 %, O 43,5 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'accumulation d’O-acétylsérine est utilisée par les plantes comme signal d'une carence en soufre afin d'accroître l'expression des gènes impliqués dans l'assimilation du soufre. A contrario, sa production est inhibée par la cystéine, qui agit en dissociant le complexe enzymatique cystéine synthase, constitué d'une sérine O-acétyltransférase et d'une O-acétylsérine (thiol)-lyase, ce qui inactive la sérine O-acétyltransférase[3] et bloque donc la production d’O-acétylsérine.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Rüdiger Hell, « Molecular physiology of plant sulfur metabolism », Planta, vol. 202, no 2, , p. 138-148 (PMID 9202491, DOI 10.1007/s004250050112, lire en ligne)
- (en) Hankuil Yi, Ashley Galant, Geoffrey E. Ravilious, Mary L. Preuss et Joseph M. Jez, « Sensing Sulfur Conditions: Simple to Complex Protein Regulatory Mechanisms in Plant Thiol Metabolism », Molecular Plant, vol. 3, no 2, , p. 269-279 (PMID 20080815, DOI 10.1093/mp/ssp112, lire en ligne)