Oxydation de Pinnick
L'oxydation de Pinnick est une réaction de chimie organique consistant en une oxydation d'un aldéhyde en l'acide carboxylique correspondant. Elle est mise au point en 1981 par Harold Pinnick à partir des travaux de Lindgren et Kraus[1].
Le réactif oxydant est le chlorite de sodium et l'ajout au milieu réactionnel de 2-méthylbut-2-ène permet d'éviter la suroxydation du substrat[1]. La réaction est menée en présence d'un tampon de dihydrogénophosphate de sodium[1].
Mécanisme
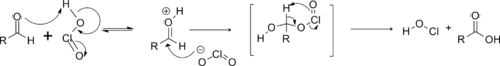
modifierLe mécanisme réactionnel commence par la formation d'acide chloreux par réaction entre le chlorite et le dihydrogénophosphate[1].
L'acide chloreux protone ensuite l'aldéhyde, ce qui accentue l'électrophilie de son carbone fonctionnel, qui subit alors une attaque nucléophile par l'ion chlorite libéré. Un mécanisme concerté permet l'élimination de l'acide hypochloreux et la formation de l'acide carboxylique souhaité[1].
Réactions secondaires
modifierL'acide hypochloreux créé lors de la réaction est responsable de deux réactions secondaires.
Dans la première, il réagit avec les ions chlorite pour former du dioxyde de chlore et des ions chlorure.
L'acide hypochloreux est un oxydant plus fort que l'ion chlorite[2]. Il va donc avoir tendance à oxyder d'autres fonctions du substrat que la fonction aldéhyde. Pour éviter cette suroxydation, on ajoute au milieu un excès de 2-méthylbut-2-ène[1].

Utilisations
modifierL'utilisation du 2-méthylbut-2-ène permet d'oxyder une large gamme de substrats insaturés sans attaquer les doubles liaisons carbone-carbone, même dans le cas d'aldéhydes α,β-insaturés[1]. Les groupes hydroxyle[1], époxyde, éther de benzyle, halogénures et stannanes sont stables dans les conditions de la réaction[2],[3],[4],[5].
L'éventuel centre stéréogène en α du carbonyle n'est pas modifié par la réaction[1]. Cette propriété a été exploitée lors de synthèses totales de molécules contenant des centres stéréogènes en α des fonctions à oxyder. C'est par exemple le cas dans la synthèse de la ditryptophénaline par Overman en 2001, où un alcool est transformé en acide carboxylique par l'enchainement d'une oxydation de Dess-Martin et d'une oxydation de Pinnick[1] ou dans la synthèse de l'acide zaragozique pour laquelle une oxydation de Swern précède l'oxydation de Pinnick[1]. Dans ce dernier exemple, d'autres réactions d'oxydation, comme l'oxydation de Jones ou l'oxydation de Ley, ont été tentées, sans succès[1].
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pinnick oxidation » (voir la liste des auteurs).
- Kürti et Czakó 2005, p. 354.
- Dalcanale, E. et Montanari, F., « Selective Oxidation of Aldehydes to Carboxylic Acids with Sodium Chlorite-Hydrogen Peroxide », Journal of Organic Chemistry, vol. 51, , p. 567–569 (DOI 10.1021/jo00354a037).
- ↑ Ishihara, J. ; Hagihara, K. ; Chiba, H. ; Ito, K. ; Yanagisawa, Y. ; Totani, K et Tadano, K., « Synthetic studies of viridenomycin. Construction of the cyclopentene carboxylic acid part », Tetrahedron Lett., vol. 41, , p. 1771–1774 (DOI 10.1016/S0040-4039(00)00013-7).
- ↑ Kuramochi, K. ; Nagata, S. ; Itaya, H. ; Takao, H. et Kobayashi, S., « Convergent Total Synthesis of epolactaene: application of bridgehead oxiranyl anion strategy », Tetrahedron Lett., vol. 40, , p. 7371–7374 (DOI 10.1016/S0040-4039(99)01512-9).
- ↑ Raach, A. et Reiser, O., « Sodium Chlorite-Hydrogen Peroxide, a Mild and Selective Reagent for the Oxidation of Aldehydes to Carboxylic Acids », Journal für praktische Chemie, vol. 342, , p. 605–608 (DOI 10.1002/1521-3897).
Bibliographie
modifier- (en) László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis : Background and Detailed Mechanisms, Elsevier Academic press, (ISBN 0-12-429785-4)
- Nicolas Rabasso, Chimie organique : 2. Hétéroéléments, stratégies de synthèse et chimie organométallique, De Boeck, coll. « LMD Chimie », , 536 p. (ISBN 978-2-8041-0168-8, lire en ligne)

