Phosmet
| Phosmet | |||
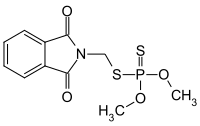
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2-(diméthoxyphosphinothioylthiométhyl)isoindoline-1,3-dione | ||
| No CAS | |||
| No ECHA | 100.010.899 | ||
| No CE | 211-987-4 | ||
| No RTECS | TE2275000 | ||
| PubChem | 12901 | ||
| ChEBI | 38786 | ||
| SMILES | |||
| InChI | |||
| Apparence | cristaux incolore | ||
| Propriétés chimiques | |||
| Formule | C11H12NO4PS2 [Isomères] |
||
| Masse molaire[1] | 317,321 ± 0,021 g/mol C 41,64 %, H 3,81 %, N 4,41 %, O 20,17 %, P 9,76 %, S 20,21 %, |
||
| Propriétés physiques | |||
| T° fusion | 70,85 °C[2] | ||
| Solubilité | 0,03 g·l-1 à 20 °C | ||
| Masse volumique | 1,03 g·cm-3 | ||
| Pression de vapeur saturante | 0,133 Pa à 49,85 °C | ||
| Précautions | |||
| SGH[3] | |||
| H302, H312, H410, P264, P273, P280 et P501 |
|||
| Transport[3] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 18 mg·kg-1 (oiseau sauvage, oral)[4] 707 mg·kg-1 (poule, oral)[4] |
||
| CL50 | 65 mg/m3/4 h (chat, inhalation)[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le phosmet est un insecticide organophosphoré non-systémique, dérivé du phtalimide, utilisé sur les plantes et les animaux. Il tue, à faible dose, les insectes (et accidentellement d'autres organismes) en inhibant l'acétylcholinestérase quand il pénètre dans l'organisme (par contact, ingestion et/ou inhalation). Ceci induit une accumulation du neurotransmetteur acétylcholine (ACh) au niveau des synapses cholinergiques, qui a son tour entraîne une toxicité (muscarinique et nicotinique) due à une activation anormale, intense et prolongée du site récepteur[5].
Histoire modifier
Il a été enregistré comme pesticide insecticide, et mis sur le marché pour la première fois aux États-Unis en 1966, avant d'être de plus en plus utilisé dans le monde, et notamment dans de nombreux pays d'Europe, du Moyen-Orient, d'Afrique, y compris contre les puces, les tiques et divers acariens d'animaux de compagnie[6].
Dans les années 2000-2020, il est très utilisé les pommiers, les pêchers (pêches/nectarines), les oliviers, les cultures d'agrumes, les fruits à pépins, ou encore sur la pomme de terre et [7],[8].
La « substance active du pesticide phosmet » a fait l'objet d'une revue d'étude par l'EFSA dans le cadre du renouvellement de l'approbation des substances actives de pesticides [9], après l'examen par des pairs des évaluations de risques antérieurement produites pour l'UE par l'Espagne et la Grèce (État membre rapporteur et co-rapporteur)[10]. Ce renouvellement d'approbation a été demandé par Gowan Comércio Internacional e Serviços, Limitada[8]. L'évaluation a porté sur des utilisations jugées représentatives du phosmet comme insecticide sur les agrumes, les fruits à pépins, les pêches/nectarines et les pommes de terre (utilisations au champ). L'EFSA a identifié à cette occasion des informations manquantes, sources de préoccupation critique, et pourtant requises par le cadre réglementaire[8]. Selon l'EFSA il existe un « déficit de données » concernant la toxicité du phosmet pour les mammifères (absence d'étude d'effets sur la neurotoxicité et le développement). Pour l'Homme, « les estimations de l'exposition non alimentaire (c'est-à-dire pour l'opérateur, le travailleur, le spectateur et le résident) pour toutes les utilisations représentatives selon le tableau GAP étaient supérieures à (A)AOEL même avec l'utilisation d'un équipement de protection individuelle ou d'une application des mesures d'atténuation disponibles dans le calculateur de l'EFSA »[8]. De plus, « les estimations provisoires de l'exposition alimentaire pour les consommateurs dépassaient la dose journalière admissible (DJA) et la dose aiguë de référence (ARfD) pour toutes les utilisations représentatives évaluées. Aucune LMR n'a été proposée pour les utilisations représentatives dans les agrumes, les fruits à pépins, les pêches/nectarines et la pomme de terre. Il est à noter que les résidus au niveau de la valeur par défaut de la LMR de 0,01 mg/kg dépasseraient également l'ARfD pour plusieurs des cultures évaluées ». l'EFSA estime que la Phosmet ne répond pas aux critères de perturbation endocrinienne pour l'homme et les organismes non ciblés, sur la base des données et de l'évaluation disponibles et selon les modalités de l'EATS[11],[8], mais cite des préoccupations écotoxicologique « critiques » pour les mammifères sauvages et les oiseaux (cf. reprotoxicité du phosmet), un « risque aigu et chronique » pour les invertébrés aquatiques, un « risque aigu » pour les abeilles pollinisatrices et sources de miel, ainsi qu'un « risque élevé » pour les arthropodes non-cible[8], et ce pour « pour toutes les utilisations du phosmet ».
Usages modifier
Il est utilisé principalement sur les pommiers pour lutter contre le carpocapse, mais également sur de nombreuses autres cultures fruitières et ornementales, ainsi que sur la vigne pour lutter notamment contre les pucerons, les acariens, et les mouches des fruits[12].
Sécurité modifier
Le phosmet figure sur la liste EPA des substances extrêmement dangereuses établie pour le plans d'urgence des États-Unis (US Emergency Planning). Il est hautement toxique pour les invertébrés et d'autres organismes, mais il se dégrade assez vite, et ses composés de dégradation par hydrolyse sont non toxiques. Peu soluble dans l'eau, il est considéré comme relativement peu mobile et peu persistant dans le sol et l'environnement du sol (on en trouve 0,0079 à 0,2 μg/l dans les eaux souterraines mais de 0,3 à 0,63 μg/l dans les eaux de surface)[13].
On a trouvé des résidus de phosmet dans divers types d'aliments mis sur le marché, dont par exemple des fruits, la pomme de terre, des noisettes, l'huile d'olive ou le miel[14],[15].
Toxicologie modifier
Il s'est montré reprotoxique et tératogènes dans le modèle animal chez le rat de laboratoire[16] et le Danio rerio[17].
Écotoxicologie modifier
En termes d'écotoxicologie, il est hautement toxique pour tous les insectes, abeilles y compris[12].
Mark Purdey a déclenché une controverse en suggérant que le phosmet pourrait aussi avoir joué un rôle clé dans l'épidémie d'encéphalopathie spongiforme bovine (ESB)[18].
En 2010, une étude a montré que chaque augmentation d'un facteur 10 du taux urinaire de métabolites organophosphorés était associée à une augmentation de 55 % à 72 % des risques d'apparition du trouble du déficit de l'attention/hyperactivité (TDA/H) chez l'enfant[19].
Dans les années 2010, peu de données étaient disponibles en termes d'effets sublétaux sur les poissons ; on a montré en 2021 qu'il est hépatotoxique et neurotoxique pour le cerveau de la truite Oncorhynchus mykiss juvénile après 24, 48, 72 et 96 h d'exposition à des taux de 5, 25 et de 50 μg/l dans l'eau. Il diminue la glycémie, le taux de protéines et de cholestérol de la truite et élève fortement l'activité de l'alanine aminotransférase, de l'aspartate aminotransférase et de la phosphatase alcaline (trois marqueurs d'hépatotoxicité). Son action anticholinestérasique atteint 46 % dans le cerveau des poissons exposés.
Dans le foie comme dans le cerveau, l'activité de la superoxyde dismutase, de la catalase et de la glutathion peroxydase augmente alors que le taux glutathion croît, de même que les substances réactives à l'acide thiobarbiturique. Le phosmet induit aussi un stress oxydatif[7].
Des effets neurotoxiques et de toxicité pour le développement juvénile et larvaire, à des doses sublétales avaient déjà été décrits, in vivo, respectivement chez Oncorhynchus kisutch et Danio rerio en 2020[17],[20]. L'EFSA, en mars 2021, note qu'exposés à seulement 1,0 μg/L de phosmet, une mortalité de 25 % des poissons femelles a été observée lors d'un test fait en laboratoire[21].
En 2023, une étude a porté sur les effets de la législation et des plans d'action nationaux visant à réduire le phénomène de dérive des pesticides vers l'environnement périphérique non agricoles (plans obligatoires dans tous les États-membres de l'UE)[22]. Elle s'est basée sur l'analyse des résidus de pesticides trouvés dans 306 échantillons d'herbe prélevés sur 88 sites (sur 6 ans, entre 2014 et 2020) dans l'une des régions où la viticulture et la pomiculture sont parmi les plus intensives en Europe : la province autonome de Bolzano-Tyrol du Sud, en Italie[22].
314 molécules ont été recherchées (par chromatographie en phase gazeuse et spectrométrie de masse)[22]. Les résultats montrent que le nombre de pesticides par site et le nombre global de pesticides tendait à diminuer sur la période[22]. Les molécules les plus retrouvées étaient des fongicides (ex : fluazinam) retrouvé sur 74 % des sites et captane sur 60 % des sites, avec 53 sites contaminés sur 88) ; et parmi les insecticides, c'est le phosmet qui était le plus présent (retrouvé dans 49 % des 88 sites, avec un pic au printemps). Globalement, le taux de molécules toxiques pour l'Homme a « considérablement augmenté au fil des ans en ce qui concerne la reprotoxicité (de 21 % des substances détectées en 2014, à 88 % en 2020) et la toxicité spécifique pour certains organes cibles (0 % en 2014 à 21 % en 2020)[22]. Les taux de substances associées à une perturbation endocrinienne (89 % des substances au fil des ans) ou à des propriétés cancérigènes (45 % des substances au fil des ans) sont restés constants (...). Les risques écotoxicologiques potentiels des résidus détectés concernant la toxicité aiguë par contact pour les abeilles sont restés élevés au cours des années d'étude, tandis que la toxicité aiguë et chronique pour le ver de terre a diminué »[22].
Voir aussi modifier
Bibliographie modifier
- European Food Safety Authority (EFSA), Maria Anastassiadou, Maria Arena et Domenica Auteri, « Peer review of the pesticide risk assessment of the active substance phosmet », EFSA Journal, vol. 19, no 3, (PMID 33747228, PMCID PMC7968347, DOI 10.2903/j.efsa.2021.6237, lire en ligne, consulté le )
- European Food Safety Authority (EFSA), Giulia Bellisai, Giovanni Bernasconi et Alba Brancato, « Review of the existing maximum residue levels for phosmet according to Article 12 of Regulation (EC) No 396/2005 », EFSA Journal, vol. 20, no 7, (PMID 35873726, PMCID PMC9297124, DOI 10.2903/j.efsa.2022.7448, lire en ligne, consulté le ).
- (en) Bala Murali Krishna Vasamsetti, Kyongmi Chon, Juyeong Kim et Jin-A. Oh, « Transcriptome-Based Identification of Genes Responding to the Organophosphate Pesticide Phosmet in Danio rerio », Genes, vol. 12, no 11, , p. 1738 (ISSN 2073-4425, DOI 10.3390/genes12111738, lire en ligne, consulté le )
- (en) A. C. Padilha, B. Piovesan, M. C. Morais et J. de B. Pazini, « Toxicity of insecticides on Neotropical stingless bees Plebeia emerina (Friese) and Tetragonisca fiebrigi (Schwarz) (Hymenoptera: Apidae: Meliponini) », Ecotoxicology, vol. 29, no 1, , p. 119–128 (ISSN 0963-9292 et 1573-3017, DOI 10.1007/s10646-019-02150-x, lire en ligne, consulté le )
- (en) Lajpreet Kaur, Afreen J. Rahman, Anju Singh et Mallika Pathak, « Binding studies for the interaction between hazardous organophosphorus compound phosmet and lysozyme: Spectroscopic and In-silico analyses », Journal of Molecular Liquids, vol. 355, , p. 118954 (ISSN 0167-7322, DOI 10.1016/j.molliq.2022.118954, lire en ligne, consulté le )
- (en) Sehrish Bilal, M. Mudassir Hassan, Muhammad Fayyaz ur Rehman et Muhammad Nasir, « An insect acetylcholinesterase biosensor utilizing WO3/g-C3N4 nanocomposite modified pencil graphite electrode for phosmet detection in stored grains », Food Chemistry, vol. 346, , p. 128894 (ISSN 0308-8146, DOI 10.1016/j.foodchem.2020.128894, lire en ligne, consulté le )
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Phosmet », sur NIST/WebBook
- Phosmet chez Sigma-Aldrich.
- (en) « Phosmet », sur ChemIDplus
- (en) Mirjana B. Colovic, Danijela Z. Krstic, Tamara D. Lazarevic-Pasti et Aleksandra M. Bondzic, « Acetylcholinesterase Inhibitors: Pharmacology and Toxicology », Current Neuropharmacology, vol. 11, no 3, , p. 315–335 (PMID 24179466, PMCID PMC3648782, DOI 10.2174/1570159x11311030006, lire en ligne, consulté le ).
- FAO/WHO (2019). FAO Specifications and Evaluations for Agricultural Pesticides, Phosmet (O,O-dimethyl Sphthalimidomethylphosphorodithioate) Note: Evaluation Report only.. http://www.fao.org/3/ca8627en/ca8627en.pdf
- (en) Firas Muhammed et Demet Dogan, « Toxicity and biochemical responses induced by phosmet in rainbow trout ( Oncorhynchus mykiss ) », Toxicology Research, vol. 10, no 5, , p. 983–991 (ISSN 2045-4538, PMID 34733483, PMCID PMC8557651, DOI 10.1093/toxres/tfab084, lire en ligne, consulté le )
- European Food Safety Authority (EFSA), Maria Anastassiadou, Maria Arena et Domenica Auteri, « Peer review of the pesticide risk assessment of the active substance phosmet », EFSA Journal, vol. 19, no 3, (PMID 33747228, PMCID PMC7968347, DOI 10.2903/j.efsa.2021.6237, lire en ligne, consulté le )
- Cf. article 14 du règlement (CE) n° 1107/2009
- Cette démarche est l'application du règlement d'exécution (UE) n° 844/2012 de la Commission, tel que modifié par le règlement d'exécution (UE) n° 2018/1659 de la Commission.
- , modalités définies au point 3.6.5 de l'annexe II du règlement (CE) n° 1107/2009, tel que modifié par le règlement (UE) 2018/605 de la Commission
- (en) « Toxicology of Phosmet » [Webpage] (consulté le ).
- EPA (2010). Risks of Phosmet Use to the Federally Threatened and Endangered California Tiger Salamander (Ambystoma californiense) ; https://www3.epa.gov/pesticides/endanger/litstatus/effects/redleg-frog/2010/phosmet/assessment.pdf
- (en) Elizabeth A. Jara et Carl K. Winter, « Safety levels for organophosphate pesticide residues on fruits, vegetables, and nuts », International Journal of Food Contamination, vol. 6, no 1, , p. 6 (ISSN 2196-2804, DOI 10.1186/s40550-019-0076-7, lire en ligne, consulté le )
- (en) Yasser El-Nahhal, « Pesticide residues in honey and their potential reproductive toxicity », Science of The Total Environment, vol. 741, , p. 139953 (DOI 10.1016/j.scitotenv.2020.139953, lire en ligne, consulté le )
- Al-Taher A.Y (2009). Adverse effects of phosmet on male fertility in rats. Veterinary Medical Journal Giza, 57(4), 769-781.
- (en) Bala Murali Krishna Vasamsetti, Nam Seok Kim, Kyongmi Chon et Hong-Hyun Park, « Developmental Toxic Effects of Phosmet on Zebrafish (Danio rerio) Embryos », The Korean Journal of Pesticide Science, vol. 24, no 4, , p. 343–351 (ISSN 1226-6183 et 2287-2051, DOI 10.7585/kjps.2020.24.4.343, lire en ligne, consulté le )
- (en) Purdey M, « High-dose exposure to systemic phosmet insecticide modifies the phosphatidylinositol anchor on the prion protein: the origins of new variant transmissible spongiform encephalopathies? », Med. Hypotheses, vol. 50, no 2, , p. 91–111 (PMID 9572563, DOI 10.1016/S0306-9877(98)90194-3).
- (en) « Organophosphate Pesticides Linked to ADHD », sur Medscape, (consulté le ).
- (en) Cathy A. Laetz, David H. Baldwin et Nathaniel L. Scholz, « Sublethal neurotoxicity of organophosphate insecticides to juvenile coho salmon », Aquatic Toxicology, vol. 221, , p. 105424 (DOI 10.1016/j.aquatox.2020.105424, lire en ligne, consulté le )
- voir la section 6 Endocrine disruption properties in European Food Safety Authority (EFSA), Maria Anastassiadou, Maria Arena et Domenica Auteri, « Peer review of the pesticide risk assessment of the active substance phosmet », EFSA Journal, vol. 19, no 3, (PMID 33747228, PMCID PMC7968347, DOI 10.2903/j.efsa.2021.6237, lire en ligne, consulté le )
- (en) Ramona Cech, Johann G. Zaller, Angeliki Lyssimachou et Peter Clausing, « Pesticide drift mitigation measures appear to reduce contamination of non-agricultural areas, but hazards to humans and the environment remain (CC BY 4.0) », Science of The Total Environment, vol. 854, , p. 158814 (DOI 10.1016/j.scitotenv.2022.158814, lire en ligne, consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phosmet » (voir la liste des auteurs).


