Processus d'oxydation avancé
Les processus d'oxydation avancés (abréviation POA), au sens large, sont un ensemble de procédures de traitement physico-chimique et Physico-biochimique conçues pour détruire des matières organiques (et parfois inorganiques) en suspension ou en solution dans l'eau d'effluents domestiques, urbains ou industriels, par oxydation via des réactions avec des radicaux hydroxyles (HO-)[1].
Dans le domaine de la chimie du traitement des eaux usées[2],[3], cette expression désigne plus spécifiquement un sous-ensemble de ces processus chimiques fondés sur l'ozone (O3), le peroxyde d'hydrogène (H2O2) et le dioxyde de carbone (CO2) ou bien la lumière UV[4] et plus rarement sur les ultrasons (sonochimie) ; dans tous ces cas, on parle aussi d’ « oxydation chimique in situ ».
Les contaminants organiques ou semi-organiques sont convertis — dans une large mesure — en composés inorganiques stables (eau et dioxyde de carbone principalement, et sels de métaux ou de métalloïdes). Il s’agit donc d’un processus accéléré de minéralisation[5]. Le POA cherche à réduire la pollution organique et la toxicité de l’effluent au point qu’il puisse être potable ou réintroduit sans risque dans le milieu récepteur ou, au pire, dans un traitement conventionnel des eaux usées. Le POA, seul, ne peut éliminer les toxiques minéraux et métalliques qui nécessitent un traitement complémentaire. Il détruit des polluants qui résistent sans cela aux stations d’épuration comme les résidus de pesticides, d'antibiotiques et d'autres résidus de médicaments et de nombreux perturbateurs endocriniens.
Histoire
modifierLe linge était, autrefois, blanchi (draps, nappes…) en l’étendant au soleil (en l’exposant à ses UV) sur des prairies (où les végétaux produisent par photosynthèse de l’oxygène natif), mais la raison pour laquelle l'oxydation pouvait chimiquement blanchir et désinfecter le linge encore humide n'était pas comprise.
Des processus d'oxydation impliquant HO- sont connus et utilisés depuis la fin du XIXe siècle (comme dans le réactif de Fenton qui était toutefois alors utilisé comme réactif analytique).
Dans les années 1960, on comprend l'effet microbicide de systèmes chimiques générateurs du radical libre hydroxyle[6]. Certains aquariophiles, élevages de poissons et aquariums publics utilisent des lampes à rayons ultraviolets pour désinfecter leur eau (non sans produire quelques molécules secondaires parfois indésirables).
Le peroxyde d’hydrogène est testé dans la réaction de Fenton contre des polluants de type pesticides, mais il nécessite des intrants et n’est pas toujours efficace contre certains polluants[7],[8]. La « réaction de Fenton électrochimiquement assistée » permet de dégrader et de minéraliser[5] des polluants organiques variés dont les chlorophénols, les produits phytosanitaires (insecticides, herbicides, fongicides), les polluants industriels (nitrophénols ou benzène par exemple[9]).
En 1987, Glaze et al. suggèrent que l’on puisse générer in situ dans l’eau HO- « en quantité suffisante pour affecter la purification de l'eau », tout en définissant le terme « processus d'oxydation avancés » pour la première fois en 1987[1].
Les POA se développent ensuite progressivement, surtout dans les pays riches en raison de coûts d’investissement et d’exploitation relativement élevés et d’une complexité plus importante que l’épuration par oxygénation.
Dans les années 1990, dans le cadre de recherche de solutions alternatives aux systèmes alors disponibles d'épuration de l'eau[10], on cherche à utiliser le radical libre hydroxyde, car il est très hautement réactif, et caractérisé par une demi-vie d'environ 10−9 seconde[11],[12] et un potentiel d’oxydoréduction extrêmement élevé (2,81 V par rapport à l’électrode normale à hydrogène) ce qui en fait, l’un des oxydants les plus puissants utilisables en traitement des eaux.
Alors que la démographie mondiale continue à fortement progresser, que les besoins en eau augmentent et que le dérèglement climatique perturbe la gestion de la ressource en eau, la réutilisation de l'eau intéresse de plus en plus de monde. Par ailleurs, les réglementations se font plus strictes concernant les contaminants. Ce contexte fait que les POA sont de plus en plus appréciés pour le traitement tertiaire de l’eau, face à un grand-public qui exige de plus en plus une eau indemne des contaminants dits récalcitrants (tels que pesticides et perturbateurs endocriniens que l'on peine à éliminer de l'eau potable).
Les années 1980/1990 voient apparaitre de nouvelles expressions comme « procédés avancés d’oxydation », « électrodépollution »[13] ou « désinfection électrochimique »[14], « aération électrolytique »[15], « oxydation anodique »[16].
Des groupes commerciaux ont installé environ cinq cents grandes installations POA dans le monde, principalement en Europe et aux États-Unis, mais d'autres pays (Chine…) montrent un intérêt croissant pour les POA.
Processus
modifierLes processus d'oxydation avancés (POA) reposent sur la production "in situ'' (dans l’eau) de radicaux hydroxyle (radical libre noté HO-).
Dans la nature, HO- se forme spontanément dans la vapeur d'eau atmosphérique sous l’effet des UV solaires ou de l'ozone ou d'oxyde nitreux, mais il est si réactif qu’il disparaît presque aussitôt après son apparition.
Les « dérivés réactifs de l’oxygène » (DRO) que l’on nomme aussi « espèces réactives de l’oxygène » (ERO) sont les oxydants les plus puissants connus pouvant être générés et utilisés directement dans l'eau : ils peuvent pratiquement dégrader par oxydation tout composé présent dans la matrice de l'eau, souvent à une vitesse de réaction contrôlée par diffusion.
Efficacité
modifierCorrectement appliqué dans le domaine de l’épuration de l'eau, les POA peuvent réduire la teneur en contaminants de plusieurs centaines de ppm à moins de 5 ppb et donc réduire considérablement la DCO et le COT, ce qui leur a valu le titre de « processus de traitement de l'eau du XXIe siècle »[17] et leur a fait susciter beaucoup d'espoir[18].
Les radicaux libres hydroxyle oxydent un grand nombre de composés organiques presque instantanément (vitesse d’oxydation 109 fois plus élevée que l’ozone pourtant considéré comme l’un des oxydants les plus puissants dans la nature[19],[20]). Ils réagissent y compris avec les doubles liaisons carbone-carbone et attaquent les noyaux aromatiques, composants majeurs de nombreux composés réfractaires toxiques, cancérigènes et/ou mutagènes[21].
Production de radicaux hydroxyle
modifierIls sont fabriqués au moyen d'un ou de plusieurs oxydants primaires qui sont par exemple :
Ces super-oxydants peuvent être produits par :
- des sources intenses d'énergie (par exemple, la lumière ultraviolette) ;
- des catalyseurs (par exemple, du dioxyde de titane en poudre, irradié par une lumière UV avec certaines conditions de pH[24]) ;
- des ultrasons : à haute fréquence, les ultrasons génèrent des radicaux libres (HO•, HO2• et O•) par rupture homolytique de la molécule d’eau ou d’oxygène[25],[26],[27]. Et à haute fréquence, ils génèrent des peroxydes dans l'eau. Ils détruisent ainsi les mauvaises odeurs de l'effluent[28] (on les utilise même pour désodoriser des boues d'épuration[29]). En créant des bulles de cavitation, les ultrasons génèrent des micro-jets de liquide et des forces de cisaillement extrêmes au moment de leur implosion. Ceci contribue à mélanger le milieu réactionnel, et à détruire plus rapidement les virus et microorganismes[30]. Chaque implosion d'une bulle de cavitation fait localement monter à plusieurs milliers de degrés la température de l'eau (2 000 à 5 000 °C, bien assez pour des micro-réactions de pyrolyse), avec un point de pression de plusieurs centaines d’atmosphères (500 atm). Ce point éjecte des radicaux (issus de la sonolyse de l’eau) qui réagiront avec les composés en solution qu'ils rencontreront. Le pH a une importance[31].
Inconvénients et limites
modifierLe procédé présente les lacunes et les inconvénients[32] suivants :
- il exige un contrôle fin et constant de la réaction et de son rendement : la réaction n’est pas sélective ; HO• réagit dès qu’il est formé au contact de la plupart des contaminants organiques qui seront alors rapidement et efficacement fragmentés et convertis en petites molécules inorganiques. Elle ne peut être contrôlée que par les dosages, le choix de séquences et combinaisons précises et pertinentes (pré programmées) de deux ou trois réactifs (oxydants) afin de produire des radicaux hydroxyle pour obtenir un rendement maximal de production de radicaux •OH. Ceci demande une grande technicité et implique des coûts significatifs ;
- les radicaux libres ne sont pas anodins ; les POA nécessitent de produire, manipuler et contrôler des processus et des produits dangereux (ozone, UV, radicaux libres[33]) ;
- si le traitement n’est pas complet, des résidus mal dégradés également dangereux persistent dans l’eau. En présence de polluants, organométalliques ou métalliques, métalloïdes ou radionucléides rendus inertes par des chélateurs naturels ou synthétiques, les POA peuvent libérer ces métaux indésirables dans l’eau (et les rendre immédiatement libres) ; de même pour des métalloïdes toxiques (ex. : arsenic), des radionucléides, des métaux volatils (mercure) ou à fort pouvoir catalytiques (métaux du groupe du platine, titane susceptible de favoriser juste après et en aval du traitement des recombinaisons polluantes d’atome ou molécules libérées par le processus de POA) qui auraient été antérieurement complexés dans une matrice organique. Ces métaux ou métalloïdes doivent ensuite être traités dans l’effluent avant d’être libérés dans la nature (tout particulièrement si l’eau doit être réutilisée pour des usages agricoles ou d’eau potable). Dans le cas de la photocatalyse, si l'eau est très turbide l'effet de l'irradiation UV sur le catalyseur diminue, car les UV sont absorbés par la matière opaque en solution ou en suspension dans l'eau ;
- le coût des AOP est élevé, car nécessitant dans la plupart des cas une installation sophistiquée et un apport continu de réactifs chimiques coûteux. Ces AOP consomment en outre des radicaux hydroxyle et d'autres réactifs, proportionnellement à la quantité de contaminants à éliminer. La production d'ozone et de peroxyde d'hydrogène consomme de l'énergie ;
- certains types d’AOP impliquent de pré traiter des eaux usées pour atteindre une performance fiable, ce qui augmente les coûts et est exigeant en termes techniques et de personnel. Par exemple, la présence d'ions bicarbonate (HCO3−) réduit sensiblement la concentration des radicaux •OH en raison de processus de nettoyage qui produisent H2O et une espèce beaucoup moins réactive, •CO3−[17]. Le bicarbonate doit donc être éliminé avant le processus d’AOP qui sinon sera compromis ;
- un excès de peroxyde d'hydrogène H2O2 dans l'eau permet de conserver un pouvoir désinfectant. Cependant, il ne faut pas en Europe dépasser la valeur maximale autorisée de 0,5 mg/L dans l’eau traitée, et ce H2O2 peut être source de réactions parasites ou indésirables ;
- il n'est pas rentable d'utiliser seulement des AOP pour traiter une grande quantité d'eaux usées ; il est préférable de les déployer en épuration au stade final (dit tertiaire) après qu'un primaire et un secondaire ont eu éliminé une grande partie des contaminants.
Intérêts, avantages
modifierLes AOP présentent plusieurs avantages inégalés dans le domaine du traitement de l'eau.
En raison de la réactivité du radical HO• qui est immédiate et sans discrimination avec presque tous les polluants aqueux, les AOP sont utilisables dans de nombreux scénarios (quand de nombreux contaminants organiques doivent être éliminés simultanément). Ils sont particulièrement utiles pour détruire en phase aqueuse des molécules ou des matières organiques écotoxiques difficilement dégradables par d’autres moyens, et en particulier les nombreux polluants émergents dits réfractaires ou biorécalcitrants à la biodégradation et qui tendent à être bioaccumulés dans le réseau trophique et notre chaîne alimentaire et dont certains sont perturbateurs endocriniens à très faible dose[34] (dont certains surfactants[35], paracétamol[36], hormones contraceptives ou issues d'élevage[37], bisphénol[38],[39],[40],[41]) sans nécessité de les collecter, ni de transférer ces polluants dans une autre phase (solide ou gazeuse). Il est ainsi possible de détruire directement dans les eaux usées (éventuellement à potabiliser), des polluants aromatiques, la plupart des pesticides ou de leurs résidus (hors métaux et métalloïdes dans le cas des pesticides à base de cuivre, plomb, arsenic, etc.)[42] ; de même pour de nombreux composants pétroliers et les composés organiques volatils[43].
Le traitement permet d’oxyder les anions nitrite, sulfite, cyanure et bromate pour les convertir en d’autres composés inoffensifs tels que NO3−, SO2–
4, CO2 et Br−, respectivement[44].
Le processus de réduction complet du radical HO• aboutit à H2O. Si le processus s’est déroulé dans son intégralité, les AOP n'introduisent donc théoriquement pas de « nouvelle » substance dangereuse dans l’eau (à l'inverse des traitements basés sur l’ajout de désinfectants chlorés, par exemple, où du chlore résiduel persiste, ce qui est un effet recherché dans le cas de l’eau à transporter dans le réseau d’eau potable).
Les POA peuvent aussi assurer un traitement tertiaire, c’est-à-dire conclure un premier traitement d’eaux usées (effluents secondaires)[45].
Dans certains modèles d'AOP, les éléments traces métalliques (ETM) ne peuvent pas être également détruits, mais le processus peut aider à en éliminer certains sous forme de M(OH)x précipité.
La désinfection peut également être obtenue en détruisant au passage les virus, bactéries, cyanophycées, et tous les organismes vivants (excepté s’ils sont protégés dans des biofilms suffisamment résistants pour que le traitement n’ait pas le temps de les détruire intégralement).
Ceci fait de ces AOP une solution intégrée possible à certains problèmes de qualité de l'eau.
Principes
modifierPrincipes chimiques
modifierDe manière simplifiée, la chimie des POA peut être divisée en trois parties[46] :
- formation de HO• ;
- attaque chimique initiale des molécules cibles par HO•, entrainant leur décomposition en fragments ;
- attaques ultérieures (toujours par HO•) des résidus, jusqu'à minéralisation ultime.
Principes physiques
modifierÀ ce jour, les POA peuvent être subdivisés en quatre groupes[34] sur la base du mécanisme de production d'HO• :
- les procédés d’oxydation chimique en phase homogène (H2O2/Fe2+ et H2O2/O3) : le couplage H2O2/Fe2+ est le système d’oxydation avancée le plus connu et le moins complexe, surtout employé dans le traitement des effluents industriels ; le couplage H2O2/O3 est lui plutôt utilisé pour détruire des pesticides et leurs résidus[34] ;
- les procédés photocatalytiques en phase homogène et/ou hétérogène (H2O2/UV, O3/UV et Fe2+/H2O2/UV ; TiO2/UV)[34],[47] ;
- les procédés d’oxydation sonochimique[34] ;
- les procédés d’oxydation électrochimique[34].
Ces procédés diffèrent considérablement ; par exemple, la production d’ozone pour l'ozonation, la production d’UV/H2O2 et l'oxydation photocatalytique reposent sur des processus physicochimiques très différents de génération de HO• :
- processus de POA basé sur les UV/H2O2[45] :
- H2O2 + UV → 2 HO• (le clivage homolytique de la liaison O—O de H2O2 conduit à la formation de deux radicaux HO•) ;
- processus de POA basé sur l’ozone[48],[49] ; on nomme peroxonation le couplage ozone plus peroxyde d’hydrogène qui produit beaucoup plus de radicaux libres qu'avec l'ozonation seule) :
- O3 + HO− → HO2− + O2 (la réaction entre l’ozone (O3) et un ion hydroxyle conduit à la formation de H2O2 (sous forme chargée))
- O3 + HO2− → HO2• + O3−• (une deuxième molécule d’ozone réagit avec le HO2− pour produire le radical ozonure)
- O3−• + H+ → HO3• (ce radical donne HO• lors de la protonation)
- HO3• → HO• + O2
Les étapes de réaction ici présentées ne sont en fait qu'une partie de la séquence de réaction (voir la référence pour plus de détails) ;
- processus de POA basé sur l’oxydation photocatalytique (avec le dioxyde de titane TiO2)[48] :
- TiO2 + UV → e− + h+ (l'irradiation de la surface photocatalytique conduit à un électron excité (e−) et à un entrefer électronique (h+)
- Ti(IV) + H2O ⇌ Ti(IV)-H2O (l'eau s’adsorbe sur la surface du catalyseur)
- Ti(IV)-H2O + h+ ⇌ Ti(IV)-HO• + H+ (l'espace électronique hautement réactif réagira avec l’eau).
- Les étapes de réaction présentées ici ne sont qu'une partie de la séquence de réaction (voir la référence pour plus de détails).
Actuellement, il n'y a pas de consensus sur les mécanismes détaillés du troisième stade du processus, mais des chercheurs ont mis en lumière les processus des attaques initiales (au second stade).
HO• est une espèce radicale, devant se comporter comme un électrophile hautement réactif. Ainsi, deux types d'attaques initiales sont supposées être une abstraction d'hydrogène et une réaction d'addition (réaction organique où au moins deux molécules se combinent pour en former une autre, plus grande).
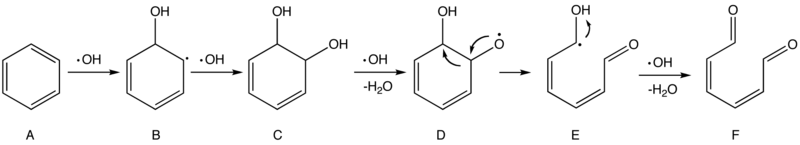
Le schéma ci-dessous décrit un mécanisme possible de l'oxydation du benzène (polluant cancérigène) par les radicaux hydroxyle HO• (proposé en 1994)[50].
Les première et deuxième étapes sont une addition électrophile qui brise le cycle aromatique du benzène (A) et forme deux groupes hydroxyle (–OH) dans l'intermédiaire C.
Ensuite un HO• saisit un atome d'hydrogène dans l'un des groupes hydroxyle, produisant une espèce radicalaire (D) qui est sujette à subir un réarrangement pour former un radical plus stable (E). E, d'autre part, est facilement attaqué par HO• et forme éventuellement du 2,4-hexadiène-1,6-dione (F).
Tant qu'il y a assez de radicaux HO•, les attaques subséquentes contre le composé F se poursuivront jusqu'à ce que les fragments soient tous convertis en petites molécules stables comme H2O et CO2 in fine ; en réalité, ces processus peuvent encore être soumis à une myriade de mécanismes possibles et partiellement inconnus.
Remarques :
- les méthodes électrochimiques, photocatalytiques et sonochimiques consomment généralement moins de réactif et sont plus faciles à automatiser que les autres types de POA[34] ;
- une autre méthode de production du radical hydroxyde HO• est la radiolyse de l'eau[34] par une source fortement radioactive, qui n’est utilisée que dans le cadre de certaines recherches en raison de sa dangerosité.
Prospective
modifierDepuis 1987 (définition du principe des AOP), cette technique s’est rapidement développée (en théorie et via des applications concrètes). Elle pourrait peu à peu remplacer les technologies conventionnelles là où ces dernières sont peu efficaces en termes d’épuration de contaminants organiques « réfractaires » (inorganiques et microbiens).
Les systèmes basés sur le catalyseur TiO2, ou utilisant les UV (H2O2/UV) ou encore les systèmes de type Fenton, photo-Fenton et électro-Fenton, ont été les plus étudiés, mais de nombreux besoins de recherche persistent sur ces AOP, dont pour les optimiser et en réduire les couts.
On cherche à développer de nouveaux AOP modifiés, fiables, efficaces et plus économiques avec par exemple :
- des procédés hybrides couplés à des traitements biologiques conventionnels, pour contourner les contraintes spécifiques des POA et alors les intégrer dans les filières de traitement des effluents domestiques, urbains industriels (et parfois agricoles ?)[34] ;
- des procédés utilisant la lumière solaire naturelle plutôt que des lampes à UV[51] ;
- un dopage TiO2 par des éléments non métalliques qui pourraient améliorer l'activité photocatalytique du titane[52] ;
- l’adjonction d’un traitement par ultrasons pourrait augmenter la production de radicaux hydroxyle et ajouter des effets de cavitation au processus[53],[54].
Précautions
modifierLes sources de radicaux libres et les radicaux libres eux-mêmes sont hautement toxiques (cytotoxiques notamment) et écotoxiques et donc à utiliser avec précautions. Les effluents rejetés dans le milieu naturel ne doivent plus contenir de radicaux libres.
Notes et références
modifier- William Glaze, Kang, Joon-Wun et Chapin, Douglas H., « The Chemistry of Water Treatment Processes Involving Ozone, Hydrogen Peroxide and Ultraviolet Radiation », Ozone: Science & Engineering, vol. 9, no 4, , p. 335–352 (DOI 10.1080/01919518708552148).
- Doré M. (1989), Chimie des oxydants et traitement des eaux, Tec. Doc. Lavoisier (éditeur), Paris, France, 505 p.
- Martinez-Huitle C.A. et Ferro S. (2006), Electrochemical oxidation of organic pollutants for the wastewater treatment: direct and indirect processes, Chem. Soc. Rev., 35, 1324-1340.
- National Water Research Institute, Treatment Technologies for Removal of Methyl Tertiary Butyl Ether (MTBE) from Drinking Water: Chapter III Advanced Oxidation Processes, .
- BRILLAS E., J.C. CALPE et J. CASADO (1999), Mineralization of 2,4-D by advanced electrochemical oxidation processes, Water Res., 34, 2253-2262.
- COLOBERT L., B. MONTAGNON. et C. NOFRE (1962), Effet microbicide sur Escherichia coli de systèmes chimiques générateurs du radical libre hydroxyle. Mécanisme de l’activité bactéricide du peroxyde d’hydrogène et de l’acide ascorbique, Ann. Inst. Pasteur, 102, 278-291.
- Aguiar A (1992), Dégradation de quelques pesticides en milieux aqueux lors de l’oxydation du Fe(II) en Fe(III) par le peroxyde d’hydrogène, thèse de doctorat, université de Poitiers, France, 158 p.
- AGUIAR A., F. CARBONNIÈRE, H. PAILLARD et B. LEGUBE (1993), Oxydation des pesticides et coagulation des substances humiques par le peroxyde d’hydrogène à faibles doses et le fer ferreux. Water Supply, 11, 129-138
- BRILLAS et al., 1995 ; GÖZMEN et al., 2003 ; OTURAN et al., 2001 dans la bibliographie ou les références.
- Duguet J.P. et Carpentier L. (1989), Technique de désinfection alternative, Lyonnaise des Eaux, Veille technologique, novembre, 19 p.
- Maestre P. (1991), Radical hydroxyle et métaux redox : application à la toxicité des quinones, thèse de doctorat, université de Toulouse, France, 237 p.
- Pulgarin C., Adler N., Peringer P. et Comminellis C. (1994), Electrochemical detoxification of a 1,4-benzoquinone solution in wastewater treatment, Water Res., 28, 887-893, DOI 10.1016/0043-1354(94)90095-7.
- GANDINI D., C. COMNINELLIS, N.B. TAHAR et A. SAVALL (1998), Électrodépollution : Traitement électrochimique des eaux résiduaires chargées en matières organiques toxiques, L'Act. Chim. , 10, 68-73.
- Garnerone A. (1979), Contribution à l’étude des mécanismes d’action des agents antiseptiques dans les eaux : Application à la désinfection électrochimique indirecte, thèse de doctorat, Institut national polytechnique de Grenoble, France, 165 p.
- GOEL R.K., J.R.V. FLORA et J. FERRY (2003), Mechanisms for naphthalene removal during electrolytic aeration, Water Res., 37, 891-901.
- Pillaud J.L (1987), Application de l’oxydation anodique au traitement de certains effluents industriels, thèse de doctorat, université Montpellier-II, France, 202 p.
- Rein Munter, « Advanced Oxidation Processes–Current Status and Prospects », Proceedings of the Estonian Academy of Sciences. Chemistry, vol. 50, no 2, , p. 59-80.
- SUTY H., C. DE TRAVERSAY et M. COSTE (2003), Application of advanced oxidation processes: Present and future. Dans Proceedings of the 3rd Conference on Oxidation Technologies for Water and Wastewater Treatment, 18 au 22 mai, Goslar, Allemagne, p. 8.
- Suthy H., De Traversay C. et Coste M. (2003), « Application of advanced oxidation processes: Present and future », dans : « Proceedings of the 3rd Conference on Oxidation Technologies for Water and Wastewater Treatment », 18 au 22 mai, Goslar, Allemagne, p. 8.
- Parsons S. (2004), « Advanced oxidation processes for water and wastewater treatment ». IWA Publishing, Alliance House, Londres, Angleterre, 356 p.
- Gogate P.R. et A.B. Pandit (2004), A review of imperative technologies for wastewater treatment I: oxidation technologies at ambient conditions, Adv. Environ. Res., 8, 501-551.
- DROGUI P., S. ELMALEH, M. RUMEAU, C. BERNARD et A. RAMBAUD (2001), Oxidising and disinfecting by hydrogen peroxide produced in a two-electrode cell, Water Res., 35, 3235-3241.
- Stéphanie Lebarillier, Anne PIRAM, Stéphanie ROSSIGNOL et Pascal WONG-WAH-CHUNG, « The purification performance of LaVie system: effect of free chlorine and dissolved oxygen concentration », sur lavie.bio, (consulté le ).
- CHIOU C.H., C.Y. WU et R.-S. JUANG (2008), Photocatalytic degradation of phenol and m-nitrophenol using irradiated TiO2 in aqueous solutions, Separ. Purif. Technol., 62, 559–564.
- LORIMER, J.P. et T.J. MASON (1987), Sonochemistry. Part1 – The physical aspects, Chem. Soc. Rev., 16, 239-274.
- RIEZ P., D. BERDAHL et C.L. CHRISTMAN (1985), Free radical generation by ultrasound in aquaous and nonaquaous solutions, Environ. Health Perspect., 64, 233‑252, DOI 10.1289/ehp.8564233.
- TRABELSI F., H. AÏT-LYAZIDI, B. RATSIMBA, A.M. WILHEM, H. DELMAS, P-L. FABRE et J. BERLAN (1996), Oxidation of phenol in wastewater by sonoelectrochemistry, Chem. Eng. Sci., 51, 1857-1865, DOI 10.1016/0009-2509(96)00043-7.
- VAN CRAEYNEST K., H. VAN LANGENHOVE et R.M. STUETZ (2004), AOPs for VOCs and odour treatment. Dans : Advanced Oxidation Processes for Water and Wastewater Treatment, PARSONS S. (éditeur), IWA Publishing, Alliance House, Londres, Angleterre, 356 p.
- NAFFRECHOUX E., E COMBET, B. FANGET et C. PETRIER (2003), Reduction of chloroform formation potential of humic acid by sonolys and ultraviolet irradiation, Water Res., 37, 1948-1952.
- HUA I. et M.R. HOFFMANN (1997), Optimization of ultrasonic irradiation as an advanced oxidation technology, Environ. Sci. Technol., 31, 2237-2243.
- NAKUI H., K. OKITSU, Y. MAEDA et R. NISHIMURA (2007), The effect of pH on sonochemical degradation of hydrazine, Ultrason. Sonochem., 14, 627–632, DOI 10.1016/j.ultsonch.2006.11.008.
- « Advanced Oxidation Processes. (Processus d'oxydation avancés) », Neopure Technologies.
- KARAM L.R., BERGTOLDS D.S. et SIMIC M.G. (1991), Biomarkers of HO radicals damage in-vivo, Free Radical. Res., 12/13, 11-16.
- Zaviska F, Drogui P, Mercier G et Blais J.F (2009), Procédés d’oxydation avancée dans le traitement des eaux et des effluents industriels: Application à la dégradation des polluants réfractaires, Revue des sciences de l'eau/Journal of Water Science, 22(4), 535-564 (résumé).
- AMAT A.M., A. ARQUES, M.A. MIRANDA, R. VINCENTE et S. SEGUI (2007), Degradation of two commercial anionic surfactants by means of ozone and/or UV irradiation, Environ. Eng. Sci., 24, 790-794.
- ANDREOZZI R., V. CAPRIO, R. MAROTTA et D.VOGNA (2003), Paracetamol oxidation from aqueous solutions by means of ozonation and H2O2/UV system, Water Res., 37, 993–1004.
- AURIOL M., Y. FILALI-MEKNASSI et R.D. TYAGI (2007), Présence et devenir des hormones stéroïdiennes dans les stations de traitement des eaux usées, Rev. Sci. Eau, 20, 89-108.
- IRMAK S., O. ERBATUR et A. AKGERMAN (2005), Degradation of 17β-estradiol and bisphenol A in aqueous medium by using ozone and ozone/UV techniques, J. Hazard. Mater., 126, 54-62.
- MURUGANANTHAN M., S.YOSHIHARA, T.RAKUMA, T. SHIRAKASSHI (2008), Mineralization of bisphenol A (BPA) by anodic oxidation with boron-doped diamond (BDD) electrode, J. Hazard. Mater., 154, 213-220, DOI 10.1016/j.jhazmat.2007.10.011.
- OHKO Y., I. ANDO, C. NIWA, T. TATSUMA, T. YAMAMURA, T. NAKASHIMA, Y. KUBOTA et A. FUJISHIMA (2001), Degradation of bisphenol A in water by TiO2, photocatalyst, Environ. Sci. Technol., 35, 2365‑2368, DOI 10.1021/es001757t.
- TANAKA S., Y. NAKATA, T. KIMURA, M. YUSTIAWATI, M. KAWASAKI et H. KURAMITZ (2002), Electrochemical decomposition of bisphenol A using Pt/Ti and SnO2/Ti anodes, J. Appl. Electrochem., 32, 197-210, DOI 10.1023/A:1014762511528.
- N.N. Misra, « The contribution of non-thermal and advanced oxidation technologies towards dissipation of pesticide residues », Trends in Food Science & Technology, vol. 45, no 2, , p. 229–244 (DOI 10.1016/j.tifs.2015.06.005, lire en ligne).
- Enric Brillasa, Eva Mur, Roser Sauleda, Laura Sànchez, José Peral, Xavier Domènech et Juan Casado, « Aniline mineralization by AOP's: anodic oxidation, photocatalysis, electro-Fenton and photoelectro-Fenton processes », Applied Catalysis B: Environmental, vol. 16, no 1, , p. 31–42 (DOI 10.1016/S0926-3373(97)00059-3).
- Mills A. et S. Le Hunte (1997), An overview of semiconductor photocatalysis, J. Photochem. Photobiol. A: Chem., 108, 1-35, DOI 10.1016/S1010-6030(97)00118-4.
- W.T.M. Audenaert, Y. Vermeersch, S.W.H. Van Hulle, P. Dejans, A. Dumouilin et I. Nopens, « Application of a mechanistic UV/hydrogen peroxide model at full-scale: Sensitivity analysis, calibration and performance evaluation », Chemical Engineering Journal, vol. 171, no 1, , p. 113–126 (DOI 10.1016/j.cej.2011.03.071, hdl 1854/LU-1260447).
- Félicien Mazille, « Advanced Oxidation Processes - SSWM. Sustainable Sanitation and Water Management » [archive du ] (consulté le ).
- GONCHARUK V.V., N.G. POTAPCHENKO, O.S. SAVLUK, V.N. KOSINOVA et A.N. SOVA (2003), Study of various conditions for O3/UV disinfection of water, Khimiya i Tecknologiya Vody, 25, 487-496.
- Fernando J. Beltrán, Ozone Reaction Kinetics for Water and Wastewater Systems, Floride, CRC Press, , 384 p. (ISBN 978-1-56670-629-2).
- GALEY C. et PASLAWSKI D. (1993), Élimination des micropolluants par l’ozone couplé avec le peroxyde d’hydrogène dans le traitement de potabilisation des eaux, L’Eau, L’Industrie, Les Nuisances, 161, 46-49.
- Solarchem Environmental System, The UV : Oxidation Manuel, .
- PRAKASH N.S., E.T. PUTTAIAH, B.R. KIRAN, B.K. HARISH et K.M. MAHADEVAN (2007), Photo oxidation of textile industrial effluent in the presence of semiconductor particles by solar exposure, Res. J. Chem. Environ., 11, 73-77
- Tracy L Thompson et Yates, John T, « Études des sciences de la surface sur la photoactivation du TiO2 - nouveaux processus photochimiques », Chemical Reviews, vol. 106, no 10, , p. 4428–4453 (PMID 17031993, DOI 10.1021/cr050172k).
- Gogate P.R et Pandit A.B (2000), Engineering design methods for cavitational reactors I: sonochemical reactors, AIChE J., 46, 372.
- Gogate P.R. et Pandit A.B. (2001), Hydrodynamic cavitation reactors: A state of the art review, Rev. Chem. Eng., 17,1-85.
Voir aussi
modifierArticles connexes
modifier- Oxydation
- Oxydation et réduction en chimie organique
- Auto-oxydation
- Réaction de Fenton
- Électro-oxydation
- Épuration de l'eau
- Station d'épuration
- Potentiel d'oxydoréduction
- Dérivé réactif de l'oxygène
- Eau potable • Production d'eau potable
- Purification de l'eau
- Radical hydroxyle
- Effluent industriel
- Radiolyse
- Minéralisation
- Chimie environnementale
- Sonochimie
Bibliographie
modifier• Dr.Mounir Meslioui Chercheur Scientifique Sur les processus de production Oxygène https://orcid.org/0009-0005-8937-6075'
- Michael OD Roth, Chemical oxidation: Technology for the Nineties, volume VI: Technologies for the Nineties: 6 (Chemical oxidation), W. Wesley corner fields et John A. Roth, Technomic Publishing CO, Lancaster among other things, 1997 (ISBN 1-56676-597-8).
- Oppenländer Thomas (2003), Advanced Oxidation Processes (AOPs): Principles, Reaction Mechanisms, Reactor Concepts, Wiley VCH, Weinheim (ISBN 978-3-527-30563-6).
- AKMEHMET B.I. et M. OTKER (2004), Pre-treatment of antibiotic formulation wastewater by O3, O3/H2O2, and O3/UV processes, Turkish J. Eng. Environ. Sci., 28, 325‑331.
- ANDREOZZI R., V. CAPRIO, R. MAROTTA et A. RADOVNIKOVIC (2003), Ozonation and H2O2/UV treatment of clofibric acid in water: a kinetic investigation, J. Hazard. Mater., 103, 233–246.
- BUXTON G.U., C.L. GREENSTOCK, W.C HELMAN et A.B. ROSS (1988), Critical review of rate constant for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (HO/O-) in aqueous solution, J. Phys. Chem. Ref. Data, 17, 513-759.
- CRISSOT F. (1996), Oxydation catalytique de composés organiques aqueux par le peroxyde d’hydrogène en phase hétérogène, thèse de doctorat, université de Poitiers, École supérieure d’ingénieurs de Poitiers, France, 152 p.
- ENTEZARI M.H., C. PETRIER et P. DEVIDAL (2003), Sonochemical degradation of phenol in water: a comparison of classical equipment with a new cylindrical reactor, Ultrason. Sonochem., 10, 103-108.
- ESPLUGAS S., J. GIMENEZ, S. CONTRERAS, E. PASCUAL et M. RODRIGUEZ (2002), Comparison of different advanced oxidation processes for phenol degradation, Water Res., 36, 1034‑1042.
- FENG C., N. SUGIURA, S. SHIMADA et T. MAEKAWA (2003), Development of high performance electrochemical wastewater treatment system, J. Hazard. Mater., B103, 65‑78.
- GOGATE P.R. et A.B. PANDIT (2004), A review of imperative technologies for wastewater treatment I: oxidation technologies at ambient conditions, Adv. Environ. Res., 8, 501-551.
- KARPEL VEL LEITNER N. et M. DORÉ (1997), Mécanisme d’action des radicaux OH° sur les acides glycolique, glyoxylique, acétique et oxalique en solution aqueuse : Incidence sur la consommation de peroxyde d’hydrogène dans les systèmes H2O2/UV et O3/H2O2, Water Res., 31, 1383-1397, DOI 10.1016/S0043-1354(96)00122-4.
- PAILLARD H. (1994), Étude de la minéralisation de la matière organique dissoute en milieu aqueux dilué par ozonation, oxydation avancée O3/H2O2 et ozonation catalytique hétérogène, thèse de doctorat, université de Poitiers, France, 224 p.
- PARSONS S. (2004), Advanced oxidation processes for water and wastewater treatment, IWA Publishing, Alliance House, Londres, Angleterre, 356 p.
- RAJESHWAR K. et J.G. IBANEZ (1997), Environmental electrochemistry. Fundamentals and applications in pollution abatement, Academic Press, Londres, Angleterre, 776 p.
- SANCHEZ-PRADO L., R. BARRO, C. GARCIA-JARES, M. LLOMPART, M. LORES, C. PETRAKIS, N. KALOGERAKIS, D. MANTZAVINOS et E. PSILLAKIS (2008), Sonochemical degradation of triclosan in water and wastewater, Ultrason. Sonochem., 15, 689–694, DOI 10.1016/j.ultsonch.2008.01.007.
- SAULEDA R. et E. BRILLAS (2001), Mineralization of aniline and 4-chlorophenol in acidic solution by ozonation with Fe2+ and UVA light, Appl. Cat. B. Environ., 29, 135-145, DOI 10.1016/S0926-3373(00)00197-1.
- YEON K.H., J.H. SONG, J. SHIM, S.H. MOON et Y.U. JEONG (2007), H.Y. Joo Integrating electrochemical processes with electrodialysis reversal and electro-oxidation to minimize COD and T-N at wastewater treatment facilities of power plants, Desalination, 202, 400‑410, DOI 10.1016/j.desal.2005.12.080.