Protéine de liaison à l'ADN
Une protéine de liaison à l'ADN est une protéine comportant un domaine de liaison à l'ADN et qui possède donc une affinité pour l'ADN monocaténaire ou bicaténaire (en double hélice)[1],[2]. Les protéines de liaison à l'ADN spécifiques d'une séquence nucléotidique interagissent généralement avec le grand sillon de l'ADN B car ce dernier expose davantage les paires de bases, ce qui permet de mieux les identifier. Il existe cependant des ligands qui interagissent avec le petit sillon, comme la nétropsine[3] (un polyamide), la distamycine, le colorant Hoechst 33258, la pentamidine (un trypanicide), le DAPI et d'autres encore[4].

Parmi les protéines de liaison à l'ADN, on compte notamment les facteurs de transcription, qui modulent la transcription de l'ADN en ARN, diverses polymérases, des nucléases, qui clivent les molécules d'ADN, ainsi que les histones, qui interviennent dans le conditionnement des chromosomes et dans la régulation de la transcription au sein du noyau des cellules. Les protéines de liaison à l'ADN peuvent contenir des motifs structurels tels que doigt de zinc, hélice-coude-hélice, glissière à leucine, et d'autres encore, qui facilitent la liaison aux molécules d'acide nucléique. Il existe également des exemples de telles protéines moins classiques, comme les effecteurs TAL (en).
Interactions protéine-ADN non spécifiques
modifier
Les protéines structurelles qui se lient à l'ADN, par exemple au sein des chromosomes, offrent des exemples bien compris d'interactions non spécifiques entre protéines et ADN. Ces protéines organisent l'ADN en une structure compacte appelée chromatine. Chez les eucaryotes, ces structures font intervenir la liaison de l'ADN avec de petites protéines basiques appelées histones. Chez les procaryotes, plusieurs types de protéines entrent en jeu[5],[6].
Les histones constituent un complexe en forme de disque appelé nucléosome contenant deux tours complets d'ADN bicaténaire enroulé autour de lui. Ces interactions non spécifiques s'établissent à travers des liaisons ioniques entre les résidus d'acides aminés basiques et chargés positivement des histones d'une part et le squelette ose-phosphate acide et chargé négativement de l'ADN d'autre part, ce qui les rend très largement indépendantes de la séquence nucléotidique[7]. Parmi les modifications post-traductionnelles de ces acides aminés basiques, on relève des méthylations, des phosphorylations et des acétylations[8]. Ces altérations chimiques modifient l'intensité des interactions entre l'ADN et les histones, rendant l'ADN plus ou moins accessible aux facteurs de transcription et modulant la vitesse de la transcription[9]. Parmi les autres protéines de la chromatine non spécifique d'une séquence d'ADN, on trouve les protéines à grande mobilité, qui se lient à l'ADN distordu[10]. Ces protéines jouent un rôle important dans l'organisation des nucléosomes pour les arranger en structures plus vastes constituant les chromosomes[11].
Protéines de liaison à l'ADN monocaténaire
modifierIl existe un groupe particulier de protéines de liaison à l'ADN qui sont spécifiques à l'ADN monocaténaire. Chez l'homme, la protéine de réplication A est le membre le mieux compris de cette famille. Il intervient dans les processus au cours desquels la double hélice d'ADN est séparée en deux brins, comme la réplication de l'ADN, la recombinaison génétique et la réparation de l'ADN[12]. Ces protéines semblent stabiliser l'ADN monocaténaire et le protéger de la dégradation par les nucléases ainsi que de la formation de structures tige-boucle.
Protéines de liaison à l'ADN spécifiques d'une séquence nucléotidique
modifier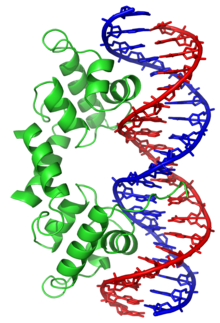
Certaines protéines ont évolué afin de ne se lier qu'à certaines séquences d'ADN. Les mieux connues d'entre elles sont les facteurs de transcription, qui sont les protéines de régulation de la transcription de l'ADN en ARN. Chaque facteur de transcription ne se lie qu'à une séquence d'ADN déterminée et active ou inhibe la transcription des gènes qui possèdent cette séquence près de leur promoteur.
Les facteurs de transcription jouent leur rôle de deux manières. D'une part, ils peuvent se lier à l'ARN polymérase responsable de la transcription, directement ou par l'intermédiaire d'autres protéines médiatrices ; ceci permet de placer la polymérase sur le promoteur et lui permet de commencer la transcription[13]. D'autre part, les facteurs de transcription peuvent se lier à des enzymes qui modifient les histones au niveau du promoteur. Ceci favorise l'accès à l'ADN pour les polymérases[14].
Ces séquences d'ADN cibles peuvent se trouver n'importe où à travers le génome d'un être vivant. Ainsi, des changements dans l'activité d'un type de facteurs de transcription peut affecter des milliers de gènes[15]. C'est la raison pour laquelle ces protéines sont souvent la cible de processus de transduction de signal contrôlant la réponse à des changements environnementaux ou la différenciation cellulaire et le développement des organismes. La spécificité étroite de l'interaction entre ces facteurs de transcription et l'ADN provient du fait que ces protéines établissent de nombreux contacts avec les bords des bases nucléiques, ce qui leur permet de « lire » les séquences nucléotidiques. La plupart de ces interactions ont lieu dans le grand sillon de l'ADN, où les bases sont le plus accessibles[1]. On réalise généralement les descriptions mathématiques de la liaison protéine-ADN prenant en compte la spécificité envers les séquences ainsi que la liaison compétitive et coopérative des protéines de types différents à l'aide de modèles en réseau (en)[16]. On a proposé des méthodes de calcul permettant d'identifier la séquence spécifique de liaison d'une protéine à l'ADN afin de tirer profit du grand nombre de séquences à présent disponibles[17].
Notes et références
modifier- (en) C. O. Pabo et R. T. Sauer, « Protein-DNA Recognition », Annual Review of Biochemistry, vol. 53, , p. 293-321 (PMID 6236744, DOI 10.1146/annurev.bi.53.070184.001453, lire en ligne)
- (en) Richard E. Dickerson, « The DNA Helix and How it is Read », Scientific American, vol. 249, no 6, , p. 94-111 (DOI 10.1038/scientificamerican1283-94, Bibcode 1983SciAm.249f..94D, lire en ligne)
- (en) Christoph Zimmer et Ulla Wähnert, « Nonintercalating DNA-binding ligands: Specificity of the interaction and their use as tools in biophysical, biochemical and biological investigations of the genetic material », Progress in Biophysics and Molecular Biology, vol. 47, no 1, , p. 31-112 (PMID 2422697, DOI 10.1016/0079-6107(86)90005-2, lire en ligne)
- (en) P. B. Dervan, « Design of sequence-specific DNA-binding molecules », Science, vol. 232, no 4749, , p. 464-471 (PMID 2421408, DOI 10.1126/science.2421408, lire en ligne)
- (en) K. Sandman, S. L. Pereira et J. N. Reeve, « Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome », Cellular and Molecular Life Sciences, vol. 54, no 12, , p. 1350-1364 (PMID 9893710, DOI 10.1007/s000180050259, lire en ligne)
- (en) Temus T. Dame, « The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin », Molecular Microbiology, vol. 56, no 4, , p. 858-870 (PMID 15853876, DOI 10.1111/j.1365-2958.2005.04598.x, lire en ligne)
- (en) Karolin Luger, Armin W. Mäder, Robin K. Richmond, David F. Sargent et Timothy J. Richmond, « Crystal structure of the nucleosome core particle at 2.8 Å resolution », Nature, vol. 389, no 6648, , p. 251-260 (PMID 9305837, DOI 10.1038/38444, lire en ligne)
- (en) Thomas Jenuwein et C. David Allis, « Translating the Histone Code », Science, vol. 293, no 5532, , p. 1074-1080 (PMID 11498575, DOI 10.1126/science.1063127, lire en ligne)
- (en) T. Ito, « Nucleosome Assembly and Remodeling », Current Topics in Microbiology and Immunology, vol. 274, , p. 1-22 (PMID 12596902, DOI 10.1007/978-3-642-55747-7_1, lire en ligne)
- (en) J. O. Thomas, « HMG1 and 2: architectural DNA-binding proteins », Biochemical Society Transactions, vol. 29, no Pt 4, , p. 395-401 (PMID 11497996, DOI 10.1042/bst0290395, lire en ligne)
- (en) Rudolf Grosschedl, Klaus Giese et John Pagel, « HMG domain proteins: architectural elements in the assembly of nucleoprotein structures », Trends in Genetics, vol. 10, no 3, , p. 94-100 (PMID 8178371, DOI 10.1016/0168-9525(94)90232-1, lire en ligne)
- (en) Cristina Iftode, Yaron Daniely et James A. Borowiec, « Replication Protein A (RPA): The Eukaryotic SSB », Critical Reviews in Biochemistry and Molecular Biology, vol. 34, no 3, , p. 141-180 (PMID 10473346, DOI 10.1080/10409239991209255, lire en ligne)
- (en) Lawrence C. Myers et Roger D. Kornberg, « Mediator of Transcriptional Regulation », Annual Review of Biochemistry, vol. 69, , p. 729-749 (PMID 10966474, DOI 10.1146/annurev.biochem.69.1.729, lire en ligne)
- (en) Bruce M. Spiegelman et Reinhart Heinrich, « Biological Control through Regulated Transcriptional Coactivators », Cell, vol. 119, no 2, , p. 157-167 (PMID 15479634, DOI 10.1016/j.cell.2004.09.037, lire en ligne)
- (en) Zirong Li, Sara Van Calcar, Chunxu Qu, Webster K. Cavenee, Michael Q. Zhang et Bing Ren, « A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells », Proceedings of the National Academy of Sciences of the United States of America, vol. 100, no 14, , p. 8164-8169 (PMID 12808131, PMCID 166200, DOI 10.1073/pnas.1332764100, lire en ligne)
- (en) Vladimir B. Teif et Karsten Rippe, « Statistical–mechanical lattice models for protein–DNA binding in chromatin », Journal of Physics: Condensed Matter, vol. 22, no 41, , article no 414105 (PMID 21386588, DOI 10.1088/0953-8984/22/41/414105, lire en ligne)
- (en) Ka-Chun Wong, Tak-Ming Chan, Chengbin Peng, Yue Li et Zhaolei Zhang, « DNA motif elucidation using belief propagation », Nucleic Acids Research, vol. 41, no 16, , article no e153 (PMID 23814189, PMCID 3763557, DOI 10.1093/nar/gkt574, lire en ligne)