Réaction d'Appel
La réaction d'Appel est une réaction organique convertissant un alcool en chlorure d'alkyle en utilisant la triphénylphosphine et le tétrachlorure de carbone[1]. L'utilisation de tétrabromure de carbone ou de dibrome comme source d'halogène produit des bromures d'alkyle, tandis que l'utilisation d'iodométhane ou de diiode donne des iodures d'alkyle. La découverte de cette réaction est crédité au chimiste allemand Rolf Appel (en) qui lui donne son nom[2], bien qu'elle fût découverte auparavant[3].
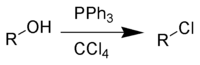
Cette réaction est devenue de moins en moins utilisée du fait de la restriction de l'usage du tétrachlorure de carbone du fait du protocole de Montréal. De plus cette réaction produit des éléments halogénés toxiques et coproduit des composés organophosphorés qui doivent être séparés du produit voulu[4]. Le réactif phosphoré peut aussi être utilisé en quantité catalytique[5],[6]. Le bromure d'alkyle correspondant peut aussi être synthétisé par addition du bromure de lithium comme source d'ions bromures.

Mécanisme modifier
Le mécanisme de la réaction d'Appel est ici illustré par la transformation du géraniol du chlorure de géranyle[7]. La réaction débute par la formation de sel de phosphonium (3). La déprotonation de l'alcool, formant le chloroforme, produit un alcoolate (5). La suite de la réaction est la substitution nucléophile du chlorure porté par le sel de phosphonium sur l'alcoolate pour former le chlorure d'alkyle final (8). Dans le cas d'un alcool primaire ou secondaire, cette réaction se fait en une seule étape par un mécanisme de type SN2. Dans le cas d'un alcool tertiaire, la réaction se fait par un mécanisme de type SN1, donc en deux étapes, la première produisant un intermédiaire organophosphine (7) et un ion chlorure (6).
La principale force derrière cette réaction et d'autres similaires est la formation d'une liaison double forte P=O[8]. La réaction est quelque peu similaire à la réaction de Mitsunobu, où la combinaison d'une organophosphine comme accepteur d'oxo, d'un composé diazo comme accepteur d'hydrogène, et d'un nucléophile est utilisée pour convertir un alcool en ester[9].
Variantes modifier
La réaction d'Appel est également efficace sur les acides caboxyliques ; de ce fait, elle a été utilisée pour les convertir en oxazolines, oxazines et thiazolines[10].
Notes et références modifier
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Appel_reaction » (voir la liste des auteurs).
- Rolf Appel, « Tertiary Phosphane/Tetrachloromethane, a Versatile Reagent for Chlorination, Dehydration, and P-N Linkage », Angewandte Chemie International Edition in English, vol. 14, no 12, , p. 801–811 (DOI 10.1002/anie.197508011)
- (de) « History - chemie », sur uni-bonn.de via Wikiwix (consulté le ).
- I Downie, J Holmes et J Lee, « Preparation of Alkyl Chlorides Under Mild Conditions », Chemistry and Industry, no 22, , p. 900 (ISSN 0009-3068)
- (en) Organophosphorus Reagents in Organic Synthesis, Londres, Academic Press, , 608 p. (ISBN 0-12-154350-1)
- Ross Denton, Jie An, Beatrice Adeniran, Alexander Blake, William Lewis et Andrew Poulton, « Catalytic Phosphorus(V)-Mediated Nucleophilic Substitution Reactions: Development of a Catalytic Appel Reaction », Journal of Organic Chemistry, (DOI 10.1021/jo201085r)
- Henri A. van Kalkeren, Stefan H. A. M. Leenders, C. (Rianne) A. Hommersom, Floris P. J. T. Rutjes et Floris L. van Delft, « In Situ Phosphine Oxide Reduction: A Catalytic Appel Reaction », Chemistry - A European Journal, (DOI 10.1002/chem.201101563)
- Jose G. Calzada and John Hooz, Geranyl chloride, Org. Synth., coll. « vol. 6 », p. 634
- http://www.alfa.com/en/docs/OrganoIntermediates.pdf « Copie archivée » (version du sur Internet Archive)
- (en) Smith, Michael B.; March, Jerry, Advanced Organic Chemistry : Reactions, Mechanisms, and Structure, New York, Wiley-Interscience, , 6e éd., 2357 p. (ISBN 978-0-471-72091-1 et 0-471-72091-7, lire en ligne)
- Helmut Vorbrüggen et Krolikiewicz, Konrad, « A simple synthesis of Δ2-oxazines, Δ2-oxazines, Δ2-thiazolines and 2-substituted benzoxazoles », Tetrahedron, vol. 49, no 41, , p. 9353–9372 (DOI 10.1016/0040-4020(93)80021-K, lire en ligne)

