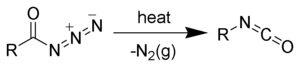Réarrangement de Curtius
Le réarrangement de Curtius (ou réaction de Curtius ou dégradation de Curtius) est une réaction chimique dans laquelle un azoture d'acyle se réarrange en isocyanate[1],[2],[3],[4]. Elle tient son nom du chimiste allemand Theodor Curtius qui l'a décrite en 1890.
Réactions
modifierLes acides carboxyliques (1) peuvent facilement être convertis en azotures d'acyles (3) sous l'action de l'azoture de diphénylphosphoryle — DPPA — (2)[5],[6],[7].
L'isocyanate issu du réarrangement peut alors être piégé par une grande variété de nucléophiles. De l'eau est souvent ajoutée afin d'hydrolyser l'isocyanate en une amine[8]. Lorsqu'elle est effectuée en présence de tert-butanol, la réaction produit une amine protégée par un groupe Boc, un intermédiaire utile utilisé en synthèse organique[9],[10].
De façon similaire, lorsque la réaction de Curtius est effectuée en présence d'alcool benzylique, une amine protégée par un groupe Cbz est formée[11].
Mécanisme réactionnel
modifierLe réarrangement de Curtius peut être décrit comme un processus à deux étapes, la première étant la perte de diazote gazeux formant un nitrène d'acyle (2), la seconde un réarrangement du nitrène d'acyle par migration du groupe R pour former l'isocyanate désiré (3). Cependant, des éléments récents tendraient à prouver que les deux étapes sont concertées, aucun intermédiaire nitrène libre ne se formant[12].
Variantes
modifierUne variante de cette réaction, appelée dégradation de Darapsky (A. Darapsky, 1936), contient un réarrangement de Curtius dans son processus de dégradation d'un α-cyanoester en acide aminé[13] :
Notes et références
modifier- (de) T. Curtius, « Ueber Stickstoffwasserstoffsäure (Azoimid) N3H », Ber. Dtsch. Chem. Ges., vol. 23, , p. 3023 (DOI 10.1002/cber.189002302232)
- DOI 10.1002/prac.18940500125
- (en) Peter A. S. Smith, « The Curtius Reaction », Org. React., vol. 3, , p. 337-449 (DOI 10.1002/0471264180.or003.09)
- DOI 10.1021/cr00084a001
- Shioiri, T.; Yamada, S., Diphenyl phosphorazidate, Org. Synth., coll. « vol. 7 », , p. 206
- DOI 10.1021/ja00772a052
- DOI 10.1016/S0040-4020(01)97352-1
- Kaiser, C.; Weinstock, J., Amines from mixed carboxylic-carbonic anhydrides: 1-phenylcyclopentylamine, Org. Synth., coll. « vol. 6 », , p. 910
- DOI 10.1021/op970115w
- DOI 10.1021/ol051428b
- Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E., 1-N-Acylamino-1,3-dienes from 2,4-pentadienoic acids by the Curtius rearrangement: benzyl trans-1,3-butadiene-1-carbamate, Org. Synth., coll. « vol. 6 », , p. 95
- (en) Michael B. Smith et Jerry March, March's Advanced Organic Chemistry : reactions, mechanisms, and structure, Hoboken, New Jersey, Wiley, , 6e éd., 2357 p. (ISBN 978-0-471-72091-1), p. 1609
- « RXN051 », sur chempensoftware.com via Wikiwix (consulté le ).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Curtius rearrangement » (voir la liste des auteurs).