Radioactivité
La radioactivité est le phénomène physique par lequel des noyaux atomiques instables (dits radionucléides ou radioisotopes) se transforment spontanément en d'autres atomes (désintégration) en émettant simultanément des particules de matière (électrons, noyaux d'hélium, neutrons, etc.) et de l'énergie (photons et énergie cinétique). La radioactivité a été découverte en 1896 par Henri Becquerel dans le cas de l'uranium, et très vite confirmée par Pierre et Marie Curie pour le radium. C'est cette dernière qui introduit à cette occasion les termes de radioactivité et radioélément[1].


L'émission de particules matérielles et immatérielles est appelée rayonnement, et l'énergie des particules est suffisante pour entraîner l'ionisation de la matière traversée, d'où le nom de rayonnements ionisants. On distingue classiquement les rayons α constitués de noyaux d'hélium (également appelés particules α), les rayons β constitués d'électrons ou de positons (particules β) et les rayons γ constitués de photons, auxquels il faut ajouter les neutrons qui dérivent des fissions spontanées.
Les effets sur un organisme vivant d'une exposition aux rayonnements ionisants (irradiation) dépendent du niveau et de la durée de l'exposition (aiguë ou chronique), de la nature du rayonnement ainsi que de la localisation de la radioactivité (exposition externe, interne, en surface, etc.).
Les rayonnements provenant de substances radioactives sont largement utilisés dans l'industrie pour le contrôle de pièces manufacturées, les soudures, l'usure, et en médecine nucléaire à des fins de diagnostic à faible dose, et à des fins thérapeutiques à forte dose pour soigner les cancers. Lors des différents usages de la radioactivité, il convient naturellement de suivre les mesures de prévention, de protection et de contrôle adaptées au niveau de radioactivité.
Histoire
modifierMise en évidence et explication de la radioactivité
modifier

La radioactivité fut observée pour la première fois par Abel Niépce de Saint-Victor en 1857 puis redécouverte en 1896[a] par Henri Becquerel (1852-1908), lors de ses travaux sur la phosphorescence : les matières phosphorescentes émettent de la lumière dans le noir après exposition à la lumière, et Becquerel supposait que la lueur qui se produit dans les tubes cathodiques exposés aux rayons X pouvait être liée au phénomène de phosphorescence. Son expérience consistait à sceller une plaque photographique dans du papier noir et mettre ce paquet en contact avec différents matériaux phosphorescents. Tous ses résultats d'expérience furent négatifs, à l'exception de ceux faisant intervenir des sels d'uranium, lesquels impressionnaient la plaque photographique à travers la couche de papier.
Cependant, il apparut bientôt que l'impression de l'émulsion photographique n'avait rien à voir avec le phénomène de phosphorescence, car l'impression se faisait même lorsque l'uranium n'avait pas été au préalable exposé à la lumière. Par ailleurs, tous les composés d'uranium impressionnaient la plaque, y compris les sels d'uranium non phosphorescents et l'uranium métallique. De plus, les physiciens Julius Elster (en) et Hans Gleiter (en) montrent dès 1898 que le phénomène n'est sensible ni à la température, ni à la pression ni à un bombardement d'électrons[3].
À première vue, ce nouveau rayonnement était semblable au rayonnement X, découvert l'année précédente (en 1895) par le physicien allemand Wilhelm Röntgen (1845-1923). Des études ultérieures menées par Becquerel lui-même, ainsi que par Marie Curie (1867-1934) et Pierre Curie (1859-1906), ou encore par Ernest Rutherford (1871-1937), montrèrent que la radioactivité est nettement plus complexe que le rayonnement X. En particulier, ils découvrirent qu'un champ électrique ou magnétique séparait les rayonnements « uraniques » en trois faisceaux distincts, qu'ils baptisèrent α, β et γ. La direction de la déviation des faisceaux montrait que les particules α étaient chargées positivement, les β négativement, et que les rayonnements γ étaient neutres. En outre, la magnitude de la déflexion indiquait nettement que les particules α étaient bien plus massives que les β.
- Reproduction de l'expérience de Becquerel.
-
Section polie de pechblende.
-
Papier photographique impressionné par le rayonnement de la pechblende.
En faisant passer les rayons α dans un tube à décharge et en étudiant les raies spectrales ainsi produites, on pouvait conclure que le rayonnement α est constitué d'hélions, autrement dit de noyaux d'hélium (4He). D'autres expériences permettaient d'établir que les rayons β sont composés d'électrons comme les particules dans un tube cathodique, et que les rayons γ sont, tout comme les rayons X, des photons très énergétiques. Par la suite, on découvrit que de nombreux autres éléments chimiques ont des isotopes radioactifs. Ainsi, en traitant des tonnes de pechblende, une roche uranifère, Marie Curie réussit à isoler quelques milligrammes de radium dont les propriétés chimiques sont tout à fait similaires à celles du baryum (ces deux éléments chimiques sont des métaux alcalino-terreux), mais qu'on arrive à distinguer à cause de la radioactivité du radium.
En 2024, des désintégrations α sont détectées individuellement grâce au recul de billes de silice contenant le radioisotope, de taille micrométrique. La détection du minuscule recul d'un objet plus de 1012 fois plus massif que les particules émises est rendue possible grâce à des techniques d'opto-mécanique en lévitation. La mesure est sensible à toutes les particules émises lors de la désintégration, y compris les particules neutres qui pourraient échapper à la détection par les techniques existantes. L'observation d'un changement dans la charge nette de la bille coïncidant avec le recul permet d'identifier les désintégrations avec un bruit de fond de l'ordre du µBq[4],[5].
Mise en évidence des dangers de la radioactivité
modifier
Les dangers des rayonnements ionisants pour la santé ne furent pas immédiatement reconnus. Ainsi, Nikola Tesla (1856-1943), en soumettant volontairement en 1896 ses propres doigts à une irradiation par des rayons X, constata que les effets aigus de cette irradiation étaient des brûlures qu'il attribua, dans une publication, à la présence d'ozone. D'autre part, les effets mutagènes des radiations, en particulier les risques de cancer, ne furent découverts qu'en 1927 par Hermann Joseph Muller (1890-1967). Avant que les effets biologiques des radiations ne soient connus, des médecins et des sociétés attribuaient aux matières radioactives des propriétés thérapeutiques : le radium, en particulier, était populaire comme tonifiant, et fut prescrit sous forme d'amulettes ou de pastilles. Marie Curie s'est élevée contre cette mode, arguant que les effets des radiations sur le corps n'étaient pas encore bien compris. Durant les années 1930, les nombreuses morts qui ont semblé pouvoir être reliées à l'utilisation de produits contenant du radium ont fait passer cette mode et, actuellement, la radiothérapie n'est appliquée qu'à bon escient dans les hôpitaux, notamment pour soigner des cas de cancers avérés ou, éventuellement, d'autres maladies graves.
Désintégration nucléaire
modifierLa « désintégration » (en physique, elle correspond à la transformation de la matière en énergie) d'un noyau radioactif peut entraîner l'émission de rayonnement α, β− ou β+. Ces désintégrations sont souvent accompagnées de l'émission de photons de haute énergie ou rayons γ, dont les longueurs d'onde sont généralement encore plus courtes que celles des rayons X, étant de l'ordre de 10−11 m ou inférieures. Cette émission gamma ( γ ) résulte de l'émission de photons lors de transitions nucléaires : du réarrangement des charges internes du noyau nouvellement formé, ou bien de la couche profonde du cortège électronique perturbé, à partir de niveaux d'énergie excités avec des énergies mises en jeu de l'ordre du MeV.

Les principaux modes de désintégration sont la désintégration α, la désintégration β− et la désintégration ε. D'autres modes concernent surtout des nucléides synthétiques : la désintégration β+, l'émission de neutrons, l'émission de protons et la fission spontanée[6]. Par ailleurs la radioactivité γ, qui n'est pas due à une désintégration à proprement parler mais à une transition nucléaire, accompagne souvent les différents modes de désintégration.
- La désintégration α (alpha) se caractérise par l'émission d'un noyau d'hélium 4, qualifié dans ce contexte de particule α. Le noyau radioactif A
Z X, de numéro atomique Z et de nombre de masse A, se transforme alors en un noyau atomique A−4
Z−2 Y, décalé donc de deux cases vers la gauche et de deux cases vers le bas dans le tableau N-Z (figure ci-contre) :
- A
Z X ⟶ A−4
Z−2 Y + 4
2He. - La particule α, de charge 2e (où e désigne la charge élémentaire), emporte sous forme d'énergie cinétique une fraction de l'énergie de masse libérée par la désintégration.
- La désintégration β− (bêta moins) se caractérise par l'émission d'un électron (particule β−), mais aussi par celle d'un antineutrino électronique (conservation du nombre leptonique). Dans A
Z X, un neutron s'est transformé en proton : le noyau garde la même masse atomique mais son numéro atomique est incrémenté de 1 (dans le tableau N-Z, il se décale d'une case vers la gauche et d'une case vers le haut) :
- La désintégration ε (epsilon), ou capture électronique, est la capture par le noyau d'un électron de son cortège électronique, qui s'accompagne de l'émission d'un neutrino électronique (conservation du nombre leptonique). Dans A
Z X, un proton s'est transformé en neutron : le noyau garde la même masse atomique mais son numéro atomique décrémenté de 1 (dans le tableau N-Z, il se décale d'une case vers la droite et d'une case vers le bas) :
- La désintégration β+ (bêta plus) se caractérise par l'émission d'un positon (particule β+), mais aussi par celle d'un neutrino électronique (conservation du nombre leptonique). Dans A
Z X, un proton s'est transformé en neutron : le noyau garde la même masse atomique mais son numéro atomique est décrémenté de 1, comme pour la désintégration ε :
- L'émission de neutrons se caractérise par l'émission d'un ou plusieurs neutrons. Le noyau garde le même numéro atomique mais sa masse atomique diminue d'une ou plusieurs unités (dans le tableau N-Z, il se décale d'autant de cases vers la gauche qu'il y a de neutrons émis) :
- A
Z X ⟶ A−n
Z Y + n 1
0n. - Le nombre n peut être égal à 1 (exemples : 4
1H, 5
2He, 13
4Be), à 2 ( 5
1H, 10
2He), à 3 ( 6
1H) ou à 4 ( 6
1H, 7
1H).
- L'émission de protons se caractérise par l'émission d'un ou deux protons. Le numéro atomique et la masse atomique du noyau diminuent d'une ou deux unités (dans le tableau N-Z, il se décale d'autant de cases vers le bas qu'il y a de protons émis) :
- A
Z X ⟶ A−n
Z−n Y + n 1
1p. - Le nombre n peut être égal à 1 (exemples : 53m
27Co, 151
71Lu, 147
69Tm) ou à 2 ( 45
26Fe, 54
30Zn).
- La fission spontanée se caractérise par la fragmentation du noyau en au moins deux noyaux plus légers, accompagnée par l'émission d'un ou plusieurs neutrons.
- La radioactivité γ (gamma).
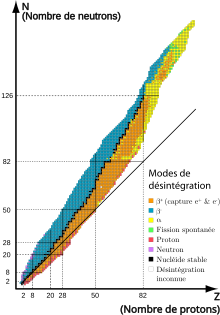
Le mode de désintégration d'un nucléide radioactif dépend de sa position par rapport aux nucléides (stables ou moins instables) de la vallée de stabilité les plus proches de lui dans le tableau Z-N (figure ci-contre). D'une façon générale, les nucléides situés à gauche de la vallée ont trop de neutrons (en comparaison de leur nombre de protons) et subissent une désintégration β− ; les nucléides situés à droite sont excédentaires en protons et subissent une désintégration ε (capture électronique) ou plus rarement une désintégration β+ ; les nucléides de masse atomique supérieure à 208 et proches de la vallée subissent une désintégration α. Il y a diverses exceptions, qui s'expliquent notamment par des considérations de cinétique.
Les désintégrations α, β− et β+ sont souvent accompagnées de l'émission de photons de haute énergie ou rayons gamma, dont les longueurs d'onde sont généralement encore plus courtes que celles des rayons X, étant de l'ordre de 10−9 m ou inférieures. Cette émission gamma (γ) résulte de transitions à partir de niveaux d'énergie excités du noyau. Le spectre émis est un spectre de raies qualitativement comparable aux spectres infrarouge, optique et ultraviolet qui résultent des transitions entre les différents niveaux d'énergie dans les atomes, mais quantitativement la différence provient du fait que les énergies mises en jeu dans le cortège électronique des atomes sont de l'ordre de l'électron-volt (eV), alors que dans les noyaux atomiques elles sont environ un million de fois plus élevées et de l'ordre du MeV.
Radioéléments
modifierLa radioactivité peut provenir de radioéléments (ou radioisotopes) naturels ou artificiels, ces derniers étant produits au laboratoire et dans des réacteurs nucléaires fabriqués par les êtres humains ou se constituant tout à fait exceptionnellement de façon spontanée dans la nature, comme celui qui semble avoir fonctionné il y a deux milliards d'années sur le site d'Oklo au Gabon, ou encore lors d'explosions de bombes atomiques. Dans le premier cas, on parle alors souvent de radioactivité naturelle, pour insister sur le fait que la radioactivité est produite par des radioéléments se rencontrant avec des abondances plus ou moins grandes (mais toujours assez faibles) dans la nature. Dans le deuxième cas, on parle de radioactivité artificielle, terme consacré depuis que les époux Frédéric Joliot et Irène Curie ont reçu en 1935 le prix Nobel de chimie « pour la découverte de la radioactivité artificielle »[7]
Les radioéléments les plus fréquents dans les roches terrestres sont l'uranium 238 : 238U ou U(92,238), le thorium 232 : 232Th ou Th(90,232), et surtout le potassium 40 : 40K ou K(19,40). Outre ces isotopes radioactifs naturels encore relativement abondants, il existe dans la nature des isotopes radioactifs en abondances beaucoup plus faibles. Il s'agit notamment des éléments instables produits lors de la suite de désintégrations des isotopes mentionnés, par exemple de divers isotopes du radium et du radon.
Un des radioisotopes naturels les plus utilisés par l'homme est l'isotope 235 de l'uranium (235U), qui se trouve dans la nature en faible proportion (moins de 1 %), associé à l'isotope 238U, mais dont on modifie la proportion par des techniques d'enrichissement de l'uranium pour qu'il puisse servir de combustible pour la production d'énergie nucléaire et d'explosif pour la production de bombes atomiques.
Un autre radioisotope naturel est le carbone 14, c'est-à-dire l'isotope 14 du carbone (14C). Celui-ci est constamment produit dans la haute atmosphère par des rayons cosmiques interagissant avec l'azote et se détruit par désintégrations radioactives à peu près au même taux qu'il est produit, de sorte qu'il se produit un équilibre dynamique et que la concentration du 14C reste plus ou moins constante au cours du temps dans l'air et dans les organismes vivants qui l'ingèrent (photosynthèse, nutrition, etc.). Une fois l'organisme mort, la concentration en 14C diminue dans ses tissus, ce qui permet de dater le moment de la mort. Cette datation au radiocarbone est un outil de recherche très prisé en archéologie et permet de dater avec une bonne précision des objets organiques dont l'âge ne dépasse pas 50 000 ans.
Loi de désintégration radioactive
modifierUn radioisotope quelconque a autant de chances de se désintégrer à un moment donné qu'un autre radioisotope de la même espèce, et la désintégration ne dépend pas des conditions physico-chimiques dans lesquelles le nucléide se trouve. En d'autres termes, la loi de désintégration radioactive est une loi statistique.
Soit le nombre d'atomes (donc de noyaux atomiques) d'une espèce radioactive donnée présents dans un échantillon à un instant quelconque. Comme la probabilité de désintégration d'un quelconque de ces noyaux ne dépend pas de la présence des autres espèces de radionucléides ni du milieu environnant, le nombre total de désintégrations pendant un intervalle de temps , (chaque désintégration entraînant la disparition de l'un des noyaux), est proportionnel au nombre de noyaux radioactifs de même espèce présents et à la durée de cet intervalle :
- (, ).
En intégrant l'équation différentielle précédente, on trouve la loi de décroissance exponentielle du nombre de radionucléides présents dans le corps à un instant quelconque, en appelant le nombre des radionucléides présents à l'instant :
- .
La demi-vie est la durée au bout de laquelle la moitié d'un échantillon radioactif est désintégrée, le nombre de noyaux fils atteignant la moitié du nombre de noyaux pères. On montre que :
- .
- Première démonstration
Par définition de
- Seconde démonstration
Interaction entre les rayonnements et la matière
modifier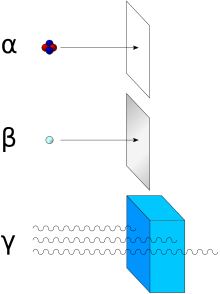
Les particules α sont arrêtées par une feuille de papier.
Les particules β sont arrêtées par une feuille d'aluminium.
Le rayonnement γ est atténué (mais jamais arrêté) par de grandes épaisseurs de matériaux denses (écran en plomb, par exemple).
Action locale des rayonnements
modifierLes rayonnements ionisants provoquent tous au sein de la matière des ionisations et des excitations. La façon dont se produisent ces ionisations dépend du type de rayonnement considéré :
- rayonnement α : un noyau atomique instable émet une particule lourde chargée positivement constituée de deux protons et de deux neutrons (noyau d'hélium 4). En traversant la matière, cette particule interagit principalement avec le cortège électronique des atomes du matériau traversé, ce qui les excite ou les ionise. Ce mécanisme se produit sur une très courte distance car la section efficace d'interaction est élevée : le pouvoir de pénétration des rayonnements alpha est faible (une simple feuille de papier ou 4 à 5 cm d'air les arrêtent totalement) et par conséquent le dépôt d'énergie par unité de longueur traversée sera élevé. Cette énergie dissipée dans la matière traversée se traduira par des excitations et des ionisations et donne lieu à des rayonnements secondaires ;
- rayonnement β- : un noyau atomique instable émet une particule légère et chargée négativement (un électron) qu'une feuille d'aluminium peut arrêter. Cependant ce rayonnement interagit avec la matière en provoquant des excitations et des ionisations par diffusion. Le parcours des électrons dans la matière est plus important que celui des particules alpha (de l'ordre de quelques mètres maximum dans l'air). La perte d'énergie du rayonnement bêta par unité de longueur traversée sera, toute autre chose étant égale, moindre que celle du rayonnement alpha. Il en sera donc de même du nombre d'excitation et d'ionisation produite par unité de longueur. Dans certains cas (électron de forte énergie et matériau traversé de masse atomique élevée) l'émission d'un rayonnement de freinage électromagnétique est possible ;
- rayonnement β+ : un noyau atomique instable émet une particule légère et chargée positivement (un positron) qui interagit, après avoir été ralenti, avec un électron du milieu provoquant son annihilation et la production de deux rayons gamma de 511 keV chacun ;
- rayonnement γ : un noyau atomique qui ne souffre pas d'un déséquilibre baryonique, mais qui se trouve dans un état d'énergie instable, émet un photon très énergétique, donc très pénétrant, pour atteindre un état d'énergie stable ; il faut environ 1 à 5 centimètres de plomb pour l'absorber[8]. Il n'y a guère de différence entre les rayons X durs et le rayonnement γ — seul leur origine les différencie. En général, l'émission de rayons γ suit une désintégration α ou β, car elle correspond à un réarrangement des nucléons, et notamment à une réorganisation de la charge électrique à l'intérieur du nouveau noyau. On rencontre donc fréquemment un noyau radioactif émettant simultanément plusieurs types de rayonnements : par exemple, l'isotope 239 du plutonium (239Pu) est un émetteur α–γ, l'isotope 59 du fer (59Fe) est un émetteur β–γ. Le rayonnement gamma est un faisceau de photons sans charge électrique ni masse. En traversant la matière, il provoque trois types d'interactions :
- Ces mécanismes produiront, in fine, des excitations et ionisations dans le matériau traversé. Le rayonnement gamma et les neutrons ont un fort pouvoir de pénétration dans la matière, plusieurs décimètres de béton pour le rayonnement γ ; un écran en plomb d'une épaisseur de 50 mm arrête 90 % du rayonnement γ (« écran dixième »).
- Rayonnement neutronique : la fission nucléaire et la fusion nucléaire produisent des neutrons en quantités importantes. Ces neutrons se diffusent dans l'environnement du réacteur. Ils nécessitent des protections neutroniques et des compteurs dosimétriques spécialisés.
La nature des lois physiques permettant de calculer les parcours ou l'atténuation des rayonnements dans la matière est différente selon les rayonnements considérés :
- les rayonnements gamma et les flux neutroniques ne sont jamais complètement arrêtés par la matière. C'est pourquoi le flux de photons émergeant d'un écran sera faible, voire quasi-indétectable, mais jamais nul. Voir Couche de demi-atténuation ;
- les lois physiques qui traduisent le parcours des rayonnements alpha et bêta montrent qu'au-delà d'une certaine distance, il est impossible que des particules puissent être retrouvées : le rayonnement incident peut donc être complètement bloqué par un matériau qui joue le rôle d'écran. Voir Parcours d'une particule.
Les défauts cristallins induits par ces rayonnements peuvent servir à dater la formation des minéraux riches en éléments radioactifs comme l'uranium et le thorium, s'ils ne sont pas trop nombreux (c'est-à-dire, s'ils peuvent être repérés individuellement), grâce aux traces de fission qu'ils laissent dans les cristaux.
Action globale
modifier- Quand un minéral riche en éléments radioactifs s'est formé depuis un temps significatif comparé aux demi-vies de ces éléments, l'accumulation des défauts induits peut transformer le matériau cristallin en un matériau amorphe ; c'est ce qu'on appelle la métamictisation. C'est notamment le cas de certains zircons vieux de plus de 500 Ma.
- L'accumulation des perturbations locales est délétère pour les organismes vivants, soit à long terme par le développement d'un cancer (Marie Curie, notamment, est morte d'une leucémie radio-induite), soit à plus court terme, en cas d'exposition intense ou prolongée, sous la forme d'un syndrome d'irradiation aiguë (bombardements atomiques d'Hiroshima et Nagasaki, catastrophe nucléaire de Tchernobyl).
- L'énergie libérée par la radioactivité est partiellement consommée par les transformations locales induites par le rayonnement, mais l'essentiel est en définitive transformé en chaleur[9]. La chaleur libérée par la radioactivité est fondamentale pour :
- l'activité géologique des planètes telluriques (la Terre et Vénus jusqu'à aujourd'hui, Mars et peut-être la Lune dans le passé). Il s'agit surtout de l'énergie libérée par la décomposition radioactive de l'uranium (isotopes 235U et 238U), du thorium (232Th) et du potassium (via son isotope radioactif 40K) ;
- la différenciation des petits corps formés suffisamment tôt, en comparaison des demi-vies d'isotopes de courte demi-vie mais initialement abondants, comme 26Al et 60Fe.
Mesure de la radioactivité (grandeurs et unités)
modifierGrandeurs objectives
modifierCes grandeurs objectives sont mesurables à l'aide d'appareils de physique (compteurs, calorimètres, horloges).
- L'activité d'une source radioactive se mesure en becquerels (Bq), unité correspondant au nombre de désintégrations par seconde, nommée en hommage à Henri Becquerel. On utilise quelquefois (en biologie par exemple) le nombre de désintégrations par minute.
- L'activité massique ou volumique est plus souvent utilisée. Elle correspond à l'activité rapportée à la masse (Bq/kg) ou au volume de l'échantillon mesuré (Bq/L ou Bq/m3).
- Le curie (Ci) était autrefois utilisé : il se définit comme l'activité d'un gramme de radium, soit 37 GBq (37 × 109 désintégrations par seconde), donc 37 Bq = 1 nCi.
- Le coulomb par kilogramme (C/kg) peut également être utilisé : il mesure l'exposition aux rayonnements X et gamma (la charge d'ions libérée dans la masse d'air). L'ancienne unité équivalente était le röntgen qui correspond au nombre d'ionisations par kilogramme d'air.
- Pour le radon, l'énergie alpha potentielle volumique (EAPV) peut être mesurée en joules par mètre cube (J/m3). Cela correspond à l'énergie des particules alpha émises dans un certain volume par les descendants du radon.
Conversion des différentes unités objectives :
Grandeurs subjectives
modifierCe sont des grandeurs non mesurables directement. Elles sont estimées à partir de mesures et de coefficients de pondération définis par la CIPR.
- La dose absorbée par la cible est définie comme l'énergie reçue par unité de masse de la cible, en joules par kilogramme, c'est-à-dire en grays (Gy) dans le système SI. L'ancienne unité était le rad. 1 Gy = 100 rad. On définit également un débit de dose, c'est-à-dire l'énergie absorbée par kilogramme et par unité de temps, mesurée en grays par seconde (Gy/s).
- La dose équivalente, H, pour laquelle chaque rayonnement doit être pondéré pour tenir compte de sa nocivité respective. L'unité du Système International (SI) est le sievert (Sv). Lorsque le rad était utilisé comme unité de dose absorbée, l'unité de dose équivalente était le rem, acronyme de « röntgen equivalent man ».
- La dose efficace, E, est la somme pondérée des doses équivalentes aux organes et tissus T irradiés. Elle rend compte du risque d'apparition de cancer. L'unité utilisée est également le sievert.
Chiffres à considérer avec précaution (non sourcés) :
Le facteur de risque d'induction de cancer est estimé à 4 % par Sv pour une population de travailleurs et à 5 % par Sv pour la population en général. À titre de comparaison, les personnes vivant en Europe occidentale reçoivent une dose annuelle naturelle de 3 mSv dont la moitié est due au radon.
- L'équivalent de dose ambiant, H*(10), est une grandeur opérationnelle exprimée en mSv. C'est une mesure approchante de la dose efficace externe, utilisée pour les mesures de l'environnement.
- L'équivalent de dose individuel, Hp(10), est une grandeur opérationnelle exprimée en mSv. C'est une mesure approchante de la dose efficace externe, utilisée pour les mesures de l'exposition des personnes aux radiations ionisantes dans le cadre de leur profession.
Conversion des différentes unités subjectives :
- 1 rad = 0,01 Gy
- 1 Gy = 100 rad
- 1 rem = 0,01 Sv = 10 mSv
- 1 Sv = 100 rem
Radioactivité dans l'environnement
modifier| Nature de la source | Exposition humaine à la radioactivité selon l'OMS[10] | ||
|---|---|---|---|
| mSv par personne et par an |
Radioactivité naturelle (en %) |
Radioactivité artificielle (en %) | |
| Radon (gaz radioactif naturel dense souvent présent dans les rez-de-chaussées) | 1,3 | 42 | |
| Irradiation d'origine médicale (radiographies, scanners, radiothérapies, etc.) | 0,6 | 20 | |
| Éléments absorbés par alimentation (essentiellement du potassium 40 contenu naturellement dans les aliments) | 0,5 | 16 | |
| Rayonnement cosmique | 0,4 | 13 | |
| Rayonnement interne | 0,2 | 6 | |
| Autres origines artificielles sauf énergie nucléaire civile (industries minières diverses, retombées atmosphériques des essais nucléaires militaires, instruments de mesure, certaines méthodes de mesure industrielles (telles le contrôle de soudures par gammagraphie), etc.) |
0,1 | 3 | |
| Énergie nucléaire civile | 0,01 | 0,3 | |
| Total | 3,1 | 77 | 23 |
Selon une étude de Solenne Billon et al.[11], l'exposition naturelle à la radioactivité représenterait environ 2,5 mSv sur un total de 3,5. Cette dose peut varier de 1 à 40 mSv, selon l'environnement géologique et les matériaux d'habitation. Il existe aussi le rayonnement interne du corps : la radioactivité naturelle des atomes du corps humain se traduit par environ 8 000 désintégrations par seconde (8 000 Bq). Ce taux est principalement dû à la présence de carbone 14 et de potassium 40 dans notre organisme.
On parle de « radioactivité naturelle » pour désigner les sources non produites par les activités humaines, comme celle issue du radon, de la terre, ou du rayonnement cosmique. A contrario, on parle de « radioactivité artificielle » pour désigner la radioactivité due à des sources produites par les activités humaines : réalisation d'examens médicaux (tels les radiographies, tomodensitométries, scintigraphies, radiothérapies), éléments transuraniens synthétiques, concentrations artificiellement élevées de matières radioactives ou production artificielle de rayons gamma (dans un accélérateur de particules, par exemple). Physiquement, il s'agit exactement du même phénomène.
Radioactivité naturelle
modifierLa principale source de radioactivité est représentée par les radioisotopes existants dans la nature et produits lors des explosions des supernovas. On trouve des traces de ces éléments radioactifs et de leurs descendants dans tout notre environnement : un roc de granite contient des traces d'uranium qui, en se désintégrant, émettent du radon.
Les isotopes qui ont subsisté depuis la formation de notre système solaire sont ceux dont la période radioactive est très longue : pour l'essentiel, l'uranium 238 (et dans une moindre mesure l'uranium 235), le thorium 232 et le potassium 40. Du fait de leur durée de vie très longue, leur activité massique est nécessairement très faible, et ces composés naturels ne constituent généralement pas un danger important en termes de radiotoxicité justifiant des mesures de radioprotection.
Le rayonnement tellurique dû aux radionucléides présents dans les roches (uranium, thorium et descendants) est d'environ 0,50 mSv par an en France[11]. Il peut cependant être bien plus important dans certaines régions où la roche est très concentrée en uranium (régions granitiques telles la Forêt-Noire en Allemagne, la Bretagne et le Massif central en France) ou en thorium (région du Kérala en Inde).
Au rayonnement dû aux éléments de longue durée de vie s'ajoute celui des radioisotopes qui forment leur chaîne de désintégration. Ces éléments sont généralement à demi-vie beaucoup plus courte, mais de ce fait, ils ne sont présents qu'en quantité très faible : les lois de la décroissance radioactive font qu'à l'« équilibre séculaire », leur activité est la même que celle de l'élément père.
Parmi ces descendants il faut citer la présence d'un gaz radioactif dense : le radon. Du fait de sa volatilité, il est susceptible de migrer dans l'atmosphère et est ainsi responsable à lui seul de la plus grande part de l'exposition humaine moyenne à la radioactivité : 42 % du total. Il est issu de la désintégration de l'uranium 235 (radon 219) et 238 (radon 222) ainsi que du thorium 232 (radon 220) naturellement contenus dans les sols. Dans les régions où la concentration en uranium dans la roche est élevée, il est souvent présent dans les habitations peu ventilées, ou construites sur des sols à fort dégagement de radon (rez-de-chaussée, maisons, caves). Il entraîne alors une exposition interne importante à cause de ses descendants à période radioactive courte (dont fait notamment partie le polonium).
D'autre part, la Terre est en permanence soumise à un flux de particules primaires de haute énergie en provenance essentiellement de l'espace et (en bien moindre mesure) du Soleil : les rayons cosmiques. Le vent solaire, et le champ magnétique qu'il entraîne, dévient une partie des rayons cosmiques « interstellaires » ; le champ magnétique terrestre (la ceinture de Van Allen) dévie la majeure partie de ceux approchant la Terre. L’atmosphère n'absorbant qu’une partie de ces particules de haute énergie, une fraction de celle-ci atteint le sol, voire pour les plus énergétiques, traverse les premières couches rocheuses.
La part due au rayonnement cosmique représente environ 32 nGy/h[12] au niveau de la mer. Cette valeur varie en fonction de la latitude et de l'altitude, elle double à 1 500 m d'altitude.
Ce rayonnement extraterrestre, par un phénomène de spallation à partir des noyaux plus lourds présents dans la haute atmosphère, entraîne la production de rayonnements et de particules ionisantes secondaires ou tertiaires (neutrons, électrons, alpha, ions, etc.). Ce phénomène est à l'origine, entre autres, de la production de radionucléides cosmiques sur notre planète tels le carbone 14 et le tritium. Ces isotopes ont une demi-vie beaucoup trop courte pour avoir été présents depuis la formation de la Terre, mais sont en permanence reconstitués.
Le carbone 14 dernier est constamment produit dans la haute atmosphère par des rayons cosmiques interagissant avec l'azote, et se détruit par désintégrations radioactives à peu près au même taux qu'il est produit, de sorte qu'il se produit un équilibre dynamique qui fait que la concentration du 14C reste plus ou moins constante au cours du temps dans l'air et dans les organismes vivants qui respirent cet air. Une fois un organisme mort, la concentration en 14C diminue dans ses tissus, et permet de dater le moment de la mort. Cette datation par le carbone 14 est un outil de recherche très prisé en archéologie et permet de dater avec une bonne précision des objets organiques dont l'âge ne dépasse pas cinquante à cent mille ans.
Radioactivité artificielle
modifierL'activité humaine est une autre source majeure de rayonnements ionisants. Principalement, pour 20 % du total des expositions humaines à la radioactivité, par les activités médicales : production de radionucléides par cyclotron (pour les scintigraphies et TEP par exemple). Le reste, représentant 3 % du total des expositions humaines, est produit, par ordre d'importance, par :
- diverses industries minières, centrales au charbon ;
- l'armée : retombées d'essais nucléaires, bombes nucléaires ;
- l'énergie nucléaire civile (0,3 % du total des expositions) : émissions, fuites et production de déchets radioactifs ;
- accidents : catastrophe nucléaire de Tchernobyl, accident nucléaire de Fukushima ;
- la recherche : recherche en physique des particules (par exemple au CERN en Suisse ou au GANIL en France).
C'est l'imagerie médicale au moyen de rayons X qui produit la plus grande part de l'exposition artificielle aux rayonnements ionisants. On ne parle cependant pas de radioactivité car les rayons X ne sont pas issus de réactions nucléaires mais d'excitation électronique de l'atome.
Les réseaux de mesures
modifierDes réseaux de mesures (plus ou moins organisés, complets et accessibles au public, selon les pays) couvrent une partie du territoire de nombreux pays, pour mesurer les variations de radioactivité dans l'eau, l'air, la flore, la faune (domestique ou sauvage, dont espèces-gibier[13]), les aliments, etc.
En France, depuis , l'ASN a réuni l'essentiel de ces réseaux (l'équivalent d'environ 15 000 mesures mensuelles depuis début 2009) en un seul portail, le Réseau national de mesures de la radioactivité de l'environnement[14], « […] de manière à faciliter l'accès […] aux résultats des mesures tout en renforçant l’harmonisation et la qualité des mesures effectuées par les laboratoires ». Un site Internet du Réseau national de mesure de la radioactivité dans l’environnement (RNM)[15], est également ouvert depuis le , notamment alimenté par l'IRSN[16].
Radioécologie
modifierMi-2011 après l'accident nucléaire de Fukushima et à l’occasion d'une Conférence internationale[17] de radioécologie et de radioactivité environnementale le à Hamilton (Canada)[18], huit organismes de recherche européens, avec le soutien de la Commission européenne, ont créé une Alliance européenne en radioécologie[19] pour mieux intégrer la recherche en radioécologie[20]. Ces organismes sont le BfS (Allemagne), le NERC (Royaume-Uni), le CIEMAT (Espagne), l'IRSN (France), le NRPA (Norvège), le SCK CEN (Belgique), le SSM (Suède), et le STUK (Finlande)[18]. La commission soutient aussi le projet STAR porté par l'Alliance européenne en radioécologie, l'université des sciences de la vie de Norvège et l'université de Stockholm sur les thèmes de « la formation, la gestion et la dissémination de la connaissance ainsi que de la recherche en radioécologie », en focalisant d'abord leurs efforts sur les sujets suivants :
- « l’intégration des méthodes d’évaluation du risque radiologique pour l’homme et les écosystèmes » ;
- « la recherche sur l’effet des faibles doses sur les écosystèmes » ;
- « l’étude des conséquences des pollutions mixtes, qui associent les substances radioactives et chimiques ».
Radioprotection
modifierSubstance radioactive
modifierUne substance radioactive doit être repérée par le symbole ☢ (Unicode 2622, UTF-8 E2 98 A2).
- Une « substance radioactive » au sens réglementaire est une substance qui contient des radionucléides, naturels ou artificiels, dont l'activité ou la concentration justifie un contrôle de radioprotection[21].
En ce qui concerne les expositions planifiées à une source radiologique artificielle, un contrôle de radioprotection doit être établi dès lors que le débit de dose maximal susceptible d'être reçu par une personne présente est supérieur à 2.5 μSv/h[22]. A contrario, si le débit de dose maximal subi est indiscutablement inférieur à cette valeur, la substance ou le produit ne relèvent pas de la législation sur la radioprotection, et ne justifient pas l'application des mesures de radioprotection correspondantes.
Gestion des risques sanitaires
modifier
Les conséquences de la radioactivité sur la santé sont complexes. Le risque pour la santé dépend non seulement de l'intensité du rayonnement et la durée d'exposition, mais également du type de tissu concerné — les organes reproducteurs sont 20 fois plus sensibles que la peau (loi de Bergonié et Tribondeau ou loi de la radiosensitivité). Les effets sont différents selon le vecteur de la radioactivité :
- exposition externe à des rayonnements ionisants par une source radioactive distante ;
- contamination radioactive interne, si par exemple l'on ingère ou inhale des radionucléides.
Les normes internationales, basées sur les conséquences épidémiologiques de l'explosion des bombes d'Hiroshima et Nagasaki, estiment que le risque pour la santé est proportionnel à la dose reçue, et que toute dose de rayonnement comporte un risque cancérigène et génétique (CIPR 1990).
La réglementation pour la protection contre les radiations ionisantes est basée sur trois recommandations fondamentales :
- justification : on ne doit adopter aucune pratique conduisant à une irradiation, à moins qu'elle ne produise un bénéfice suffisant pour les individus exposés ou pour la société, compensant le préjudice lié à cette irradiation ;
- optimisation : l'irradiation doit être au niveau le plus bas que l'on peut raisonnablement atteindre ;
- limitation de la dose et du risque individuels : aucun individu ne doit recevoir des doses d'irradiation supérieures aux limites maximum autorisées.
De récentes études de l'IRSN s'intéressent aux effets de la contamination radioactive chronique, qui même à des faibles doses, pourraient ne pas être négligeables, et pourraient provoquer différentes pathologies atteignant certaines fonctions physiologiques (système nerveux central, respiration, digestion, reproduction)[23]. Mais cette vision est contestée, et d'autres acteurs, dont notamment l'Académie de médecine, estiment au contraire que ces craintes sont inutiles[24].
Dose radiative
modifierLe principe retenu en radioprotection est de maintenir l'exposition au niveau le plus bas qu'il est raisonnablement possible d'atteindre (principe ALARA). Pour faciliter cette optimisation, les sites français exposés aux radiations ionisantes sont organisés en zones dont l'accès est plus ou moins restreint. Ces zones sont délimitées par les débits de doses suivants[25] :
- zone bleue : d'environ 2,5 à 7,5 μSv h−1 ;
- zone verte : de 7,5 à 25 μSv h−1 ;
- zone jaune : de 25 μSv h−1 à 2 mSv h−1 ;
- zone orange : de 2 à 100 mSv h−1 ;
- zone rouge : > 100 mSv h−1.
L'environnement naturel émet un rayonnement variant de 0,2 μSv h−1 à 1 μSv h−1, avec une moyenne de 0,27 μSv h−1 (soit 2,4 mSv an−1 habitant−1). Le débit de dose dont on est certain qu'il produit des effets biologiques dangereux se situe à partir de 1 mSv h−1, c'est-à-dire en « zone jaune ». Les effets varient selon le temps auquel on y est soumis. Les effets statistiquement observables apparaissent pour des doses cumulées supérieures à 100 mSv, soit un stationnement de plus de 50 h (une semaine à plein temps) en zone jaune. Cette exposition peut être atteinte en 1 h en « zone orange ».
Dose équivalente
modifier
La dose équivalente est la mesure de dose cumulée d'exposition continue aux radiations ionisantes durant une année, avec des facteurs de pondération. Jusqu'en 1992, les doses équivalentes n'étaient pas mesurées de la même façon en Europe et aux États-Unis ; aujourd'hui ces doses sont standardisées.
La dose cumulée d'une source radioactive artificielle devient dangereuse à partir de 500 mSv (ou 50 rem), dose à laquelle on constate les premiers symptômes d'altération sanguine. En 1992, la dose efficace (E) maximale pour une personne travaillant sous rayonnements ionisants était fixée à 15 mSv sur les 12 derniers mois en Europe (CERN et Angleterre) et à 50 mSv sur les 12 derniers mois aux États-Unis. Depuis , la dose efficace maximale est passée à 20 mSv sur les 12 derniers mois.
Lors d'un scanner médical, le patient peut par exemple recevoir une dose moyenne de 0,05 mSv (examen local), de 25 mSv (scanner du crâne) ou de 150 mSv (scanner du corps entier). Pour éviter tout symptôme d'altération sanguine, on se limite à un maximum de trois examens d'organe par an.
Irradiation
modifierEn France, la dose annuelle d'origine artificielle autre que les applications médicales maximale est fixée à 20 mSv (2 rem) pour les travailleurs et à 1 mSv (0,1 rem) pour la population.
Les facteurs qui protègent des radiations sont :
- Distance (la variation du débit de dose (DDD) est inversement proportionnelle au carré de la distance à la source) ;
- Activité (en centrale nucléaire, on effectue diverses opérations pour enlever les sources des conduits) ;
- Temps (la dose est proportionnelle au temps ; rester le moins longtemps près de la source) ;
- Écran (plomber, recouvrir d'acier, bétonner, immerger la source, par exemple).
Certains comportements sont susceptibles d'entraîner une surexposition à la radioactivité : un patient qui passe 5 radiographies aux rayons X peut subir une dose de 1 mSv ; les passagers et le personnel navigant des avions de ligne, ainsi que les astronautes en orbite, peuvent subir une dose voisine lors d'une éruption solaire très intense. S'ils répètent ces voyages ou effectuent des missions de longues durées, une exposition prolongée accroît le risque d'irradiation.
Alimentation
modifierLe phénomène de radioactivité étant au départ mystérieux parce que mal compris, certaines eaux minérales ou de source en firent quelque temps un argument de vente sur leurs étiquettes : Bussang (Vosges) déclarée d'intérêt public en 1866, Velleminfroy (Haute-Saône) autorisée en 1859, Teissières (Cantal) autorisée en 1847 et « approuvée par l'Académie de médecine », et beaucoup d'autres dont les images d'étiquettes sont visibles sur la Toile[26]. Leurs radioactivités — faibles, mais réelles — étaient de l'ordre de celles que l'on trouve naturellement dans quelques régions granitiques, sans réel danger, mais sans effet thérapeutique non plus.
La Communauté européenne a fixé des doses de radioactivité à ne pas dépasser dans les aliments : le lait ne doit pas dépasser 500 Bq/l pour l'iode 131. Dans certains länder allemands, les normes sont beaucoup plus sévères (100 Bq/l en Sarre, 20 Bq/l en Hesse et Hambourg).
Contamination radioactive
modifierEn zone contaminée par des poussières radioactives, on se protège par une hygiène très stricte : confinements ; tenue étanche ventilée (TEV), heaume ventilé avec surtenue, et/ou autres protections ; nettoyage des surfaces de travail ; précautions pour éviter de soulever la poussière.
Les mesures sont réalisées au moyen de contaminamètres équipés de sonde α ou β [unités de mesure : Bq/m3 (pour la contamination volumique) ou Bq/cm2 (pour la contamination surfacique).
Notes et références
modifierNotes
modifier- Le premier scientifique connu à avoir observé le phénomène de radioactivité est Abel Niépce de Saint-Victor vers 1858, près de 40 ans avant Henri Becquerel, mais il n'a pas mesuré la portée de sa découverte, vite tombée dans l'oubli[2].
Références
modifier- « Marie Curie par elle-même »
- Bernard Fernandez, chap. 1 « Les rayons de Becquerel », dans De l'atome au noyau : Une approche historique de la physique atomique et de la physique nucléaire, Ellipses, , 597 p. (ISBN 978-2729827847), partie I, p. 9.
- Bernard Fernandez, De l'atome au noyau : Une approche historique de la physique atomique et de la physique nucléaire, Ellipses, , 597 p. (ISBN 978-2729827847), partie I, chap. 4 (« L'émanation du thorium »).
- (en) Andrew Grant, « Levitating beads reveal radioactivity », Physics Today, (ISSN 0031-9228, DOI 10.1063/pt.uehq.hnej
 , lire en ligne, consulté le ).
, lire en ligne, consulté le ).
- (en) Jiaxiang Wang, T. W. Penny, Juan Recoaro, Benjamin Siegel, Yu-Han Tseng et David C. Moore, « Mechanical detection of nuclear decays », Physical Review Letters, (arXiv 2402.13257v1, présentation en ligne).
- Cette terminologie est indiquée par exemple dans l'ouvrage de J.P. Sarmant (1988) : Dictionnaire Hachette de Physique, Hachette, Paris. (ISBN 2-01-007597-8).
- http://www.curie.fr/fondation/musee/irene-frederic-joliot-curie.cfm/lang/_fr.htm.
- Eugène Hecht, Physique, De Boeck, 1999, p. 1 099.
- (en) Thomas Ruedas, « Radioactive heat production of six geologically important nuclides », G3, (DOI 10.1002/2017GC006997).
- Jean-Marc Jancovici : à propos de quelques objections fréquentes sur le nucléaire civil.
- (en) Solenne Billon et al., « French population exposure to radon, terrestrial gamma and cosmics ray », Radiation Protection Dosimetry, vol. 113, no 3, , p. 314-320 (DOI 10.1093/rpd/nch463)
- (en) [PDF] UNSCEAR 2000.
- U. Fielitz, Radioaktivität in Wildtieren, Abshlussbericht zum Forschungsvorhaben 4017 des BMU, Universität Goettingen. Goettingen : Goettingen University, 1994, 120 p.
- Réseau national de mesures de la radioactivité de l'environnement.
- Site Internet du Réseau national de mesure de la radioactivité dans l’environnement (RNM).
- Bilan IRSN 2009 de la surveillance radiologique de l’environnement en France : vers une évolution de la stratégie de surveillance, 2011/02/03.
- Site internet de la Conférence internationale de radioécologie et de radioactivité.
- Conférence internationale de radioécologie et de radioactivité environnementale le 20 juin 2011 à Hamilton (Canada).
- Site internet de l'Alliance européenne en radioécologie.
- IRSN, L’Alliance européenne en radioécologie : une initiative pour une meilleure intégration des recherches menées en radioécologie en Europe, 2011/06/20.
- Code de l'environnement, Article L542-1-1.
- Arrêté du 15 mai 2006 relatif aux conditions de délimitation et de signalisation des zones surveillées et contrôlées et des zones spécialement réglementées ou interdites compte tenu de l'exposition aux rayonnements ionisants, ainsi qu'aux règles d'hygiène, de sécurité et d'entretien qui y sont imposées [1].
- Lefigaro.fr.
- Faibles doses de radioactivité : une révolution dans la radioprotection par Emmanuel Grenier (Source : Fusion no 77, 1999).
- Circulaire DGT/ASN no 01 du 18 janvier 2008.
- Eaux minérales et autres produits vendus comme radioactifs.
Voir aussi
modifierArticles connexes
modifier- Liste des unités de mesure de radioactivité
- Radioisotope
- Table des isotopes
- Tableau périodique des éléments
- Période radioactive | Décroissance radioactive
- Période biologique
- Rayonnement ionisant
- Radioprotection
- Radioactivité alpha | Radioactivité bêta | Radioactivité gamma
- Radiotoxicologie
- Faibles doses d'irradiation
- Elaphomyces granulatus (champignon bioaccumulateur et bioconcentrateur, à l'origine de la contamination de sangliers)
- Cassure chromosomique
- Organisme radiorésistant
- Agence nationale pour la gestion des déchets radioactifs
Principaux isotopes radioactifs
modifier| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6 | Cs | Ba | * |
Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | * * |
Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | |||||||||||||||||||
* |
La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||
* * |
Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||
| Pb | Un isotope au moins de cet élément est stable | ||||||||||||||||||
| Cm | Un isotope a une période d'au moins 4 millions d'années | ||||||||||||||||||
| Cf | Un isotope a une période d'au moins 800 ans | ||||||||||||||||||
| Md | Un isotope a une période d'au moins 1 journée | ||||||||||||||||||
| Bh | Un isotope a une période d'au moins 1 minute | ||||||||||||||||||
| Og | Tous les isotopes connus ont une période inférieure à 1 minute | ||||||||||||||||||
- américium : 241Am
- antimoine : 125Sb
- carbone : 14C
- césium : 134Cs, 135Cs et 137Cs
- chlore : 36Cl
- cobalt : 60Co
- curium : 242Cm et 244Cm
- iode : 129I, 131I et 133I
- krypton : 85Kr et 89Kr
- phosphore : 32P
- plutonium : 239Pu et 241Pu
- polonium : 210Po
- potassium : 40K
- radium : 226Ra et 242Ra
- ruthénium : 106Ru
- sélénium : 75Se
- soufre : 35S
- strontium : 90Sr
- thorium : 234Th
- tritium : 3H
- uranium : 235U et 238U
Organisations
modifier- Commission internationale de protection radiologique (CIPR)
- Institut de radioprotection et de sûreté nucléaire (IRSN)
- Société française de radioprotection (SFRP)
- Commission de recherche et d'information indépendantes sur la radioactivité (CRIIRAD)
- Agence nationale pour la gestion des déchets radioactifs (ANDRA)
Liens externes
modifier
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Mesures de la radioactivité dans l’environnement publiées par l'ASN et l'IRSN.
- Déchets-radioactifs.com. Site d'information pédagogique sur la radioactivité, les déchets radioactifs et leur gestion (site édité par l'Andra).
- LaRadioactivite.com (un site expliquant ce qu'est la radioactivité, réalisé par des chercheurs du CNRS).
- Articles de février et d'Henri Becquerel, et analyse de ces articles sur le site BibNum.
- « La transformation radioactive », article de 1903 de Rutherford & Soddy en ligne et analysé sur BibNum.
- La découverte de la radioactivité artificielle, texte de 1935 de Frédéric Joliot-Curie, et analyse sur le site BibNum
- (en) Liste d'accidents (Johnston's Archive).
- La radioactivité de Homer à Oppenheimer http://www.andra.fr/laradioactivite/ – le site de l'exposition itinérante proposée par l'Andra.





























