Séchage supercritique
Le séchage supercritique est un procédé utilisé pour sécher un échantillon (éliminer les phases liquides) d'une manière précise, contrôlée et surtout sans endommager l'échantillon. Il est utile dans la production de systèmes microélectromécaniques, le séchage d'épices, la production d'aérogel, la décaféination du café et la préparation d'échantillons biologiques pour la microscopie électronique à balayage.

Lorsque la matière initialement à l'état liquide traverse la transition de liquide à gazeux (voir la flèche verte sur le diagramme de phase), le liquide se change en gaz à une vitesse finie, tandis que la quantité de liquide diminue. Lorsque cela arrive dans un environnement hétérogène, la tension superficielle dans le liquide induit une traction sur toute structure solide avec laquelle le liquide se trouve en contact. Des structures délicates, telles que les membranes des cellules, les dendrites dans un gel de silice, ou les minuscules mécanismes d'appareils microélectromécaniques, ont tendance à être détériorés voire brisés par cette tension de surface au fur et à mesure du retrait de la jonction liquide-gaz-solide.
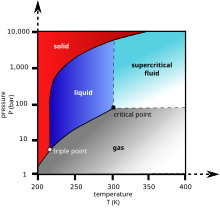
Pour éviter ce phénomène, l'échantillon peut être séché via deux voies alternatives possibles sans franchir la transition liquide-gaz. Dans la lyophilisation, cela signifie aller à gauche du diagramme (basse température, basse pression, flèche bleue). Cependant, cela signifie deux changements de phase : liquide-solide, puis solide-gaz. Si la deuxième transition (sublimation) n'impose que très peu de contrainte physique à l'échantillon, la première transition (solidification) peut endommager certaines structures (notamment en raison de la cristallisation de l'eau si la congélation n'est pas assez rapide[1] : l'expansion de la glace peut rompre les parois cellulaires). Le séchage supercritique, quant à lui, va de l'autre côté du diagramme de phase pour contourner la transition liquide-gaz, tout à droite (haute température, haute pression, flèche rouge). Cette voie de liquide à gaz n'exige aucune transition de phase, empruntant à la place un passage par l'état de fluide supercritique, où la distinction entre gaz et liquide cesse d'exister. Les densités des phases liquides et gazeuses sont égales au point critique du séchage.
Parmi les fluides adaptés au séchage supercritique, on compte le dioxyde de carbone (point critique à 304,25 K (31,1 °C) et 7,39 MPa) ou certains fréons (≈ 300 K, 3,5 à 4 MPa). L'oxyde nitreux a un comportement physique similaire à celui du dioxyde de carbone, mais c'est un oxydant puissant sous forme supercritique. L'eau supercritique est peu pratique en raison du risque de détérioration thermique de l'échantillon au point critique à 647 K (374 °C).
Dans la plupart des procédés de ce type, l'éthanol ou l'acétone est d'abord utilisé pour éliminer toute trace d'eau, en tirant parti de la miscibilité totale de ces deux fluides. Le solvant liquide est ensuite éliminé par rinçage avec du dioxyde de carbone liquide sous haute pression[2]. Le dioxyde de carbone liquide est alors chauffé jusqu'au-delà de son point critique puis il suffit de diminuer graduellement la pression pour libérer le gaz, ce qui laisse un produit sec et qui n'a subi aucune tension due à une transition de phase.
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Supercritical drying » (voir la liste des auteurs).
- Description sur le site de l'EUFIC
- Certains Fréons n'étant plus autorisés pour certaines applications dans l'Union européenne.