Sépiaptérine
La sépiaptérine est un composé organique hétérocyclique naturel, de la famille des ptérines. C'est un pigment ptérinique jaune fluorescent, présent dans de nombreux organismes vivants.
| Sépiaptérine | |
| |
| Structure de la sépiaptérine | |
| Identification | |
|---|---|
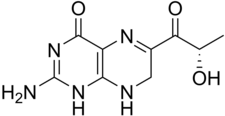
| Nom UICPA | 2-amino-6-lactoyl-7,8-dihydroptéridin-4(3H)-one |
| Synonymes |
6-(S)-lactoyl-7,8-dihydroptérine |
| No CAS | |
| PubChem | 65253 |
| ChEBI | 16095 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C9H11N5O3 [Isomères] |
| Masse molaire[1] | 237,215 3 ± 0,009 9 g/mol C 45,57 %, H 4,67 %, N 29,52 %, O 20,23 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Découverte
modifier
La sépiaptérine a été découverte dans les années 1950 dans le cadre d'une étude sur les pigments jaunes et rouges, certains présentant une fluorescence, présents dans les yeux de mouches du vinaigre (Drosophila melanogaster) mutantes, présentant une teinte sépia, dont la population augmentait[2].
Elle fut isolé pour la première fois par l'équipe de Forrest and Mitchell au California Institute of Technology (Pasadena) sous la forme de cristaux jaunes[3]. Quelques années plus tard, Viscontini et Möhlmann découvrirent également un isomère qu'ils nommèrent isosépiaptérine[4].
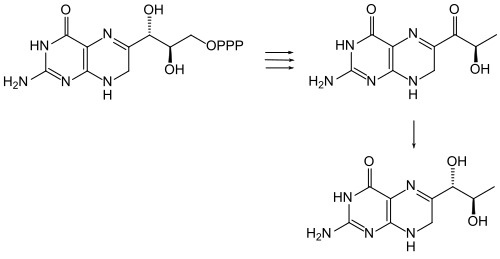
La formule structurelle de la sépiaptérine n'a pu être déterminée qu'en 1978/1979 par Max Viscontini et son équipe (Zurich), et Wolfgang Pfleiderer (Constance)[5],[6]. C'est une 7,8-dihydroptérine très proche de la bioptérine, mais qui porte un groupe carbonyle sur la chaîne C3 en position 6, en lieu et place d'un groupe hydroxyle. Cette chaîne latérale a la structure de l'acide lactique en configuration S.
Occurrence naturelle
modifierLa sépiaptérine est également présente chez un grand nombre d'organismes ; elle est notamment présente dans l'épiderme du bombyx du mûrier[7] et de divers amphibiens et poissons[8]. Des traces ont été trouvées dans l'urine des mammifères, humains compris, ce qui suggère qu'il s'agit d'un intermédiaire métabolique de nombreux organismes.
Biochimie
modifierLa sépiapterine est un précurseur de la tétrahydrobioptérine (BH4), une importante coenzyme d'acide aminé aromatique hydroxylases[9]. L'enzyme sépiaptérine réductase catalyse l'hydrogénation du groupe carbonyle en C-1‘ par le NADPH, formant la dihydrobioptérine[10]. Cette dernière est finalement réduite en tétrahydrobioptérine.
Notes et références
modifier- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Sepiapterin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- E. Hadorn, K. H. Mitchell, Proc. Natl. Acad. Sci. USA, 37, S. 650 (1951).
- H. S. Forrest, H. K. Mitchell, J. Am. Chem. Soc., 76, S. 5656 (1954).
- M. Viscontini, E. Möhlmann, Helv. Chim. Acta, 42, S. 836–841 (1959).
- B. Schircks, H. J. Bieri, M. Viscontini, Helv. Chim. Acta, 61, S. 2731–2738 (1978).
- W. Pfleiderer, Chem. Ber., 112, S. 2750–2755 (1979).
- Junshan Gao, Jing Wang, Wenjing Wang, Chaoliang Liu, Yan Meng, « Isolation, Purification, and Identification of an Important Pigment, Sepiapterin, from Integument of the lemon Mutant of the Silkworm, Bombyx mori », Journal of Insect Science, vol. 13, no 118, (PMID 24773269, DOI 10.1673/031.013.11801, lire en ligne)
- (de) W. Pfleiderer, « Neuere Entwicklungen in der Pteridin-Chemie », Angewandte Chemie, vol. 75, no 21, , p. 993-1011 (DOI 10.1002/ange.19630752102, lire en ligne)
- Shinozaki K, Nishio Y, Okamura T, Yoshida Y, Maegawa H, Kojima H, Masada M, Toda N, Kikkawa R, Kashiwagi A, « Oral administration of tetrahydrobiopterin prevents endothelial dysfunction and vascular oxidative stress in the aortas of insulin-resistant rats », Circulation Research, no 87, , p. 566-73 (PMID 11009561)
- Masako Matsubara, Setsuko Katoh, Miki Akino, Seymour Kaufman, « Sepiapterin reductase », Biochimica et Biophysica Acta - Enzymology and Biological Oxidation, no 122(2), , p. 202–212 (ISSN 0926-6593, DOI 10.1016/0926-6593(66)90062-2)