Statique des végétaux
Vegetable Staticks de Stephen Hales
| Vegetable Staticks or, an account of some Statical Experiments on the Sap in Vegetables... An Attempt to Analyse the Air | |

| |
| Auteur | Stephen Hales |
|---|---|
| Éditeur | W. and J. Innys |
| Lieu de parution | London |
| Date de parution | 1727 |
| modifier |
|
La Statique des végétaux est un ouvrage de Stephen Hales publié en 1727, sous le nom de Vegetable Staticks. Hales est un ecclésiastique qui s'est adonné avec passion à la botanique, la biologie animale et à la construction de machines ingénieuses. Il est surtout connu pour ses Statical Essays (Essais statiques) dont le premier volume Vegetable staticks[1] (1727), traduit par Buffon en Statique des végétaux[2] (1735) contient le compte rendu d'un grand nombre d'expériences sur la physiologie des plantes. Le chapitre VI représentant environ la moitié du livre traite d'un sujet crucial pour la chimie : le dégagement de gaz issus de diverses transformations chimiques et du chauffage de divers végétaux, animaux et substances variées. Son dispositif expérimental de la cuve à eau (fig. 38) permettant de récupérer l’air (ie. le gaz) produit dans une réaction va permettre le développement de la chimie pneumatique, c’est-à-dire de l’étude des transformations chimiques au sein de mélanges gazeux.
Par ses inventions d'appareils ingénieux, Hales permit d'ouvrir de nouveaux champs d'études en physiologie végétale et en chimie.
La méthode de travail
modifierBuffon ne tarit pas d'éloges dans la préface de sa traduction « La nouveauté des découvertes et de la plupart des idées qui composent cet ouvrage, surprendra sans doute les Physiciens. Je ne connais rien de mieux dans son genre, et le genre par lui-même est excellent ». Il est séduit par l'approche purement empiriste de Hales : « C'est par des Expériences fines, raisonnées et suivies, que l'on force la Nature à découvrir son secret » écrit-il.
En ce début du XVIIIe siècle, la pensée européenne est en plein bouleversement, le savoir de l'Antiquité perd de son prestige et les sciences modernes émergent en s'appuyant sur deux piliers : le calcul et l'expérience.
Hales, membre de la Royal Society et grand admirateur de Newton, est convaincu que c'est par la « philosophie expérimentale » que notre connaissance de la nature progressera[3]. Dès la première page de l'introduction de la Statique des végétaux, il déclare:
Cet Être [divin], tout sage s'est fait une loi de créer avec nombre, poids & mesure; il a gardé dans ses ouvrages les proportions les plus exactes: pour les pénétrer, nombrons, pesons & mesurons; c'est la méthode la plus raisonnable, la plus sûre, les grands succès qui l'ont toujours distinguée doivent nous animer à la suivre. (Statique[2], p. 1)
Hales a lu avec attention l'Opticks de Newton et le citera à maintes reprises dans son ouvrage. Comme son modèle intellectuel « the great Sir Isaac Newton », il pose des questions auxquelles il essaie de répondre par des expériences originales. Il semble obnubilé par la volonté de mettre en évidence de nouveaux phénomènes qu'il puisse mesurer, dénombrer et quantifier à loisir.
Hales est un inventeur prodige qui conçoit une foule d’appareils ingénieux pour observer le mouvement de la sève dans les végétaux ou tous les changements de volume de gaz que la nature lui offre. Il semble avoir été pris d'une véritable passion pour l’observation et l’expérimentation. Il multiplie les expériences ingénieuses en donnant des interprétations minimales.
Hales n'est pas le premier à utiliser la méthode expérimentale mais il semble qu'il n'y ait pas de travail équivalent avant lui pour tenter de comprendre le fonctionnement des plantes[3]. Il fit faire un grand pas dans l'approche physique de la transpiration et de l'absorption.
Hales par ses inventions techniques pour récupérer et mesurer les gaz produits lors de réaction, permit d'ouvrir le nouveau champ d'étude de la « chimie pneumatique ». Cette nouvelle activité expérimentale se développera particulièrement en Grande-Bretagne et en France où elle aboutira à la grande reconceptualisation de Lavoisier.
L'ouvrage
modifierDans Vegetable staticks, Hales expose toutes les procédures expérimentales qu'il a imaginées pour explorer deux grands domaines: la physiologie des plantes et la production de gaz par une grande variété de substances qu'il fait chauffer pour en recueillir « l'air » c'est-à-dire le gaz qu'elles contiennent. En 317 pages, il passe en revue méthodiquement 124 expériences.
Les expériences de physiologie végétale
modifier
er tube de verre à l'intérieur duquel sont mis en contact une tige (ou une racine) et de l'eau contenue dans un autre tube plus petit ez qui plonge dans une cuve de mercure et d'eau x
Dans les cinq premiers chapitres, Hales expose ses expériences pour mesurer les pertes en eau des plantes par évaporation, la vitesse de croissance des racines, des pousses et des feuilles, les variations de la puissance d'absorption des racines à différents moments de la journée et de la circulation de la sève. Le chapitre VII, le dernier de l'ouvrage, est consacré à la façon qu'il comprend la croissance des plantes.
Hale démontre et c'est une de ses découvertes les plus importantes[3], que la théorie selon laquelle la sève circule dans les plantes comme le sang dans le corps, est fausse. La sève en effet ne circule pas en circuit fermé comme William Harvey l'avait montré un siècle plus tôt pour le sang. Il montre à travers une série d'expériences très ingénieuses, que la sève, dans les conditions normales, montait, qu'elle ne descendait pas.
L'expérience 21 (fig. 10) consiste à disposer une racine coupée dans l’eau d’un petit tuyau, plongé dans une cuve de mercure.
« La racine tira l’eau avec tant de vigueur, qu’en 6 minutes, le mercure avait monté dans le tuyau d,z à la hauteur z, c’est-à-dire, à 8 pouces.
A huit heures le lendemain matin, le mercure avait baissé de deux pouces »
Dans l'expérience 22 (fig. 11), la branche coupée en i, trempe dans l’eau d’un tube de verre renversé au-dessus d’une cuve x de mercure et eau. Elle « montre la grande force avec laquelle les branches tirent l’eau » .
Il mène ainsi de nombreuses expériences sur la physiologie végétale : le mouvement de la sève (chapitre IV) ou « qu’une quantité considérable d’air est tirée par les plantes » (chapitre V).
Il montre que la transpiration est très dépendante des facteurs climatiques et proportionnelle à la surface foliaire. De plus, il confirme une hypothèse très controversée à l'époque, à savoir que c'est bien le sol qui est le réservoir d'eau pour la plante[3].
Les expériences de « l'Analyse de l'air » (chap. VI)
modifierLe chapitre VI présente de nombreuses expériences pour mesurer les volumes des gaz produits ou absorbés par différents organes des plantes ou lors de différentes réactions, distillations, fermentations.
Hales ne parle jamais de « gaz », terme introduit par van Helmont en 1670 mais qui ne commencera à être utilisé qu'à partir du milieu du XVIIIe siècle en France. À cette époque en Grande-Bretagne, on ne connaissait qu’un seul type de gaz nommé « air », distingué toutefois de la vapeur d’eau ou d’autres « vapeurs » blanches ou colorées. L'air conserve son élasticité quand on le refroidit ou le chauffe alors que les vapeurs d'eau se condensent quand on les refroidit.
Hales, avec les chimistes britanniques, Boyle, Black, Cavendish et Priestley, sont les créateurs de la chimie pneumatique. Tous ont utilisé le terme air prêtant pourtant énormément à confusion[4]. L'air commun était traditionnellement un élément premier, un corps simple d'après la théorie des Quatre éléments. On distinguait différents genres d'air (fixe, inflammable...) qui était de l'air atmosphérique avec différents degrés de pureté.
Plutôt que d'une production d'air lors d'une réaction, Hales parle de « la grande quantité d’air qui est contenue dans les substances animales, végétales ou minérales » (titre du chap. VI). Il s'agit pour lui, d'une libération d'un air préalablement existant, préalablement fixé à l'intérieur, comme il indique dans la préface
on verra que tous les corps contiennent une grande quantité d'air; que cet air est souvent dans ces corps sous forme différente de celle que nous connaissons; c'est-à-dire dans un état de fixité, où il attire aussi puissamment qu'il repousse... ces particules d'air fixe qui s'attirent mutuellement sont, ... souvent chassées hors des corps denses par la chaleur ou la fermentation (Statique[2], page XVJ)
C'est nous qui mettons en gras air fixe pour souligner l'emploi de ce nouveau terme.

L'appareil de la figure 33 est conçu pour mesurer la quantité de gaz qui est produit par un corps « distillé »[n 1]. On dispose la substance à étudier dans une petite cornue r (une retorte), débouchant sur un récipient à long col (un matras) de grande capacité et percé au fond. Lorsqu’on enfonce ce dernier dans une cuvette d’eau x, l’eau entre en force dans le matras jusqu’à z. On redresse le matras et on l'ajuste à la cornue. La variation du niveau de l’eau dans le matras montre quelle quantité d’air est produite ou consommée lors de la distillation.
Ainsi dans l'expérience 49, on observe qu'« un pouce cubique de sang de cochon « distillé » jusqu’aux scories sèches, produit 33 pouces cubiques d’air ».
L’expérience 54, est une combustion : « deux grains [0,1 gramme] de phosphore se fondirent aisément à quelques distance du feu ; ils s’enflammèrent & remplirent la retorte de vapeurs blanches et ils absorbèrent 3 pouces cubiques d’air »
La réaction est P4 + 5 O2(g) → P4O10(g). La combustion d’une mole de phosphore blanc consomme 5 moles de dioxygène de l’air et ne libère qu’une mole de pentoxyde de phosphore (la vapeur blanche), ce qui explique la diminution de « 3 pouces cubiques d’air »
Hales examine aussi les eaux minérales (qui contiennent plus de gaz que l'eau de pluie) ou les substances minérales mais comme il ne s'agit jamais de substances pures, les observations aussi nombreuses soient-elles, restent difficiles à interpréter.

L’appareil de la figure 35 a été conçu pour mesurer la quantité d’air absorbé ou produit par une chandelle, par une réaction chimique, par la combustion de soufre ou de nitre, par la respiration d’un petit animal ou par la fermentation de diverses substances.
On place la substance à étudier sur un piédestal et on aspire l’air avec un siphon jusqu’à ce que l’eau monte au niveau zz.
Dans l'expérience 82, il indique « un demi pouce cubique de Sel ammoniac avec un pouce cubique d'huile de Vitriol, donna le premier jour 5 ou 6 pouces cubiques d'air; mais les jours suivants il en absorba 15 pouces cubiques, et demeura plusieurs jours dans cet état ». Sachant que le Sel ammoniac est du chlorure d'ammonium et que l'huile de Vitriol, l'acide sulfurique, on peut supposer qu'il produisit du chlorure d’hydrogène gazeux :
- 2 NH4Cl + H2SO4 → (NH4)2SO4 + 2 HCL(gaz)
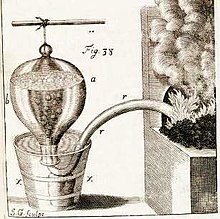
Dans l'appareil de la fig. 38, on dispose d'une cornue rr, dans laquelle est placée la matière à étudier. On la relie à un siphon de plomb qui débouche dans une bonbonne retournée, pleine d'eau. Lorsque le gaz produit dans la cornue passe à travers l'eau, il y abandonne une « bonne partie des esprits acides & des vapeurs sulphureuses ».
Hales distille par cette méthode des dizaines de substances: « de la Corne, la Pierre ou le calcul humain, les écailles d'Huîtres, le Chêne, la graine de Moutarde, le blé de Turquie, les Pois, le Tabac, l'Anis, l'huile d'Olive, le Miel, la Cire, le Sucre etc. ». Certaines substances donnent plus « d'air » que d'autres.
Il observe (expérience 55, p. 152) que: « un demi pouce cubique ou 135 grains de cœur de Chêne, produit 128 pouces cubiques d'air; c'est-à-dire une quantité égale à 216 fois le volume du morceau de Chêne ». En bon physicien, connaissant la loi de Boyle-Mariotte (P.V=cste), il en déduit logiquement
si ces 216 pouces cubiques étaient dans un état élastique, resserré dans l'espace d'un pouce cubique, ils presseraient contre les côtés du pouce cubique avec une force expansive égale à la pression de 3310 livres...force suffisante pour briser le Chêne avec une grande explosion: l'on doit donc conclure raisonnablement, que la plupart des particules de cet air nouvellement produit étaient, dans un état fixe dans la Pomme et le Chêne, et que c'est par le feu ou par la fermentation qu'elles acquièrent ce principe actif de répulsion qui les rend élastique. (Statique[2] p.185)
La deuxième étape de son raisonnement, est une hypothèse qui pourtant n'a rien d'une conclusion aussi raisonnable que ce qu'il annonce. L'air selon lui, peut connaître divers états : un état élastique, obéissant à la loi de Boyle-Mariotte et un état fixe n'y obéissant pas. Comme nous avons pu l'entrevoir, ces airs fixés dans les substances pouvaient être des espèces chimiques de nature très diverse. Dans les décennies suivantes, Joseph Black va s'attacher à caractériser précisément l'air fixé dans la craie et libéré par la calcination[n 2] qu'il appellera air fixe, renommé par Lavoisier et ses collaborateurs gaz acide carbonique[5] [CO2].
Une des choses qui impressionna le plus Buffon, c'est l'étude de la Pierre de la Vessie (calculs rénaux ou lithiase urinaire). Hales indique : « Je distillai une de ces pierres tirée de la vessie dans la retorte de fer (fig. 38). Elle pesait 230 grains...il en sortit avec vivacité dans la distillation 516 pouces cubiques d'air élastique, c'est-à-dire, 645 fois le volume de la pierre » (p.167). Les calculs rénaux sont composés d'oxalate de calcium dihydraté. Le naturaliste Buffon ne cache pas son enthousiasme pour cette expérience : « Aurions nous pu penser que certains corps, comme la Pierre de la Vessie et le Tartre ne sont pour plus de deux tiers que de l'air solide & métamorphosé ? »
L'expérience 76 semble surprendre Hales : « Un pouce cubique de Soufre commun, distillé dans une retorte de verre, se dilata fort peu, quoiqu'exposé à un très grand feu, et quoique qu'il passa tout dans le récipient sans s'enflammer ». En effet, la production d'une mole de dioxyde de soufre SO2 consomme une mole de dioxygène et donc la réaction se fait sans changement de volume, hormis la dilatation due à l'augmentation de la température.
Notes
modifier- c'est-à-dire chauffé plus ou moins fort dans une cornue ou une cucurbite garnie d'un chapiteau se prolongeant par un tuyau de décharge descendant, permettant de récupérer les substances les plus volatiles, s'échappant en premier sous forme gazeuse
- CaCO3(s) → CaO + CO2(g)
Références
modifier- Stephen Hales, Vegetable staticks, or, An account of some statical experiments on the sap in vegetables…, W. & J. Innys, (lire en ligne)
- Stephen Hales traduit par M. de Buffon, La Statique des végétaux et l'analyse de l'air, Debure aîné, (lire en ligne)
- Pierre Cruizat, « Comprendre la montée de la sève dans les arbres De Hales (1727) à Dixon (1914) », dans P. Robin, J-P. Aeschlimann, C. Feller, Histoire et agronomie Entre rupture et durée, IRD,
- Pierre de Menten, Dictionnaire de chimie Une approche étymologique et historique, de boeck, , 396 p.
- Lavoisier, Fourcroy, Berthollet, Guyton de Morveau, Méthode de nomenclature chimique, Cuchet (Paris), (lire en ligne)