Réarrangement de Favorskii
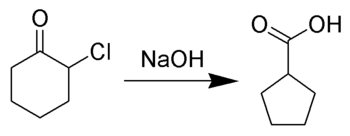
Le réarrangement de Favorskii, du nom du chimiste russe Alexei Yevgrafovich Favorskii (en), consiste principalement en un réarrangement de cyclopropanones et de cétones alpha-halogénées conduisant à des dérivés d'acide carboxylique. Dans le cas des cétones alpha-halogénées cycliques, le réarrangement de Favorskii entraîne une réduction de la taille du cycle. Ce réarrangement nécessite la présence d'une base : on utilise parfois un hydroxyde, le produit est alors un acide carboxylique ; on peut également utiliser un alcoolate ou une amine, le produit étant alors respectivement un ester ou un amide. Dans le cas des cétones halogénées sur les deux positions alpha, il y a élimination de HX et il se forme une énone α,β-insaturée[1],[2],[3],[4],[5],[6],[7],[8].
Mécanisme réactionnel
modifierOn pense que le mécanisme de réaction implique la formation d'un énolate du côté opposé à l'halogène par rapport à la fonction cétone. Cet énolate se cyclise en un intermédiaire cyclopropanone qui est ensuite attaqué par l'hydroxyde qui joue le rôle de nucléophile.

Une autre théorie veut que la deuxième étape du mécanisme se fasse en plusieurs étapes : l'ion chlorure part tout d'abord, ce qui produit un cation oxyallyl zwitterionique avant la fermeture du cycle qui produit la cyclopropanone[9].
Lorsque la formation de l'énolate est impossible, le réarrangement de Favorskii se produit par un mécanisme alternatif. Il y a alors addition d'hydroxyde sur la cétone, suivi d'un effondrement concerté de l'intermédiaire tétraédrique et d'une migration du carbone voisin avec déplacement de l'halogénure. On appelle cet autre mécanisme « réarrangement pseudo-Favorskii », bien qu'avant que le mécanisme ait été découvert, on pensait que tous les types de réarrangements de Favorskii avaient eu lieu par cet autre mécanisme.
Dégradation de Wallach
modifierDans la dégradation de Wallach (Otto Wallach, 1918), on part d'une molécule avec deux atomes d'halogène en alpha de la cétone de part et d'autre, ce qui entraîne la formation d'une nouvelle cétone après oxydation et décarboxylation[10],[11].
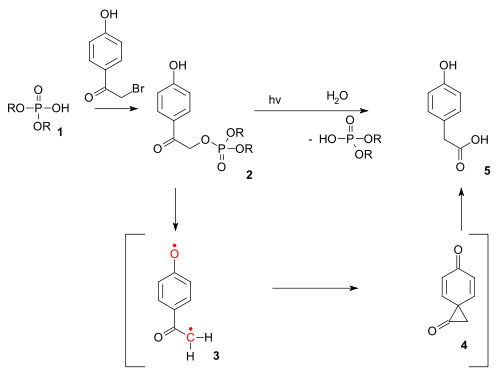
Réaction Photo-Favorskii
modifierLe réarrangement de Favorskii existe également sous la forme d'une réaction photochimique. La réaction photo-Favorskii a été utilisée dans le déverrouillage photochimique de certains phosphates (par exemple ceux de l'ATP) protégés par des groupes dits p-hydroxyphénacyles[12]. La déprotection passe par un diradical triplet (3) et un intermédiaire dione spiro (4), bien que ce dernier n'ait jusqu’à présent pas encore été détecté[13].
Voir aussi
modifier- La synthèse classique du cubane passe par deux réarrangements de Favorskii.
- La cycloaddition du triméthylèneméthane peut se faire par un mécanisme similaire.
Références
modifier- Favorskii, A. E. J. Russ. Phys. Chem. Soc. 1894, 26, 590.
- Favorskii, A. E. J. Russ. Phys. Chem. Soc. 1905, 37, 643.
- (de) A. Y. Faworsky, « Über die Einwirkung von Phosphorhalogenverbindungen auf Ketone, Bromketone und Ketonalkohole », J. Prakt. Chem., vol. 88, no 1, , p. 641–698 (DOI 10.1002/prac.19130880148)
- Arthur Cope, Organic Reaction Volume XI, New York, Wiley-Interscience, , 1re éd. (ISBN 978-0-471-17127-0, DOI 10.1002/jps.2600500225)
- Ring Contraction via a Favorskii-Type Rearrangement: Cycloundecanone, Org. Synth. 56, coll. « vol. 6 », , p. 368
- Takayuki Shioiri et Nobutaka Kawai, « New methods and reagents in organic synthesis. 2. A facile conversion of alkyl aryl ketones to α-arylalkanoic acids using diphenyl phosphorazidate. Its application to a new synthesis of ibuprofen and naproxen, nonsteroidal antiinflammatory agents », J. Org. Chem., vol. 43, no 14, , p. 2936–2938 (DOI 10.1021/jo00408a049)
- Cycloundecanecarboxylic Acid, Org. Synth. 62, coll. « vol. 7 », , p. 135
- Cyclopentanecarboxylic acid, methyl ester, Org. Synth. 39, coll. « vol. 4 », , p. 594
- Akhrem, Ustynyuk et Titov, « The Favorskii Rearrangement », Russian Chemical Reviews, vol. 39, no 9, , p. 732–746 (ISSN 0036-021X, DOI 10.1070/rc1970v039n09abeh002019, lire en ligne)
- (de) Wallach, « Zur Kenntnis der Terpene und der ätherischen Öle. Über das Verhalten zweifach gebromter hexacyclischer Ketone in Abhängigkeit von der Stellung der Bromatome », Justus Liebigs Ann. Chem., vol. 414, no 3, , p. 271–296 (DOI 10.1002/jlac.19184140303)
- (de) Wallach, « Zur Kenntnis der Terpene und der ätherischen Öle », Justus Liebigs Ann. Chem., vol. 414, no 3, , p. 296–366 (DOI 10.1002/jlac.19184140304)
- Park et Givens, « New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes », J. Am. Chem. Soc., vol. 119, no 10, , p. 2453–2463 (DOI 10.1021/ja9635589)
- Givens, Heger, Hellrung et Kamdzhilov, « The Photo-Favorskii Reaction of p-Hydroxyphenacyl Compounds is Initiated by Water-Assisted, Adiabatic Extrusion of a Triplet Biradical », J. Am. Chem. Soc., vol. 130, no 11, , p. 3307–3309 (PMCID 3739295, DOI 10.1021/ja7109579)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Favorskii rearrangement » (voir la liste des auteurs).