Utilisateur:Patrick.Delbecq/Brouillon11
Un mélange azéotrope ou azéotropique (du grec ά, a privatif, ζέω, zéô, « bouillir » et τρορός, tropós, « manière, direction, tour, façon, mode »[1],[2]) est un mélange liquide qui bout à température fixe en gardant une composition fixe[3]. Un mélange azéotropique présente une phase vapeur ayant la même composition que la phase liquide avec laquelle elle est en équilibre.
Il existe deux types d'azéotrope, selon les déviations induites par les interactions intermoléculaires par rapport au modèle de la solution idéale : l'azéotrope positif ayant, à température donnée, une pression supérieure à celle prédite par la loi de Raoult, et l'azéotrope négatif ayant une pression inférieure. Il existe des doubles azéotropes, des azéotropes à plus de deux corps et des hétéroazéotropes.
La composition d'un azéotrope ne peut être dépassée par une distillation classique. Les techniques de distillation par balancement de pression et extractive permettent de « casser » un azéotrope.
Définitions
modifierZéotropie, écarts à l'idéalité
modifier-
Figure 1 - Loi de Raoult, modèle idéal. -
Figure 2 - Déviation positive. -
Figure 3 - Déviation négative.
Un mélange zéotrope ou zéotropique est un mélange dont la température et la composition varient continuellement lors d'un processus de distillation à pression constante[4]. De plus, la composition du liquide et de la vapeur (phase gaz) en équilibre sont différentes.
À température donnée, lorsque les composés de natures différentes (molécules et ) s'attirent autant que les composés de même nature (molécules entre elles et entre elles), le mélange est idéal et l'équilibre liquide-vapeur suit la loi de Raoult (cf. figure 1)[5]. Les mélanges benzène - toluène et méthanol - éthanol - propan-1-ol - butan-1-ol ont des comportements très proches du comportement idéal[6]. Dans la plupart des mélanges, les interactions entre molécules induisent des écarts à l'idéalité.
Pour un mélange réel à température donnée, lorsque les composés de natures différentes s'attirent moins que les composés de même nature, la pression de distillation est supérieure à celle définie par la loi de Raoult. Le mélange est dit mélange à déviation positive (cf. figure 2)[7],[8]. À pression donnée, un mélange à déviation positive distille à une température inférieure à celle établie par la loi de Raoult[8].
Inversement, à température donnée, lorsque les composés de natures différentes s'attirent plus que les composés de même nature, la pression de distillation est inférieure à la pression définie par la loi de Raoult. Le mélange est dit mélange à déviation négative (cf. figure 3)[9],[8]. À pression donnée, un mélange à déviation négative distille à une température supérieure à celle établie par la loi de Raoult[8].
Azéotropie
modifierUn mélange « azéotrope » ou « azéotropique » est un mélange dont la composition et la température ne varient pas au cours du processus de distillation à pression constante[3],[2]. La phase liquide et la phase gaz ont la même composition[8]. Un mélange azéotrope se comporte comme un corps pur. Les azéotropes n'apparaissent que lorsque les déviations par rapport à la loi de Raoult deviennent suffisamment importantes, c'est-à-dire pour des mélanges dont le comportement s'écarte de façon suffisamment importante de celui du mélange idéal (cf. figure 1).
On définit pour les deux corps et :
- à température donnée, les pressions de vapeur saturante et et la pression de l'azéotrope ;
- à pression donnée, les températures d'ébullition et et la température de l'azéotrope.
-
Figure 4 - Azéotrope positif.
Système méthanol-chloroforme. -
Figure 5 - Azéotrope négatif.
Système eau-acide-formique.
Lorsque, à température donnée, la pression de l'azéotrope est supérieure à la pression déterminée par la loi de Raoult, l'azéotrope est dit azéotrope à déviation positive ou azéotrope positif (cf. figure 4)[7],[10],[8]. Dans ce cas, la pression est supérieure à la plus grande des deux pressions de vapeur saturante à cette température ; l'azéotrope positif peut également être appelé azéotrope à pression de vapeur saturante maximale ou azéotrope à maximum de pression. À pression donnée, la température d'un azéotrope positif est inférieure à la plus petite des deux températures d'ébullition à cette pression[7] ; l'azéotrope positif peut également être appelé azéotrope à température de bulle minimale ou azéotrope à minimum de température[8]. Par exemple, à pression atmosphérique, un mélange à 96 % d'éthanol et 4 % d'eau (pourcentages massiques) présente un azéotrope qui bout à 78,2 °C[11]. Cette température est inférieure à celle de l'eau pure (100 °C) et celle de l'éthanol pur (78,4 °C).
Lorsque, à température donnée, la pression de l'azéotrope est inférieure à la pression déterminée par la loi de Raoult, l'azéotrope est dit azéotrope à déviation négative ou azéotrope négatif (cf. figure 5)[9],[10],[8]. Dans ce cas, la pression est inférieure à la plus petite des deux pressions de vapeur saturante à cette température ; l'azéotrope négatif peut également être appelé azéotrope à pression de vapeur saturante minimale ou azéotrope à minimum de pression. À pression donnée, la température d'un azéotrope négatif est supérieure à la plus grande des deux températures d'ébullition à cette pression[9] ; l'azéotrope négatif peut également être appelé azéotrope à température de bulle maximale ou azéotrope à maximum de température[8]. Par exemple, à pression atmosphérique, un mélange à 77,4 % d'acide formique et 22,6 % d'eau (pourcentages massiques) présente un azéotrope qui bout à 107,2 °C[12]. Cette température est supérieure à celle de l'eau pure (100 °C) et celle de l'acide formique pur (101,1 °C).
L'azéotropie est un phénomène courant. Les azéotropes négatifs sont cependant moins fréquents que les azéotropes positifs : sur l'ensemble des azéotropes connus, le rapport est d'un azéotrope négatif pour neuf azéotropes positifs[2],[13],[14]. Il existe des cas encore plus rares de double azéotropie, comme celui du mélange benzène - hexafluorobenzène présenté sur la figure 6[15],[13]. L'azéotropie concerne également des mélanges à plus de deux constituants[13].
-
Figure 6 - Double azéotrope.
Système benzène-hexafluorobenzène[15]. -
Figure 7 - Hétéroazéotrope au point C.
Un hétéroazéotrope est un cas particulier dans lequel la phase liquide subit une démixtion. La vapeur est alors en équilibre avec deux phases liquides de compositions différentes. Les deux phases liquides ont cependant une composition globale identique à celle de la vapeur (cf. figure 7)[16],[8],[10]. Une démixtion apparait lorsque les constituants en phase liquide se repoussent de façon suffisante. Au contraire, s'ils s'attirent, leur miscibilité est favorisée : il ne peut donc exister d'hétéroazéotrope négatif, il n'existe que des hétéroazéotropes positifs[9]. Par opposition à l'hétéroazéotrope, un azéotrope sans démixtion de liquides peut être appelé homoazéotrope[8]. L'hétéroazéotrope est pour les équilibres liquide-vapeur l'équivalent de l'eutectique des équilibres solide-liquide, dans lequel un liquide est en équilibre avec deux solides démixés.
Conditions d'apparition d'un azéotrope
modifierFacteurs favorisant les azéotropes
modifier
Si les deux corps d'un mélange présentent un point de Bancroft, c'est-à-dire s'il existe une température à laquelle les deux corps ont la même pression de vapeur saturante (cf. figure 8), alors le mélange a un comportement azéotropique (positif ou négatif) dans des conditions de pression et température proches de ce point[17],[18]. Pour des conditions suffisamment éloignées de ce point, le mélange peut perdre son comportement azéotropique. À pression donnée, un écart de température d'ébullition de plus de 50 °C écarte pratiquement toute possibilité d'azéotropie[13]. La réciproque de la règle de Bancroft n'est pas vraie : tous les mélanges binaires formant un azéotrope n'ont pas nécessairement de point de Bancroft[18]. Le système eau-éthanol présente un azéotrope mais pas de point de Bancroft[17], de même que le système dioxyde de carbone-éthane.
Les azéotropes n'apparaissent que pour des déviations suffisamment importantes par rapport au modèle idéal de la loi de Raoult, lorsque les forces intermoléculaires (attractives ou répulsives) interespèces sont bien plus importantes que les forces entre molécules de même espèce[18]. Par exemple, les liaisons hydrogène favorisent les azéotropes négatifs[13] dans les mélanges eau-alcool (eau-éthanol), acétate de butyle-1,2,2-trichloropropane et cyclohexanone-bromoforme[19]. Dans les solutions aqueuses, la dissociation d'un électrolyte favorise les azéotropes négatifs si l'électrolyte a une volatilité au moins égale à celle de l'eau[19]. Par exemple, la dissociation de l'acide formique favorise l'azéotrope eau-acide formique[19] :
Pression, température et composition d'un azéotrope
modifierLes interactions moléculaires varient en fonction de la température et de la pression, aussi la composition et la température d'apparition d'un azéotrope varient-elles en fonction de la pression (cf. figure 15)[8]. Pour un mélange de deux corps ( = 2) en équilibre de deux phases liquide et vapeur ( = 2), la règle des phases donne une variance = 2 ; on peut faire varier deux paramètres (parmi la pression, la température et les compositions des deux phases) indépendamment l'un de l'autre et conserver l'équilibre liquide-vapeur (les autres paramètres sont alors subis et déduits des lois des équilibres de phases). Dans un azéotrope les compositions des deux phases sont identiques. On doit donc considérer une contrainte supplémentaire ( = 1) dans le calcul de la variance, qui devient = 1. L'azéotrope d'un mélange binaire ne dépend que d'un seul paramètre. Ainsi, si la pression est imposée, la température et les compositions de phases de l'azéotrope sont subies et ne peuvent être modifiées. Dans un diagramme de phases isotherme ou isobare, un azéotrope est représenté par un point (cf. figure 4 et figure 5). Pour un mélange de corps, la variance d'un azéotrope vaut . Pour un mélange de trois corps ( = 3), la variance = 2 indique que l'on peut choisir deux paramètres indépendamment l'un de l'autre : on peut imposer la pression et la température, mais la composition est subie.
Le tableau suivant donne les conditions de l'azéotrope négatif eau-acide formique. À pression atmosphérique, la température d'ébullition de l'eau est 100 °C, celle de l'acide formique 100,8 °C[20].
| Fraction molaire de l'eau |
Pression (atm - mmHg) |
Température (°C) |
|---|---|---|
| 0,42 | 1 - 760 | 107,3 |
| 0,50 | 0,26 - 200 | 71,3 |
| 0,58 | 0,13 - 100 | 55,7 |
Cette propriété peut être utilisée pour dépasser le point d'azéotrope dans le cas d'une distillation azéotropique, dans une technique appelée distillation par balancement de pression (pressure-swing distillation en anglais)[20].
Le comportement d'un mélange azéotropique peut redevenir zéotropique sur toute la plage de composition à certaines pressions, notamment loin du point de Bancroft s'il existe, et inversement. Par exemple, l'azéotrope eau-éthanol disparait au-dessous de 0,07 atm[8],[20]. Dans ce cas, une distillation classique peut être employée pour obtenir les corps purs[20].
Théorème de Gibbs-Konovalov
modifierSoit, à température donnée, un mélange de deux corps notés et . Leurs pressions de vapeur saturante à sont notées et ; on suppose que .
Un azéotrope ne peut apparaitre que lorsque le comportement du mélange est suffisamment éloigné du modèle idéal de la loi de Raoult. Si, à température constante, sur toute la plage de composition du corps pur au corps pur, la pression d'équilibre liquide-vapeur est comprise entre et , le mélange ne peut pas présenter d'azéotrope.
Si, à température constante, il existe une plage de composition sur laquelle la pression d'équilibre est en dehors de la plage de pression de à , alors il existe nécessairement une pression extrémale (maximale ou minimale). Le théorème de Gibbs-Konovalov (ou deuxième règle de Konovalov) montre qu'en un point extrémal d'un diagramme de phases binaire isotherme (ou isobare), les compositions de la phase liquide et de la phase vapeur en équilibre sont identiques, et, réciproquement, qu'en un point où les compositions des deux phases sont égales, la pression (ou la température) est extrémale. Il s'agit dans tous les cas d'un azéotrope[21].
Un azéotrope positif est caractérisé par un maximum de pression dans un diagramme isotherme ou par un minimum de température dans un diagramme isobare (cf. figure 4). Un azéotrope négatif est caractérisé par un minimum de pression dans un diagramme isotherme ou par un maximum de température dans un diagramme isobare (cf. figure 5).
Thermodynamique de l'azéotropie
modifierSoit un mélange de deux corps notés et , à température donnée et pression modérée (moins de 10 bar). La phase vapeur est considérée comme un mélange de gaz parfaits, la phase liquide n'est pas idéale. L'équilibre liquide-vapeur est décrit par les équations :
ou :
avec :
- et les coefficients de partage ;
- la pression totale ;
- et les pressions de vapeur saturante à la température ;
- et les fractions molaires des deux corps en phase liquide () ;
- et les fractions molaires des deux corps en phase gaz () ;
- et les coefficients d'activité des deux corps en phase liquide.
Dans un mélange azéotropique, la phase gaz a la même composition que la phase liquide :
On obtient pour la pression totale d'un azéotrope :
Il existe donc un azéotrope s'il existe une valeur de vérifiant[2] :
Cette condition ne peut être remplie par le modèle de la solution idéale (loi de Raoult, loi de Henry), dans lequel . Le modèle idéal est donc incapable de représenter un azéotrope.
La volatilité relative du corps par rapport au corps est définie par :
La volatilité vaut pour un mélange idéal quelle que soit la composition. Pour un mélange réel, une volatilité inférieure à 1 signifie que le corps s'évapore moins facilement que le corps . Inversement, une volatilité supérieure à 1 signifie que le corps s'évapore plus facilement que le corps . La volatilité vaut 1 pour un azéotrope.
Les coefficients d'activité des corps purs valent :
- ( pur)
- ( pur)
Les coefficients d'activité à dilution infinie sont définis par :
- (dilution infinie de dans )
- (dilution infinie de dans )
Lorsque le mélange binaire tend vers le corps pur, soit , si < 1, alors :
En conséquence :
On tire de l'étude des divers cas possibles les conditions d'apparition des azéotropes simples ou doubles (homoazéotropes ou hétéroazéotropes) présentées dans le tableau suivant[2],[13],[22],[23]. Ces conditions sur les coefficients d'activité à dilution infinie et sont nécessaires et suffisantes pour les azéotropes simples, elles ne sont que nécessaires pour les azéotropes doubles (les mélanges zéotropiques répondent aux mêmes conditions que les doubles azéotropes).
- Exemple[24]
- Pour un mélange eau (1) - butan-1-ol (2) à 100 °C, on a :
- = 101,33 kPa et = 51,89 kPa ;
- = 21 et = 4.
- On peut présager un azéotrope positif, puisque :
- = 0,25 < = 0,512 < = 21
- À 100 °C et 136 kPa, le mélange butan-1-ol - eau présente un hétéroazéotrope : la vapeur est en équilibre simultanément avec une phase liquide riche en eau et pauvre en butan-1-ol, et une phase liquide riche en butan-1-ol et pauvre en eau.
Distillation d'un mélange azéotropique
modifierDistillation classique
modifier-
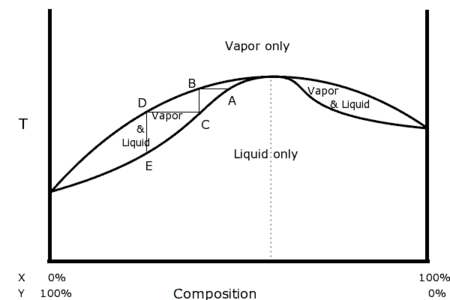
Figure 13 - Distillation d'un mélange à azéotrope positif.
-
Figure 14 - Distillation d'un mélange à azéotrope négatif.
Un mélange azéotrope se comporte comme un corps pur lors de son ébullition : la pression et la température ne varient pas, la composition du liquide et de la vapeur sont identiques et ne varient pas au cours du processus. Lors d'un processus de distillation, il est par conséquent impossible d'obtenir des compositions de liquide ou de gaz au-delà du point d'azéotrope. Par exemple, lors de la distillation à pression constante d'un mélange binaire liquide représenté par le point A de la figure 13, la vapeur en équilibre avec le liquide a la composition du point B, elle est condensée en liquide C. La vapeur en équilibre avec le liquide C a la composition D, elle est condensée en liquide E et ainsi de suite… Au fur et à mesure du processus, les deux phases s'enrichissent en produit X. Lorsque le liquide et la vapeur atteignent la même composition au point azéotrope (ici un azéotrope positif situé au minimum de température), cette composition ne varie plus. Dans ces conditions, il est alors impossible d'obtenir un liquide de concentration en X plus élevée que la concentration de l'azéotrope. Par exemple, la distillation à pression atmosphérique du mélange eau-éthanol ne permet pas d'obtenir des compositions de plus de 96 % en masse d'éthanol.
Le même processus de distillation (condensation de la vapeur en équilibre avec un liquide) appliqué à un azéotrope négatif conduit à s'éloigner de l'azéotrope plutôt que de s'en rapprocher (cf. figure 14). À pression constante, pour s'approcher d'un azéotrope négatif à partir du liquide E, il faut d'abord évaporer ce liquide pour obtenir la vapeur D. Le liquide C en équilibre avec la vapeur D est à son tour évaporé. La vapeur B obtenue est en équilibre avec le liquide A. Les deux phases sont ainsi successivement enrichies en produit X.
La distillation classique peut éventuellement être utilisée dans des conditions de pression dans lesquelles l'azéotrope d'un mélange disparait, par exemple à moins de 0,07 atm pour la distillation du mélange eau-éthanol[25].
Distillation par balancement de pression
modifier-
Figure 15 - Distillation par balancement de pression. La composition et la température d'un azéotrope dépendent de la pression.
-
Figure 16 - Schéma de procédé montrant un appareil de distillation par balancement de pression. Azéotropes positifs.
Le produit A correspond au produit Y de la figure 15, le produit B au produit X.
En génie chimique, la technique appelée distillation par balancement de pression (pressure-swing distillation en anglais)[20] utilise la dépendance de la composition de l'azéotrope à la pression pour contourner l'azéotrope.
Par exemple, on veut distiller le mélange A constitué des corps X et Y, Y étant le corps le plus lourd (ayant la température d'ébullition la plus élevée). Ce mélange présente un comportement azéotropique positif (à minimum de température). Sur la figure 15, le mélange A est dans un premier temps distillé à basse pression pour l'enrichir en produit X jusqu'au point B, situé immédiatement à gauche de l'azéotrope positif à basse pression. La pression et la température sont ensuite augmentées. Le point C résultant se situe toujours à gauche de l'azéotrope à haute pression, mais celui-ci est situé beaucoup plus loin. On peut ainsi continuer à enrichir le liquide en produit X jusqu'au point D. Lorsque l'on repasse à la première pression, on obtient le point E. Ce point est situé au-delà de l'azéotrope à basse pression, mais est inaccessible par distillation directe dans ces conditions. La distillation du point E peut ensuite être poursuivie pour obtenir le corps X pur.
Dans cet exemple, la première distillation est effectuée dans une colonne à basse pression alimentée par le mélange liquide A. En pied de la colonne 1 sort le produit Y plus ou moins pur (produit A sur la figure 16). L'azéotrope basse pression sort en tête de la colonne 1, il est alimenté dans une deuxième colonne à pression plus élevée . En pied de la colonne 2 sort le produit X plus ou moins pur (produit B sur la figure 16). L'azéotrope haute pression sort en tête de la colonne 2 et est réalimenté à la colonne 1[20]. Si les azéotropes sont négatifs (à maximum de température), les azéotropes sont obtenus en pied et les corps purs en tête des colonnes[20].
Un important écart de pression est souvent nécessaire pour obtenir un décalage significatif de l'azéotrope, ce qui peut rendre cette technique inexploitable en pratique.
Distillation au tiers-corps
modifierLa distillation au tiers corps consiste à introduire lors de la distillation d'un mélange azéotropique binaire des corps et un troisième corps appelé entraineur, le corps . Ce tiers-corps modifie les interactions du mélange initial et amplifie la différence de volatilité entre et . Il permet ainsi de « casser » ou « rompre » l'azéotrope, c'est-à-dire de le faire disparaitre[26]. L'entraineur peut lui-même produire un azéotrope homogène ou hétérogène avec ou , ou avec chacun des deux, voire former un azéotrope ternaire avec eux[20].
Deux techniques sont utilisées : la « distillation azéotropique » consiste à introduire le tiers corps avec l'alimentation de la colonne et la « distillation extractive » consiste à introduire l'entraineur sur un étage différent de l'alimentation[13]. Dans tous les cas, une deuxième distillation est ensuite nécessaire pour extraire l'entraineur du produit voulu. Par exemple, le benzène et le toluène sont utilisés dans la distillation du mélange eau-éthanol pour obtenir l'éthanol pur (éthanol absolu). L'eau est utilisée comme entraineur de la distillation du mélange acétone-méthanol[13].
Liste de mélanges azéotropes
modifierNotes et références
modifierNotes
modifier- Académie nationale de Pharmacie, « Azéotrope », sur dictionnaire.acadpharm.org, (consulté le ).
- Rode 2012, p. 37.
- « azéotrope », dictionnaire Larousse.
- « zéotrope », dictionnaire Larousse.
- Gerbaud et al. 2015a, p. 6.
- Gerbaud et al. 2015a, p. 6;8.
- Rode 2012, p. 38.
- Gerbaud et al. 2015a, p. 8.
- Rode 2012, p. 42.
- Fauduet 2019, p. 84.
- Fauduet 2019, p. 86.
- Fauduet 2019, p. 88.
- Gerbaud et al. 2015a, p. 9.
- King et al. 2013, p. 374.
- (en) Ulrich K. Deiters et Thomas Kraska, High-Pressure Fluid Phase Equilibria : Phenomenology and Computation, Amsterdam/Boston, Elsevier, coll. « Supercritical Fluid Science and Technology », , 342 p. (ISBN 978-0-444-56347-7, ISSN 2212-0505, lire en ligne), p. 31.
- Rode 2012, p. 40-41.
- Fauduet 2019, p. 97.
- King et al. 2013, p. 373-374.
- King et al. 2013, p. 376.
- Gerbaud et al. 2015b, p. 3.
- Bruno Fosset, Jean-Bernard Baudin, Frédéric Lahitète et Valéry Prévost, Chimie tout-en-un PSI-PSI* : Le cours de référence, Dunod, , 3e éd., 400 p. (ISBN 978-2-10-077191-2, lire en ligne), p. 250-251.
- King et al. 2013, p. 374-375.
- (en) N.P. Komninos et E.D. Rogdakis, « Geometrical investigation and classification of three-suffix margules binary mixtures including single and double azeotropy », Fluid Phase Equilibria, vol. 494, , p. 212-227 (DOI 10.1016/j.fluid.2019.04.017, lire en ligne).
- (en) Jean-Charles de Hemptinne et Jean-Marie Ledanois, Select Thermodynamic Models for Process Simulation : A Practical Guide Using a Three Steps Methodology, Éditions TECHNIP, coll. « IFP Énergies Nouvelles Publications - Institut français du pétrole publications - Publications (IFP Énergies nouvelles) », , 380 p. (lire en ligne), p. 169-170. Exercice p. 169-170 développé sur le site (en) Jean-Charles de Hemptinne et Jean-Marie Ledanois, IFP Énergies Nouvelles, « Example 3-13: Draw the isothermal phase diagram of the binary mixture of water and butanol at 373.15 K » (consulté le ).
- Gerbaud et al. 2015a, p. 3-4.
- Gerbaud et al. 2015b, p. 15.
Références
modifier- Henri Fauduet, Opérations unitaires de séparations avec équilibre entre phases fluides en chimie : Génie des procédés, Éditions Ellipses, coll. « Formations & Techniques », , 888 p. (ISBN 9782340091597, lire en ligne), p. 84-89.
- Sabine Rode, Séparations thermiques en génie des procédés : Distillation, air humide, séchage, Éditions Ellipses, , 480 p. (ISBN 9782340059221, lire en ligne).
- Vincent Gerbaud et Ivonne Rodriguez-Donis, Distillation de mélanges non idéaux : Courbes de résidu et autres outils de conception, vol. J 2 611, Éditions Techniques de l'Ingénieur, coll. « Procédés chimie - bio - agro », 2015a (lire en ligne).
- Vincent Gerbaud et Ivonne Rodriguez-Donis, Distillation de mélanges non idéaux : Distillation azéotropique et distillation extractive. Choix de l'entraîneur, vol. J 2 612, Éditions Techniques de l'Ingénieur, coll. « Procédés chimie - bio - agro », 2015b (lire en ligne).
- (en) M. B. King et P. V. Danckwerts, Phase Equilibrium in Mixtures : International Series of Monographs in Chemical Engineering, vol. 9, Elsevier, , 304 p. (ISBN 978-1-4831-5241-7, lire en ligne).
Voir aussi
modifierLiens externes
modifier- (en) Jack Ponton, université d'Édimbourg, « Easy Access Data Source For Homogeneous Azeotropes », sur homepages.ed.ac.uk, (consulté le ).

















![Figure 6 - Double azéotrope. Système benzène-hexafluorobenzène[15].](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b3/Benzene%2BHexafluorobenzene_%28Double_Azeotrope%29.png/600px-Benzene%2BHexafluorobenzene_%28Double_Azeotrope%29.png)