Baricitinib
Le baricitinib est une molécule inhibitrice des Janus kinases 1 et 2, deux tyrosine kinases, utilisé dans certains cas de polyarthrite rhumatoïde. Il est commercialisé par le laboratoire Lilly sous forme de comprimés dosés à 2 mg [2] et 4 mg [3].
| Baricitinib | |
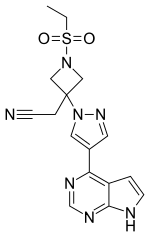
| |
| Structure du baricitinib | |
| Identification | |
|---|---|
| Nom systématique | 2-[1-éthylsulfonyl-3-[4-(7H-pyrrolo[2,3-d]pyrimidin-4-yl)pyrazol-1-yl]azétidin-3-yl]acétonitrile |
| No CAS | |
| No ECHA | 100.219.080 |
| No CE | 691-421-4 |
| Code ATC | |
| DrugBank | 11817 |
| PubChem | 44205240 |
| ChEBI | 95341 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C16H17N7O2S |
| Masse molaire[1] | 371,417 ± 0,021 g/mol C 51,74 %, H 4,61 %, N 26,4 %, O 8,62 %, S 8,63 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Efficacité
modifierIl a une certaine efficacité sur les symptômes de la polyarthrite rhumatoïde lorsqu'elle est résistante au méthotrexate[4]ou à d'autres molécules[5].
En cours de test
modifierEn tant qu'anti-interféron, le tofacitinib a aussi montré ou a été proposé pour diverses autres pathologies :
- Maladies auto-immunes ;
- Maladies inflammatoires[6],[7] ;
- Lupus érythémateux disséminé[8] ;
- dans certaines formes d'alopécie (« alopecia aerata »)[9] ;
- COVID-19 due au virus SARS-CoV-2 (voir ci-dessous)
Intérêt du Baricitinib dans la lutte contre la COVID-19 ?
modifierDes chercheurs ont analysé un grand référentiel de données et d'information médicale structurées (dont par la littérature scientifique et un logiciel d'apprentissage automatique destiné à la conception de nouveaux médicaments)[10], avec l'aide d'une intelligence artificielle. À la suite de ce travail ils ont récemment (février 2020) proposé[11] le Baricitinib pour le traitement médicamenteux des cas de COVID-19 nécessitant hospitalisation.
Cette proposition est motivée par le fait que cette molécule peut inhiber des enzymes kinases en atténuant l'infectiosité du virus (en l'empêchant d'entrer dans les cellules via l'inhibition de l'endocytose médiée par la clathrine) et par le fait qu'elle peut empêcher une inflammation excessive dans la réponse au virus[12].
L'intérêt de cette proposition a immédiatement été discuté, car le baricitinib est un inhibiteur JAK1 et JAK2 ; il feinte donc la production d'interférons. Or la COVID-19 est une maladie virale, et les antiviraux naturels de l'organisme sont justement des interférons, en grande partie médiés par la voie de signalisation JAK-STAT, ce qui donne à cette stratégie une apparence paradoxale.
Les partisans du baricitinib répondent à cela que pour les 80% des patients éliminent naturellement et spontanément le virus (probablement en grande partie grâce aux interférons), il n'est pas question de recommander le baricitinib (ni aucun autre inhibiteur de JAK).
Mais ils rappellent que pour les patients hospitalisés pour des formes modérées à graves de la maladie, en réalité « l'administration d'interféron pégylé n'a pas eu les effets antiviraux bénéfiques attendus[13] et que les essais cliniques faits avec les interférons ont donné des résultats incohérents ; des effets pathogènes des interférons étant même observés dans certaines infections virales »[12].
Chez ces patients, la charge maximale de SARS-CoV-2 apparait dans la semaine qui suit les premiers symptômes. Puis le titre viral diminue chez certains de ces malades, avec alors une hyper-inflammation qui dégrade sévèrement leur état (tempête de cytokines)[14]. Or cette étape critique s'accompagne toujours d'un niveau très anormalement élevé de signalisation ; avec notamment une hausse des interféron α et β et d'IL-6, qui tous, signalent par la voie JAK-STAT. En 2007, Cameron et al. avaient noté[15] que, curieusement, les malades du SRAS ayant quitté l'hôpital avaient paradoxalement une activité de signalisation d'interféron α et d'interféron γ faible, alors que qui sont morts d'hypoxémie avaient au moment de leur mort au contraire une signalisation α et l'interféron γ élevée.
Par ailleurs, le modèle animal conçu pour étudier le SRAS et le MERS a aussi montré que si l'action des interféron α et β étaient bénéfique au début de la maladie, elle devenait pathogène en se retournant contre l'organisme aux stades ultérieurs[13]. Ceci laisse penser que chez les patients infectés par le SARS-CoV-2 et nécessitant hospitalisation, inhiber la voie JAK-STAT, c'est-à-dire inhiber la production de cytokines, est peut-être une stratégie pertinente.
Un risque serait que faute d'interféron des maladies latentes puissent se réveiller lors du traitement. Mais selon Peter J Richardson (de Benevolent AI), Mario Corbellino (infectiologue italien) et Justin Stebbing (de l'Imperial College London, rédacteur en chef d'Oncogene, administrateur de BB Biotech Healthcare Trust et président de Xerion Healthcare), le baricitinib ne serait dans ce cadre utilisé que pour 7 à 14 jours, ce qui ne suffirait pas à réactiver des infections latentes telles que l'herpès ou la tuberculose.
Richardson et ses deux collègues ajoutent qu'il pourrait exister plusieurs schéma de progression de la COVID-19. Si c'est le cas, il faut alors produire les modèles de stratification et de pronostic adéquats et identifier par des biomarqueurs (encore à préciser) le moment optimal pour administrer le baricitinib comme inhibiteurs de cytokines[14]. Des études prospectives en cours en 2020 (par exemple, NCT04320277 et NCT04321993) incluant le baricitinib parmi d'autres essais de traitement de la COVID-19 devraient apporter des données, toujours à interpréter avec prudence. Ils suggèrent aussi qu'administrer systémiquement des interférons α et β aux patients hospitalisé pourrait être contre-productif, ce qui serait en accord avec des études antérieures où les interférons ont donné des résultats incohérents : nécessaires au début de la maladie, ils pourraient fortement précipiter la maladie ensuite. Ils s'inquiètent du fait que l'essai multi-pays OMS SOLIDARITY (NCT04321616) inclue la prescription d'interféron β ; ils promeuvent des essais contrôlés randomisés.
En novembre 2020, des chercheurs de l'Institut suédois Karolinska publient les résultats de leurs essais cliniques randomisés en cours dans la revue Science Advances:
"Nous sommes heureux d'annoncer une réduction de 71% de la mortalité pour le groupe recevant du baricitinib en plus des soins standard"[16].
Effets secondaires
modifierIl existe un risque de survenue d'infections et de cancers (lymphomes) ou de thromboses[17].
Voir aussi
modifierLe filgotinib et le tofacitinib sont deux autres inhibiteurs des Janus kinases.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Autorisation - Minigraphie », sur sante.fr (consulté le ).
- « Autorisation - Minigraphie », sur sante.fr (consulté le ).
- (en) Keystone EC, Taylor PC, Drescher E et al. « Safety and efficacy of baricitinib at 24weeks in patients with rheumatoid arthritis who have had an inadequate response to methotrexate » Ann Rheum Dis. 2015;74:333-340
- (en) Genovese MC, Kremer J, Zamani O et al. « Baricitinib in patients with refractory rheumatoid arthritis » N Engl J Med. 2016;374:1243-1252
- Yvan Jamilloux, Thomas El Jammal, Lucine Vuitton et Mathieu Gerfaud-Valentin, « JAK inhibitors for the treatment of autoimmune and inflammatory diseases », Autoimmunity Reviews, vol. 18, no 11, , p. 102390 (ISSN 1873-0183, PMID 31520803, DOI 10.1016/j.autrev.2019.102390, lire en ligne, consulté le )
- Thomas Bieber, Kristian Reich, Carle Paul et Yuichiro Tsunemi, « Efficacy and safety of baricitinib in combination with topical corticosteroids in patients with moderate-to-severe atopic dermatitis with inadequate response, intolerance or contraindication to ciclosporin: results from a randomized, placebo-controlled, phase III clinical trial (BREEZE-AD4) », The British Journal of Dermatology, vol. 187, no 3, , p. 338–352 (ISSN 1365-2133, PMID 35484697, DOI 10.1111/bjd.21630, lire en ligne, consulté le )
- Thomas Dörner, Ronald F. van Vollenhoven, Andrea Doria et Bochao Jia, « Baricitinib decreases anti-dsDNA in patients with systemic lupus erythematosus: results from a phase II double-blind, randomized, placebo-controlled trial », Arthritis Research & Therapy, vol. 24, no 1, , p. 112 (ISSN 1478-6362, PMID 35578304, PMCID 9109322, DOI 10.1186/s13075-022-02794-x, lire en ligne, consulté le )
- King B, Ohyama M, Kwon O et al. Two phase 3 trials of baricitinib for alopecia areata, N Engl J Med, 2022;386:1687-1699
- (en) Marwin H. S. Segler, Mike Preuss et Mark P. Waller, « Planning chemical syntheses with deep neural networks and symbolic AI », Nature, vol. 555, no 7698, , p. 604–610 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature25978, lire en ligne, consulté le )
- Peter Richardson, Ivan Griffin, Catherine Tucker et Dan Smith, « Baricitinib as potential treatment for 2019-nCoV acute respiratory disease », The Lancet, vol. 395, no 10223, , e30–e31 (ISSN 0140-6736, DOI 10.1016/s0140-6736(20)30304-4, lire en ligne, consulté le )
- (en) Peter J Richardson, Mario Corbellino et Justin Stebbing, « Baricitinib for COVID-19: a suitable treatment? – Authors' reply », The Lancet Infectious Diseases, , S147330992030270X (DOI 10.1016/S1473-3099(20)30270-X, lire en ligne, consulté le )
- (en) Puja Mehta, Daniel F McAuley, Michael Brown et Emilie Sanchez, « COVID-19: consider cytokine storm syndromes and immunosuppression », The Lancet, vol. 395, no 10229, , p. 1033–1034 (DOI 10.1016/S0140-6736(20)30628-0, lire en ligne, consulté le )
- (en) M. J. Cameron, L. Ran, L. Xu et A. Danesh, « Interferon-Mediated Immunopathological Events Are Associated with Atypical Innate and Adaptive Immune Responses in Patients with Severe Acute Respiratory Syndrome », Journal of Virology, vol. 81, no 16, , p. 8692–8706 (ISSN 0022-538X, PMID 17537853, PMCID PMC1951379, DOI 10.1128/JVI.00527-07, lire en ligne, consulté le )
- « Covid-19 : un médicament contre la polyarthrite rhumatoïde réduirait les risques de décès de 71 % », sur Medisite (consulté le ).
- Food and Drug Administration. [ https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/207924s000lbl.pdf Olumiant (baricitinib)]