Tofacitinib
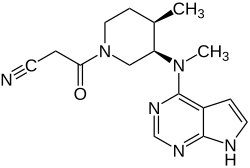
Le tofacitinib ou CP-690550 est une molécule développée comme médicament, inhibiteur des janus kinases (JAK) 1 et 3 (un type de tyrosine kinase). Il est commercialisé par le laboratoire Pfizer sous forme de comprimés dénommés XELJANZ dosés à 5 [3] et 10 mg [4] et sous forme de comprimés à libération prolongée dosée à 11 mg [5].
| Tofacitinib | |
| |
| Identification | |
|---|---|
| Nom UICPA | 3-[(3R,4R)-4-méthyl-3-[methyl(7H-pyrrolo[2,3-d]pyrimidin-4-yl)amino]pipéridin-1-yl]-3-oxopropanenitrile |
| Synonymes |
CP-690550 |
| No CAS | |
| No ECHA | 100.215.928 |
| Code ATC | |
| DrugBank | DB08895 |
| PubChem | 9926791 |
| ChEBI | 71200 |
| SMILES | |
| InChI | |
| Apparence | mousse jaune[1] |
| Propriétés chimiques | |
| Formule | C16H20N6O |
| Masse molaire[2] | 312,369 6 ± 0,015 7 g/mol C 61,52 %, H 6,45 %, N 26,9 %, O 5,12 %, |
| pKa | pKa1 = 8,46 (cyano); pKa2 = 13,56 (amine secondaire)[1] |
| Propriétés optiques | |
| Pouvoir rotatoire | +10.4 deg (cc = 0,64 in méthanol)[1] |
| Précautions | |
| SGH[1] | |
| H301, H302, H311, H315, H319, H331, H335, H360, P201, P202, P261, P264, P270, P271, P280, P281, P311, P312, P321, P322, P330, P301+P310, P301+P312, P302+P352, P304+P340, P305+P351+P338 et P308+P313 |
|
| Écotoxicologie | |
| LogP | (octanol/eau) 1,808[1] |
| Données pharmacocinétiques | |
| Biodisponibilité | 74 %[1] |
| Liaison protéique | 40 %[1] |
| Métabolisme | Foie (via CYP3A4 (majeur) et CYP2C19 (mineur))[1] |
| Demi-vie d’élim. | 3 h[1] |
| Excrétion | |
| Considérations thérapeutiques | |
| Voie d’administration | Orale[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Pharmacologie
modifierIl est administré par voie orale.
Mécanisme d'action
modifierIl a été testé au début chez l'animal pour la prévention du rejet de greffe par son effet anti JAK3[6]. Il s'est révélé par la suite également anti-JAK1, respectant relativement le JAK 2[7]. Les janus kinases interviennent dans les syndromes inflammatoires par l'intermédiaire de la production de multiples cytokines, dont plusieurs interleukines. L'inhibition des janus kinases entraîne donc des modifications de la réponse inflammatoire et immunologique[8]. Le tofacitinib réduit, en particulier, la sécrétion de cytokines induite par le TNF[9].
Intérêts potentiels
modifierChez l'animal, il diminue le risque de rejet lors d'une greffe d'organe[6].
Dans la polyarthrite rhumatoïde, il améliore les symptômes à court terme[10] (six mois) avec une efficacité semblant équivalente à celle de l'adalimumab[11] et supérieure à celle du méthotrexate[12]. Il est efficace en particulier dans les formes résistantes à ce dernier[13]. Les résultats à plus long terme, notamment sur les destructions articulaires, ne sont pas connues chez l'homme mais la molécule semble diminuer ces dernières dans un modèle animal[14].
Dans la rectocolite hémorragique, il améliore également les symptômes à court terme[15]. Il permet des rémissions pouvant dépasser un an dans un tiers des cas[16].
Dans le psoriasis, il diminuerait, à court terme, les lésions cutanées[17] et serait aussi efficace que l'étanercept[18]. Il est également actif dans le rhumatisme psoriasique, de manière comparable à l'adalimumab[19], et ce, dans les formes résistantes aux inhibiteurs du TNF[20].
Le tofacitinib a aussi montré un intérêt dans diverses autres maladies auto-immunes ou inflammatoires[21]. Il semble améliorer le pronostice des formes graves de la COVID-19[22].
Effets secondaires
modifierLes effets secondaires les plus importants sont les infections[10],[11], la diarrhée[10], les céphalées[10]. Il peut exister des perturbations du bilan hépatique, une augmentation du LDL cholestérol[10], avec un risque augmenté de survenue de maladies cardiovasculaires [23].
Le risque de survenue d'un cancer semble être majoré[12],[23].
Indication
modifierL'indication sur la polyarthrite rhumatoïde, résistante ou intolérante au méthotrexate a été acceptée par la FDA américaine, fin 2012[24].
Le , le tofacitinib (nom commercial : Xeljanz) obtient une nouvelle autorisation de mise sur le marché européenne en association au méthotrexate dans le traitement du rhumatisme psoriasique actif chez les patients adultes ayant présenté une réponse inadéquate ou une intolérance à un traitement de fond antirhumatismal (DMARD (en)) antérieur[25].
Depuis juin 2021, le tofacitinib est disponible comme médicament générique aux USA [26].
Voir aussi
modifierLe filgotinib et le baricitinib sont deux autres inhibiteurs des janus kinases.
Notes et références
modifier- PubChem CID 9926791.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Autorisation - Minigraphie », sur sante.fr (consulté le ).
- « Autorisation - Minigraphie », sur sante.fr (consulté le ).
- « Autorisation - Minigraphie », sur sante.fr (consulté le ).
- Changelian PS, Flanagan ME, Ball DJ et al. Prevention of organ allograft rejection by a specific Janus kinase 3 inhibitor, Science, 2003;302:875-878
- Fox DA, Kinase inhibition — A new approach to the treatment of rheumatoid arthritis, N Engl J Med, 2012;367:565-567
- Meyer DM, Jesson MI, Li X et al. Anti-inflammatory activity and neutrophil reductions mediated by the JAK1/JAK3 inhibitor, CP-690,550, in rat adjuvant-induced arthritis, J Inflamm (Lond), 2010;7:41-41
- Rosengren S, Corr M, Firestein GS, Boyle DL, The JAK inhibitor CP-690,550 (tofacitinib) inhibits TNF-induced chemokine expression in fibroblast-like synoviocytes: autocrine role of type I interferon, Ann Rheum Dis, 2012; 71: 440-447
- Fleischmann R, Kremer J, Cush J et al. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis, N Engl J Med, 2012;367:495-507
- van Vollenhoven RF, Fleischmann R, Cohen S et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis, N Engl J Med, 2012;367:508-519
- Lee EB, Fleischmann R, Hall S et al. Tofacitinib versus Methotrexate in rheumatoid arthritis, N Engl J Med, 2014;370:2377-2386
- Burmester GR, Blanco R, Charles-Schoeman C et al. Tofacitinib (CP-690550) in combination with methotrexate in patients with active rheumatoid arthrtis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet, 2013;381:451-460
- Milici AJ, Kudlacz EM, Audoly L, Zwillich S, Changelian P, Cartilage preservation by inhibition of Janus kinase 3 in two rodent models of rheumatoid arthritis, Arthritis Res Ther, 2008;10:R14
- Sandborn WJ, Ghosh S, Panes J et al. Tofacitinib, an oral janus kinase inhibitor, in active ulcerative colitis, N Engl J Med, 2012;367:616-624
- Sandborn WJ, Su C, Sands BE et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis, N Engl J Med, 2017;376:1723-1736
- Boy MG, Wang C, Wilkinson BE et al. Double-blind, placebo-controlled, dose-escalation study to evaluate the pharmacologic effect of CP-690,550 in patients with psoriasis, J Invest Dermatol, 2009;129:2299-2302
- Bachelez H, van de Kerkhof PCM, Strohal R et al. Tofacitinib versus etanercept or placebo in moderate-to-severe chronic plaque psoriasis: a phase 3 randomised non-inferiority trial, Lancet, 2015;386,552–561
- Mease P, Hall S, FitzGerald O et al. Tofacitinib or adalimumab versus placebo for psoriatic arthritis, N Engl J Med, 2017;377:1537-1550
- Gladman D, Rigby W, Azevedo VF et al. Tofacitinib for psoriatic arthritis in patients with an inadequate response to TNF inhibitors, N Engl J Med, 2017;377:1525-1536
- Yvan Jamilloux, Thomas El Jammal, Lucine Vuitton et Mathieu Gerfaud-Valentin, « JAK inhibitors for the treatment of autoimmune and inflammatory diseases », Autoimmunity Reviews, vol. 18, no 11, , p. 102390 (ISSN 1873-0183, PMID 31520803, DOI 10.1016/j.autrev.2019.102390, lire en ligne, consulté le )
- Guimarães PO, Quirk D, Furtado RH et al. Tofacitinib in patients hospitalized with Covid-19 pneumonia, N Engl J Med, 2021;385:406-415
- Ytterberg SR, Bhatt DL, Mikuls TR et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis, N Engl J Med, 2022;386:316-326
- Food and Drug Administration, FDA approves Xeljanz for rheumatoid arthritis, 6 novembre 2012
- (en) « Xeljanz-H-C-4214-X-0005 : EPAR - Assessment Report - Variation »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur ema.europa.eu, European Medicines Agency, (consulté le ).
- (en) « Tofacitinib citrate: FDA-Approved Drugs », sur FDA, (consulté le ).



