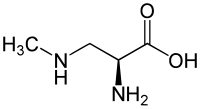
β-N-Méthylamino-L-alanine
La β-N-méthylamino-L-alanine (ou BMAA) est un acide aminé non-protéique, neurotoxique, relativement stable, produit par des cyanobactéries, dont certains nostocs. Elle est également trouvée dans le cerveau de patients morts de certains types de dégénérescence du système nerveux central.
| β-N-Méthylamino-L-alanine | |
| |
| Identification | |
|---|---|
| Nom UICPA | acide (S)-2-amino-3-méthylaminopropanoïque |
| No CAS | |
| PubChem | 105089 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H10N2O2 [Isomères] |
| Masse molaire[1] | 118,134 4 ± 0,004 9 g/mol C 40,67 %, H 8,53 %, N 23,71 %, O 27,09 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
On a montré dans l'île de Guam que la BMAA peut être dans la nature fortement accumulée dans certaines parties de végétaux (nodules racinaires, fruits, graines) ayant établi une symbiose racinaire avec des cyanophycées, puis dans les animaux (dont l'homme) qui consomment ces végétaux.
Toxicologie
modifierLa BMAA est une neurotoxine inhabituelle[2], qui combine plusieurs effets toxiques[3]. En tant qu'acide aminé non protéique, elle développe :
- des effets toxiques sur les neurones moteurs, notamment dans la zone de la substantia nigra[4] ;
- une action agoniste sur les récepteurs NMDA et AMPA[5] ;
- un stress oxydatif[5] ;
- un épuisement du glutathion[5] ;
- et peut-être — c'est une hypothèse à confirmer — un mauvais repliement des protéines intraneuronales, ce qui est l'une des sources connues de la neurodégénérescence.
S'il n'y a pas de modèle animal pour étudier une SLA induite par la BMAA, il existe maintenant des preuves substantielles évoquant sérieusement un lien de causalité entre cette toxine bactérienne et la SLA[6].
L'ingestion de BMAA est un facteur possible de démence parkinsonnienne liée à une sclérose latérale amyotrophique : le syndrome de Guam, syndrome atypique uniquement découvert sur l'île de Guam, et resté mal compris durant toute la seconde moitié du XXe siècle. De plus, le suivi des cas survenus chez des patients ayant depuis longtemps quitté l'île de Guam montrent que jusqu'à une trentaine d'années peuvent s'écouler (et peut-être plus) entre le contact avec la toxine, et la déclaration de la maladie[7].
La toxicité de cette molécule a aussi été étudiée in vitro sur des cultures de neurones corticaux[8].
Écotoxicologie
modifierComme cela est le cas pour beaucoup de toxines bactériennes, il est probable que la BMAA joue un rôle protecteur pour les bactéries qui le produisent, voire pour des espèces (arbres, champignons…) qui développent une symbiose avec ces bactéries.
Les conséquences écotoxicologiques de cette molécule proche de l'alanine (abréviation : Ala ou A) sont complexes, et encore mal comprises. Elles font l'objet d'études, notamment concernant sa biomagnification qui semble avérée dans certains contextes et qui pourrait avoir ailleurs été sous-estimée. Certaines espèces animales semblent relativement immunisées (la roussette de l'île de Guam par exemple), mais elles peuvent fortement la bioconcentrer et alors la transmettre dans la chaine alimentaire, dont à l'homme, via la consommation de gibier pour les populations qui chassent ces animaux. C'est ce qui a été démontré sur l'île de Guam (voir plus bas).
Enjeux sanitaires et écologiques
modifierComme les pullulations de cyanophycées sont de plus en plus fréquentes en eau douce de surface, dont les lacs ou réservoirs de barrages utilisés pour produire de l'eau potable, la confirmation de l’hypothèse qu'il s'agit d'un « déclencheur environnemental bactérien » pour la SLA ou d'autres maladies neurodégénératives pourrait avoir d'énormes conséquences en matière de sécurité sanitaire[6].
Le syndrome de l'île de Guam
modifierIl tire son nom[9] du fait qu'au milieu du XXe siècle, les médecins et épidémiologistes américains ont constaté sur cette île, au sein de la population autochtone Chamorro[10], une incidence anormalement élevée (50 à 100 fois plus que la normale) d'un syndrome, très intrigant et préoccupant pour les épidémiologistes, évoquant des maladies neurodégénératives connues, mais avec des cas sporadiques parmi les jeunes (comme pour les maladies à prion). Il mêle les symptômes d'une sclérose latérale amyotrophique à ceux d'une démence parkinsonienne, constituant une maladie neurodégénérative[11].
Des chercheurs ont ensuite découvert que de grandes quantités de BMAA étaient présentes dans les graines et fruits d'un arbre local, le Cyca (Cycas micronesica)[10], une sorte de palmier autrefois très présent sur l'île. Il a ensuite été démontré que cette BMAA était en réalité produite par des milliers de petites colonies de cyanobactéries symbiotiques abritées sous la terre, à l'intérieur de nodules formés par les Cycas dans des racines spécialisées (dites « racines coralloïdes »[10],[12]. Sous forme libre dans la nature, la bactérie ne contient que 0,3 μg·g-1 de BMAA, mais quand elle vit en symbiose avec son arbre (Cicas), elle en produit jusqu'à 120 fois plus (2 à 37 μg·g-1)[13]. Cette BMAA est transportée par la sève vers les branches, puis retrouvée particulièrement concentrée dans les tissus reproducteurs de l'arbre (9 μg/g en moyenne dans la partie charnue du sarcotest et plus de 100 fois plus, 1 161 μg g−1 en moyenne, dans l'enveloppe périphérique de la graine)[13]. Cette BMAA est aussi trouvée sous forme bioassimilable dans le fruit et la graine[10], mais en petite quantité sous forme libre. C'est sous forme liée à des protéines qu'elle est surtout présente, jusqu'à une centaine de fois plus concentrée, alors bioassimilable[13]. Des chercheurs avaient suggéré un lien entre cette BMAA et l'étrange syndrome de Guam, mais on leur a rétorqué qu'il faudrait ingérer des tonnes de farines de graines ou de fruits de cet arbre pour accumuler la quantité de BMAA trouvée dans le cerveau de certains malades. Les recherches ont été interrompues durant une trentaine d'années et orientées vers d'autres explications dont aucune n'a été convaincante. De plus, ce syndrome se développe généralement plusieurs dizaines d'années environ après le début de l'intoxication[11], ce qui ne facilite pas le suivi épidémiologique.
Plusieurs décennies après, on a remarqué que plusieurs espèces d'animaux mangés par l'homme se nourrissaient du fruit et de la graine de cet arbre : c'est le cas des roussettes (Pteropus mariannus), des cochons et des cervidés. Par des mesures de leur teneur en BMAA, on a alors rapidement constaté que ces animaux participent à une rapide bioamplification de la neurotoxine dans le réseau trophique local (jusqu'à l'homme, qui est situé au bout de la chaîne alimentaire[13]). Ainsi les roussettes consommant graines et fruits du Cyca bioaccumulent à leur tour la BMAA (3 556 μg·g-1 en moyenne). Et elles sont très prisées du peuple autochtone Chamorro qui les chassent et les mangent bouillies dans une crème de coco. On a ensuite constaté que la BMAA est une toxine très stable, assez pour qu'on la retrouve en quantité élevée dans les roussettes de Guam conservées dans les musées[14]. La consommation d'une seule roussette apporte une dose équivalente de BMAA qu'en mangeant de 174 à 1 014 kg de farine de cycas[14]. À cause des festins traditionnels de renards volants (autre nom de cette roussette), les Chamorros meurent bien plus nombreux que la moyenne des humains du syndrome de Guam ; cette BMAA (liée à des protéines) a en effet aussi été retrouvée dans le cerveau des morts de ces maladies dégénératives sur l'île (à des concentrations moyenne de 627 μg·g-1, 5mM) alors qu'on ne l'a pas trouvée dans les cerveaux de cas témoins, ni dans le cerveau de patients morts de maladie de Huntington[10].
Ces découvertes ont ravivé l'intérêt pour l'hypothèse que la BMAA pourrait être déclencheur d'autres maladies neurodégénératives, d'autant qu'elle a aussi été trouvée (à des taux moyens de 95 μg·g-1, 0,8mM) dans le cerveau d'individus nord-américains morts de maladie d'Alzheimer, ce qui renforce l'hypothèse d'un rôle étiologique possible de la BMAA dans le cas de maladies neurodégénératives ailleurs que sur l'île[10],[13] (et une étude encore contestée laisse penser que d'autres plantes ou animaux pourraient concentrer la BMAA[11]). Les cyanobactéries sont abondantes dans le monde entier. De plus, les pullulations de cyanophycées dans des réservoirs superficiels d'eau potable sont de plus en plus fréquentes (en raison de déséquilibres écologiques encore mal compris, mais semblant impliquer l'eutrophisation des eaux de surface)[10]. Dans les années 2000, l'hypothèse de facteurs environnementaux jouant un rôle majeur dans le développement de maladies neurodégénératives gagne du terrain. En particulier, certaines souches de cyanobactéries sont potentiellement (et de manière avérée à Guam) source de BMAA environnementale susceptible d'être transportée dans les eaux potables, ou bioconcentrée, puis impliquée dans la maladie d'Alzheimer, la SLA (sclérose latérale amyotrophique)[6] ou la maladie de Parkinson[15] chez les individus qui auraient une prédisposition génétique à l'incapacité à prévenir l'accumulation de protéines liées à la BMAA dans le cerveau, hypothèse avancée par certains auteurs[10],[16] mais qui est encore à confirmer (par exemple par tracage isotopique et/ou par des études épidémiologiques (et écoépidémiologiques) solides.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Vyas KJ, Weiss JH. « BMAA--an unusual cyanobacterial neurotoxin » Amyotroph Lateral Scler. 2009; 10 Suppl 2:50-5.
- (en) Lobner D, Piana PM, Salous AK, Peoples RW. « Beta-N-methylamino-L-alanine enhances neurotoxicity through multiple mechanisms » Neurobiol Dis. 2007 Feb; 25(2):360-6. Epub 2006 Nov 13 (Résumé).
- (en) Cucchiaroni ML, Viscomi MT, Bernardi G, Molinari M, Guatteo E, Mercuri NB. « Metabotropic glutamate receptor 1 mediates the electrophysiological and toxic actions of the cycad derivative beta-N-Methylamino-L-alanine on substantia nigra pars compacta' DAergic neurons » J Neurosci. 2010 Apr 14; 30(15):5176-88.
- (en) Liu X, Rush T, Zapata J, Lobner D. « beta-N-methylamino-l-alanine induces oxidative stress and glutamate release through action on system Xc(-) » Exp Neurol. 2009 Jun;217(2):429-33. Epub 2009 Apr 15 (Résumé).
- (en) Banack SA, Caller TA, Stommel EW. « The cyanobacteria derived toxin Beta-N-methylamino-L-alanine and amyotrophic lateral sclerosis » Toxins (Basel). 2010 Dec;2(12):2837-50. Epub 2010 Dec 20 (Résumé)
- (en) Garruto RM, Gajdusek DC. & Chen K-M. « Amyotrophic lateral sclerosis among chamorro migrants from Guam » Ann Neurol., 1980;8: 612-9. DOI 10.1002/ana.410080612 (Résumé)
- (en) Weiss JH, Koh JY, Choi DW. « Neurotoxicity of beta-N-methylamino-L-alanine (BMAA) and beta-N-oxalylamino-L-alanine (BOAA) on cultured cortical neurons » Brain Res. 1989 Sep 11; 497(1):64-71. (résumé)
- Syndrome dit « Syndrome de Guam » ou Lytico-bodig disease pour les anglophones, ou encore AL-SPDC pour Amyotrophic lateral sclerosis/parkinsonism-dementia complex. (en) Voir l'article en anglais.
- (en) Bradley WG, Mash DC. « Beyond Guam: the cyanobacteria/BMAA hypothesis of the cause of ALS and other neurodegenerative diseases » Amyotroph Lateral Scler. 2009; 10 Suppl 2:7-20. (résumé)
- (en) Karamyan VT, Speth RC. « Animal models of BMAA neurotoxicity: a critical review » Life Sci. 2008 Jan 30;82(5-6):233-46. Epub 2007 Dec 7. (résumé)
- Photos de l'arbre, des nodules, des fruits mangés par une roussette
- (en) Cox PA, Banack SA, Murch SJ. « Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam » Proc Natl Acad Sci U S A. 2003 Nov 11; 100(23):13380-3. (Résumé)
- (en) Banack SA, Cox PA. « Biomagnification of cycad neurotoxins in flying foxes: implications for ALS-PDC in Guam » Neurology. 2003 Aug 12;61(3):387-9. (résumé)
- (en) Salama M, Arias-Carrión O. « Natural toxins implicated in the development of Parkinson's disease » Ther Adv Neurol Disord. 2011 Nov; 4(6):361-73.
- (en) Ince PG, Codd GA. « Return of the cycad hypothesis - does the amyotrophic lateral sclerosis/parkinsonism dementia complex (ALS/PDC) of Guam have new implications for global health ? » Neuropathol Appl Neurobiol. 2005 Aug; 31(4):345-53. (Résumé)