Thiane
Le thiane ou tétrahydrothiine (ou encore tétrahydrothiopyrane) est un composé hétérocyclique saturé de formule brute C5H10S .
| Thiane | |

| |
| Structure du thiane | |
| Identification | |
|---|---|
| Synonymes |
thiocyclohexane |
| No CAS | |
| No ECHA | 100.015.056 |
| No CE | 216-561-1 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H10S [Isomères] |
| Masse molaire[2] | 102,198 ± 0,01 g/mol C 58,76 %, H 9,86 %, S 31,38 %, |
| Moment dipolaire | 1,781 ± 0,010 D [1] |
| Propriétés physiques | |
| T° fusion | 19 °C[3] |
| T° ébullition | 141,8 °C[3] |
| Solubilité | 1,300 g·l-1 (eau, 25 °C)[3] |
| Masse volumique | 0,99 g·cm-3 (20 °C)[4] |
| Pression de vapeur saturante | 116,5 hPa (75 °C)[5] |
| Écotoxicologie | |
| LogP | 2,280[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
C'est l'équivalent du cyclohexane, où l'un des atomes de carbone a été substitué par un atome de soufre.
Par extension, on appelle thianes les composés dérivés du thiane.
Propriétés
modifierLe thiane cristallise dans un système cubique avec un paramètre de maille de a = 869 pm et quatre molécule par maille[6].
Synthèse
modifierLe thiane peut être obtenu avec un bon rendement par réaction de 1,5-dibromopentane et du sulfure de sodium, produisant en même temps du bromure de sodium :
Il est également possible d'obtenir le thiane par cyclisation du 5-bromopentane-1-thiol en présence de base[7] :
Réactions
modifierLe thiane peut réagir comme nucléophile, mais il faut que l'électrophile dispose d'un bon groupe partant. Il est par exemple possible d'utiliser des halogénure organiques, activés par des sels d'argent. Le résultat de la réaction est un pseudo sel de tétrahydrothiopyranium.
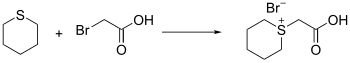
Notes et références
modifier- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Thiane », sur ChemIDplus
- G. H. Jeffery, R. Parker, A. I. Vogel in: J. Chem. Soc. 1961, 570–574.
- P. T. White, D. G. Barnard–Smith, F. A. Fidler in: Ind. Eng. Chem. 1952, 44, 1430–1438.
- S. Kondo in: Bull. Chem. Soc. Jpn. 1956, 29, 999.
- M. B. Anderson, M. G. Ranasinghe, J. T. Palmer, P. L. Fuchs in: J. Org. Chem. 1988, 53, 3125–3127.
- E. Ziegler, H. Wittmann, H. Sterk in: Monatsh. Chem. 1987, 118, 115–126.
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « thian » (voir la liste des auteurs).



