Thiophosgène
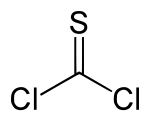
Le thiophosgène est un liquide jaune de formule brute CSCl2. Ce composé a une géométrie trigonale plane. Il possède deux liaisons carbone-chlore réactives qui permettent à ce réactif d'intervenir dans différents protocoles en synthèse organique.
| Thiophosgène | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | carbonothioyl dichloride | |
| Synonymes |
chlorure de thiocarbonyle |
|
| No CAS | ||
| No ECHA | 100.006.675 | |
| No CE | 207-341-6 | |
| No RTECS | XN2450000 | |
| PubChem | 10040, 7791301 | |
| ChEBI | 29366 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide jaune | |
| Propriétés chimiques | ||
| Formule | CSCl2 | |
| Masse molaire[1] | 114,982 ± 0,01 g/mol C 10,45 %, Cl 61,67 %, S 27,89 %, |
|
| Propriétés physiques | ||
| T° fusion | < 25 °C [2] | |
| T° ébullition | 73 °C[3] | |
| Solubilité | décomp. dans l'eau | |
| Masse volumique | 1,50 g·cm-3[4] | |
| Point d’éclair | 62 °C[3] | |
| Cristallographie | ||
| Structure type | molécule plane, C2v | |
| Propriétés optiques | ||
| Indice de réfraction | 1,548[4] | |
| Précautions | ||
| Directive 67/548/EEC[3] | ||
| Transport[3] | ||
| Écotoxicologie | ||
| DL50 | 100 mg·kg-1 (souris, intraveineuse)[5] 929 mg·kg-1 (rat, oral)[5] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Synthèse
modifierCSCl2 est préparé en deux étapes à partir du disulfure de carbone (S=C=S). Dans la première étape, celui-ci est chloré pour former le chlorure de trichlorométhanesulfényle, CCl3SCl :
- CS2 + 3 Cl2 → CCl3SCl + S2Cl2
La chloration doit être contrôlée pour éviter qu'un excès de chlore ne convertisse le chlorure de trichlorométhanesulfényle en tétrachlorure de carbone (CCl4). Une hydrodistillation sépare ce chlorure de trichlorométhanesulfényle, un rare chlorure de sulfényle et hydrolyse le chlorure de soufre.
La réduction du chlorure de trichlorométhanesulfényle produit du thiophosgène :
- CCl3SCl + M → CSCl2 + MCl2
avec M, un métal ; typiquement, l'étain est utilisé comme réducteur.
Utilisation
modifierLe thiophosgène est principalement utilisé pour préparer des composés de formule CSX2 où X = OR, NHR (thiocarbamides). Ces réactions passent par des intermédiaires tels que CSClX. Sous certaines conditions, le thiophosgène peut convertir des amines primaires en isothiocyanates. Il peut aussi servir comme diénophile pour donner après réduction des dérivés 5-thiacyclohexén-1-yl.
Sécurité
modifierCSCl2 est considéré comme étant hautement toxique.
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Thiophosgene » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Thiophosgène », sur ChemIDplus, consulté le 26 octobre 2009
- Entrée « Thiocarbonyl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 octobre 2009 (JavaScript nécessaire)
- thiophosgene sur sigmaaldrich.com
- thiophosgène sur chemidplus et ref incluses
- Thiophosgene, Dyson, G. M. ; Organic Syntheses, Coll. Vol. 1, p. 506; Vol. 6, p. 86.
- Thiophosgene in Organic Synthesis, Sharma, S. ; Synthesis, 1978, pages 804-820.

