Cancer colorectal
Le cancer colorectal (ou colo-rectal) est une tumeur maligne de la muqueuse du côlon ou du rectum. Il peut toucher tous les segments anatomiques du gros intestin comme le caecum, le côlon ascendant, le côlon transverse, le côlon descendant, le côlon sigmoïde et le rectum mais ne concerne pas le cancer du canal anal qui est une entité distincte[1].
| Médicament | Irinotécan |
|---|---|
| Spécialité | Oncologie |
| CISP-2 | D75 |
|---|---|
| CIM-10 | C18-C20/C21 |
| CIM-9 | 153.0-154.1 |
| ICD-O | M8140/3 (95% of cases) |
| OMIM | 114500 |
| DiseasesDB | 2975Í |
| MedlinePlus | 000262 |
| eMedicine |
277496 med/1994 ped/3037 |
| Patient UK | Colorectal-cancer |
Le type histologique est un adénocarcinome lieberkühnien dans la majorité des cas. Les symptômes de la maladie dépendent de l'emplacement de la tumeur et de son stade. Initialement, le cancer est asymptomatique. Un symptôme typique du cancer colorectal est un saignement, qui peut être invisible à l’œil nu lors de la défécation ou bien être observé mélangé avec les selles. Dans le cas d'un emplacement plus en amont, le sang se dégrade, le saignement se manifeste alors par la présence de selles noires. L'anémie secondaire au saignement chronique se manifeste principalement par une faiblesse, une fatigue constante et une pâleur de la peau et des muqueuses. La douleur abdominale survenant dans le cancer colorectal est inhabituelle et dépend de l'emplacement de la tumeur. Il peut y avoir alternance de diarrhée et de constipation, ainsi qu'une perte de poids.
Un dépistage du cancer colorectal par détection du sang dans les selles est disponible dans de nombreux pays. En France, en Belgique, et au Québec il est gratuit et réalisé à partir de l'âge de 50 ans[2],[3],[4].
Épidémiologie
modifier
- no data
- <2.5
- 2.5-5
- 5-7.5
- 7.5-10
- 10-12.5
- 12.5-15
- 15-17.5
- 17.5-20
- 20-22.5
- 22.5-25
- 25-27.5
- >27.5
C'est le second cancer, pour ce qui est de la fréquence, chez la femme (après le cancer du sein) et le troisième chez l'homme (après le cancer de la prostate et le cancer du poumon)[6],[7].
Dans le monde, son incidence est estimée à un million de nouveaux cas en 2018[7]. Les taux d'incidence les plus élevés sont relevés en Australie, Nouvelle-Zélande, Europe et Amérique du Nord. Les plus faibles sont situés en Amérique centrale, sud de l'Asie centrale et en Afrique[7].
Âge
modifierLe cancer du côlon touche environ 4 % des adultes au cours de leur vie aux États-Unis, selon le National Cancer Institute, mais il est en forte augmentation depuis 2008 environ chez les jeunes adultes américains, y compris au Canada où le registre national du cancer canadien a montré une incidence qui chez les femmes de moins de 50 ans a augmenté chaque année de près de 4,5 % entre 2010 et 2015. Chez les hommes canadiens de moins de 50 ans, l'augmentation moyenne a été de près de 3,5 %/an entre 2006 et 2015. Ce sont pour les deux sexes les taux les plus élevés jamais enregistrés parmi les cohortes de naissance les plus récentes. En 2017, près de 12 000 femmes et près de 15 000 hommes, tous âges confondus ont reçu un diagnostic de cancer colorectal[8].
Aux États-Unis, il en va de même : en 2004, 10 % des diagnostics concernaient des personnes de moins de 50 ans, ce taux est passé à 12 % en 2015 ; en 2019, un cancer colorectal sur trois concerne des patients âgés de 18 à 50 ans explique une oncologue américaine. En Europe au Danemark, on dresse le même constat chez les moins de 50 ans. De même, au Royaume-Uni lors de la décennie 2008-2018. Une autre étude montre pour 20 pays européens sur ces 10 ans une augmentation de près de 8 % par an des cas déclarés chez les 20 ans, de 5 % chez les 30 ans et de 1,6 % chez les quadragénaires[8]. Dans l'hémisphère sud en Nouvelle-Zélande, on fait le même constat[8].
De plus, au moment du diagnostic, la part des stades 3 ou 4 est disproportionnée chez les jeunes adultes (sans doute car la maladie était autrefois rare chez eux, faisant que patients et médecins n’y pensent pas) ; il est donc urgent de sensibiliser à cette augmentation du risque, et de comprendre l'origine de cette augmentation régulière[8]. Une étude des « signatures mutationnelles » de formes précoces montre une corrélation entre l'exposition pendant l'enfance à des souches d'E.coli productrices de colibactine (en) (un métabolite génotoxique) et la survenue d'un cancer colorectal avant 40 ans[9]. S'il n'est pas possible d'en déduire un lien de causalité, il est en revanche établi que le phénomène concerne surtout des habitants de zones urbaines occidentalisés, ayant un régime alimentaire « plus riche en viandes rouges et transformées, en sucre ajouté et en céréales raffinées » au détriment des fruits et légumes[10]. Sont également incriminés les charcuteries, pâtes blanches, des boissons sucrées et le pain blanc emballé. À l'inverse, les légumes (patates douces et carottes notamment) et même les pizzas (du fait de tomates cuites riches en lycopène, un puissant antioxydant) ont un effet anti-inflammatoire[11].
Les formes héréditaires (transmission mendélienne) sont rares (moins de 5 % des cas) même si un antécédent familial est retrouvé dans près d'un cinquième des cas[12]. Les formes familiales seraient de meilleur pronostic[13].
Mortalité
modifierEn France, le cancer colorectal a été diagnostiqué chez 43 000 personnes en 2018, et a été responsable de 17 000 décès. Bien que sa mortalité soit en diminution, il représente la 2e cause de décès par cancer chez l'homme, et 3e chez la femme[7].
Dans le monde, on estime qu'il a été responsable en 2018 de plus de 880 000 décès[7].
La survie nette standardisée en France métropolitaine, sur la période 2005-2010 a été estimé à 63 % à cinq ans (62 % chez l'homme contre 64 % chez la femme), et 52 % à dix ans (52 % chez l'homme contre 54 % chez la femme).
L'âge médian au décès est de 77 ans pour l'homme et 81 ans pour la femme[14].
Diagnostic
modifier

Signes fonctionnels
modifierUn cancer colorectal ne manifeste pas forcément de signes. C'est pourquoi, après cinquante ans, on recommande des tests de détection.
Il peut se manifester par :
- du sang dans les selles (sang fécal, apparent ou occulte : en ce cas, détectable par un test) ;
- une constipation soudaine ou qui s'aggrave, avec possible alternance diarrhées/constipations. À l'extrême, une occlusion intestinale peut survenir, ou une perforation de la tumeur avec péritonite. La présence de signes digestifs apparus dans les mois précédant l'accident aigu orientent vers l'origine cancéreuse de la complication aigüe ;
- une douleur abdominale.
Les symptômes sont souvent moins spécifiques avec, par exemple :
- une anémie qui entraîne une fatigue persistante et un teint pâle (due aux hémorragies intestinales). Elle survient typiquement à cause d'une carence en fer (taux bas du fer sérique et de la ferritine du plasma sanguin). La recherche d'un saignement occulte, dans ce cas, conduit à un diagnostic de cancer du côlon dans environ 10 % des cas[15] ;
- un amaigrissement inexpliqué ;
- tardivement, les métastases hépatiques peuvent générer un foie anormalement gros lors de la palpation.
Examen clinique
modifierIl est, en règle générale, décevant car le toucher rectal ne permet que de chercher de possibles anomalies rectales. Rapide et peu coûteux, cet examen détecte les anomalies situées aux alentours du rectum (dépistage d’environ deux tumeurs du rectum sur trois)[16].
Examens complémentaires
modifierEn complément de l'examen clinique, ils vont rechercher :
- d'éventuelles lésions à la fois rectales et/ou coliques. Ceci se fait habituellement grâce à la coloscopie. En présence d'une sténose, le médecin utilisera le lavement baryté (si la sténose n'implique pas une rétention de baryte, s'il existe un risque de rétention le médecin prescrira probablement une IRM du pelvis.
Si après détection d'une tumeur une exérèse locale ou un autre traitement local de la tumeur est envisagé, le toucher rectal est complété par une imagerie pelvienne (échographie endorectale faite au moyen d'une sonde sans endoscope, ou échoendoscopie) ; - d'éventuelles métastases viscérales. Cette recherche se fait via une radiographie pulmonaire (face et profil), généralement associée à une échographie du foie, et parfois à un examen de l'abdomen au scanner.
Si un cancer est effectivement détecté et que l'état du patient le permet, une coloscopie complète est prescrite avant l'intervention pour bien décrire et localiser les lésions tumorales coliques synchrones, bénignes ou malignes[17].
Coloscopie
modifier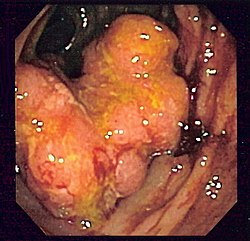
La coloscopie est l'examen de référence : une sonde (long flexible enrobé de plastique) est insérée par l'anus puis glissée peu à peu dans l'intestin (sous anesthésie générale en général). Il permet d'observer la muqueuse de l'anus jusqu'à la jonction iléo-colique, au niveau du cæcum et de l'appendice iléo-cæcal, et de faire des prélèvements. Si un polype est découvert, il est enlevé entièrement et sera analysé au laboratoire par histologie ; son exérèse diminue beaucoup le risque de cancer (voir ci-dessous le paragraphe Prévention). La sigmoïdoscopie est un examen plus rapide, mais moins complet, fait au moyen d'une courte sonde semi-rigide qui permet l'exploration du rectum et du côlon sigmoïde, mais pas du reste du côlon.
Le tissu prélevé est inclus dans un bloc de paraffine pour en extraire des coupes fines de quelques micromètres. Après coloration, ces coupes sont examinées au microscope par un médecin spécialisé en anatomopathologie (ou histologie). Cet examen permet de classer le prélèvement suivant la forme de la tumeur et le type des cellules.
On trouve le plus souvent dans l'intestin des adénomes (polypes adénomateux). Considéré comme bénin, le polype risque d'évoluer vers un cancer si on le laisse en place, s'il est gros (plus d'un centimètre de diamètre), et/ou s'il est villeux. Les petits polypes et les polypes tubulaires présentent moins de risques. On trouve aussi des polypes hyperplasiques considérés comme pratiquement sans risque. Enfin, on trouve dans les côlons des adénocarcinomes qui sont les véritables cancers, dont les cellules dysplasiques franchissent la lamina propria. Ce premier stade de l'invasion peut évoluer pour s'étendre à d'autres organes et conduire à l'apparition de métastases hépatiques le plus souvent, qui provoquent la mort plus fréquemment que la tumeur initiale[réf. nécessaire].
La coloscopie assistée par intelligence artificielle permettrait d'augmenter de 20 % le taux de détection de polypes[18]. L'endoscope confocal[19] est un outil qui permettrait la détection des biofilms in vivo, tandis que le traitement par ultrasons permettrait la perturbation de ceux-ci[20].
Le coloscanner
modifierAujourd'hui, le diagnostic en imagerie repose sur l'utilisation de la tomodensitométrie ou scanner en s'aidant d'une technique de distension colique. Cette technique particulière justifie le terme spécifique de coloscanner. La distension peut se faire avec un lavement à l'eau ou avec une insufflation gazeuse.
- Dans le premier cas de lavement à l'eau, on parle de coloscanner à l'eau. Son indication est essentiellement le diagnostic d'un cancer colorectal et il est proposé en alternative à la coloscopie devant des symptômes évoquant un cancer colique, en particulier chez les sujets âgés ou fragiles pour lesquels il est préférable de se dispenser d'une anesthésie générale en première intention. Cette technique permet de faire le diagnostic du cancer et le bilan complet de recherche d'une métastase, en particulier hépatique ou pulmonaire.
- La deuxième technique dite de coloscopie virtuelle est une forme particulière de scanner, permettant de reconstituer grâce aux images du scanner une image en 3D de l'intérieur du côlon. Cette méthode d'exploration impose comme pour une coloscopie un régime sans résidus 24 h avant et administration d'une préparation colique visant à laver le côlon. Elle est généralement pratiquée lorsqu'une coloscopie traditionnelle n'est pas réalisable[21].
Le lavement baryté
modifierLa radiographie après lavement au sulfate de baryum (appelé couramment lavement baryté) : le baryum, très lourd, est opaque aux rayons X. Cette technique est nettement moins performante que le coloscanner et va progressivement disparaitre dans cette indication.
D'autres types d'examens sont peu utilisés, trop coûteux, trop nouveaux, ou pas assez spécifiques ou sensibles (vidéocapsule, PET, CEA…).
Anatomopathologie
modifierLes adénocarcinomes représentent 95 % des cas, dont 17 % d'adénocarcinomes colloïdes ou mucineux.
Macroscopie
modifierC'est une tumeur le plus souvent ulcérée à sa partie centrale, avec un bourgeonnement plus ou moins marqué en périphérie et une infiltration pariétale qui s'étend vers la séreuse ; elle est rarement végétante (cæcum). Elle occupe une partie ou la totalité de la circonférence colique[réf. nécessaire].
-
Apparence de l'intérieur d'un côlon développant un carcinome colorectal invasif (tumeur de forme irrégulière formant ici un cratère rougeâtre).
-
Apparence d'une colectomie révélant deux polypes adénomateux (tumeurs ovales brunâtres) et un carcinome colorectal invasif (cratère rougeâtre).
-
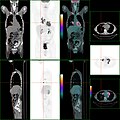
Examen (PET/CT) de carcinome du côlon. Outre, la tumeur primaire, d'autres lésions sont visibles, dont un nodule pulmonaire.
Microscopie
modifierL'adénocarcinome colique est une prolifération généralement bien différenciée (adénocarcinome lieberkühnien), faite de grandes cellules basophiles, cylindriques, disposées en structures glandulaires, papillaires ou polyadénoïdes. Il existe parfois une mucosécrétion très abondante, dissociant les formations épithéliales et le stroma (adénocarcinome mucineux, anciennement adénocarcinome colloïde muqueux)[réf. nécessaire]. L'extension se fait vers la séreuse, avec souvent une pénétration des lymphatiques par le tissu tumoral.
-
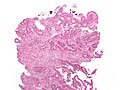
Cancer — Adenocarcinome invasif (le type le plus fréquent de cancer colorectal). Les cellules cancéreuses sont visibles (en bleu) au centre et en bas à droite de l'image (à comparer aux cellules normales visibles en haut à droite).
-
Vue histopathologique de cellules cancéreuses du côlon.
-
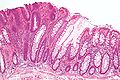
Lésions précancéreuses - Adénome tubulaire (à gauche de l'image), un type de polype du côlon et un précurseur du cancer colorectal (la muqueuse colorectale normale est visible à droite).
-
Lésions précancéreuses - adénome villeux colorectal.
Relations entre les tumeurs bénignes et les tumeurs malignes
modifierUn certain nombre d'adénomes (10 à 15 %) apparaissant histologiquement dédifférenciés sont susceptibles de cancérisation, aboutissant à la constitution d'un adénocarcinome lieberkühnien[réf. nécessaire]. Ainsi, la grande majorité des adénocarcinomes coliques dérive d'un polype adénomateux[22]. Le polype prend naissance presque toujours avec la présence d'un biofilm[23],[24],[25],[26], dans lequel les polyamines auraient un rôle important[27],[28],[29],[30]. Ceci serait en particulier plus marqué pour le colon droit, mais moins évident pour le colon gauche[31]. La présence d'un biofilm bactérien permet en particulier aux cellules cancéreuses d'échapper au système immunitaire[32], ou parce qu'elles sont en zone de Lumière du côlon, non accessible non plus à celui-ci. L'imagerie par fluorescence combinatoire, utilisant la bioluminescence, permettrait de distinguer les biofilms à tendance carcinogène de ceux plus anodins[33], comme le propose aussi la technique d'Hybridation in situ en fluorescence[34].
L'évolution vers la malignité d'une tumeur bénigne dans la muqueuse colique concerne 3 ‰ des adénomes[16]. Il n'y a pas d'opposition absolue entre tumeurs bénignes et tumeurs malignes : il existe seulement des tumeurs présentant des niveaux d'évolution différents[réf. nécessaire]. Ces évolutions seraient provoquées en particulier par l'action conjuguée à travers un biofilm[35],[36] (en particulier colon droit[37]) des toxines émises par au moins deux bactéries oncogéniques (en) : Bacteroides fragilis (en) et certaines souches d'Escherichia coli productrices de colibactine (en)[38]. L'évolution d'un adénome en adénocarcinome prend en moyenne une dizaine d'années[39] et 30 % des adénomes dont la taille est supérieure à 1 cm se transformeront en cancer[40].
Physiopathologie
modifierOn pense le cancer colorectal serait lié à une lésion chroniquement enflammée et mal cicatrisée. Selon une étude de 2024, le cancer colorectal serait associé à un profil lipidomique proinflammatoire défavorable à la cicatrisation d'une lésion.
L'évolution normale de la cicatrisation d'une lésion comporte une phase inflammatoire transitoire suivie d'une phase résolutoire. Le passage de la première phase à la seconde s'accompagne d'un changement de classe lipidique induit par la prostaglandine (PGE2/PGD2) produisant des lipoxines (en) antiinflammatoires (LXA4, LXB4). Or, le profil lipidomique des tumeurs du cancer colorectal montre une faible expression des gènes permettant ce changement de classe lipidique[41].
Facteurs de risque
modifierLiés à l'individu
modifier- L'âge : neuf personnes atteinte sur dix ont plus de 50 ans[42].
- Les antécédents personnels ou familiaux d'adénome ou de cancer colorectal[43].
- La polypose adénomateuse familiale (PAF) une multitude de polypes apparaissent chez tous les porteurs du gène APC muté. À l'âge adulte, l'un de ces polypes dégénère forcément en cancer, sauf si on enlève le côlon par une opération chirurgicale. Le gène APC est un gène suppresseur de tumeur situé sur le bras long du chromosome 5 et son altération est considérée comme initiatrice de la cancérogenèse colorectale (1 % environ des cancers colorectaux). Il agit en amont de la voie de signalisation Wnt. Il suffit d'une mutation d'une des deux copies de gène (puisqu'il s'agit d'une maladie autosomique dominante) pour induire des polyposes adénomateuses familiales (avec apparition dès l'adolescence de centaines à milliers de polypes dans le côlon[44]).
- Le syndrome de Lynch, ou cancer héréditaire du côlon sans polypose (en anglais HNPCC). Il y a moins de polypes que dans la FAP, et un risque moindre de cancer, mais la surveillance est nécessaire par coloscopies régulières.
- Les maladies inflammatoires chroniques intestinales (MICI), notamment la maladie de Crohn et la colite ulcéreuse[43].
- Outre des mutations qui peuvent être induites au cours de la vie (exposition à de la radioactivité ou à des produits mutagènes présents dans la nourriture), une mutation du gène « Notch » peut fortement accélérer ou aggraver la cancérogenèse colorectale. Ce gène code une protéine qui agit comme un « interrupteur » qui, quand il est allumé, induit une cascade de réactions à l'intérieur de la cellule, permettant une prolifération cellulaire (normale et nécessaire tant qu'elle est contrôlée, dans toute cellule, de tout organisme, et notamment lors du développement embryonnaire)[45]. Ce gène Notch, avec le gène Wnt, joue un rôle majeur dans la signalisation cellulaire intestinale, assurant le développement et l'organisation de l'intestin qui est un organe devant se renouveler en permanence (il est entièrement renouvelé en moins de cinq jours, sur une surface de villosités et de circonvolutions qui, si elles étaient « étendues à plat », serait comparable à la taille d'un court de tennis joué en double. Des cellules progénitrices situées dans les creux des villosités intestinales doivent sans cesse produire des cellules neuves, tout en étant régulées… Or, l'activation simultanée (artificielle ou anormale) de ces deux voies de signalisation accroît de plus de vingt fois le risque quantitatif d'apparition d'adénomes (tumeurs bénignes) intestinaux chez la souris, par rapport à l'altération de la seule voie Wnt. Le gène Notch semble donc particulièrement en cause dans un phénomène probablement synergique et déclenché par l'activation couplée de ces deux voies, créant les conditions favorisant le processus tumoral. De plus, chez la souris, ces tumeurs se développent de façon inhabituellement rapide et importante dans le côlon, évoquant la physiopathologie du cancer du côlon chez l'humain.
Liés à l'environnement
modifier- L'activité physique, la consommation de céréales complètes, de produits laitiers et de fibre semblent diminuer le risque de développer un cancer colorectal[46].
- La consommation de viande rouge ou transformée, d'alcool, le tabagisme et l'obésité semblent augmenter le risque[46],[47].
- Certaines études tendent à montrer également que l'apport de vitamine C, de vitamine D et de poisson diminuerait le risque[46].
- D'autres études tendent elles à montrer qu'une faible consommation de fruits et légumes et la consommation de produits contenant du fer héminique augmenteraient le risque[46].
- La bactérie Fusobacterium nucleatum inhiberait l'action des cellules immunitaires, ce qui pourrait faciliter la cancérogenèse[48],[49].
Prévention du cancer colorectal
modifierLa majorité des cancers du côlon et du rectum pourraient être évités par une surveillance accrue, un mode de vie et une alimentation appropriés (limitation des quantités de viande rouge et restriction ou suppression des charcuteries[50]) et, probablement aussi, la prise orale de produits de chimioprévention.
En janvier 2014, le Conseil supérieur de la santé de Belgique a publié un avis scientifique complet sur le rôle de la surconsommation de viande rouge et la consommation de charcuterie[51] et la prévalence du cancer du côlon. Le Conseil y détaille les mécanismes physiopathologiques et recommande à la population belge de diminuer de moitié sa consommation de viande rouge pour réduire de 20 % son risque global de cancer colorectal et d'« éviter autant que possible les charcuteries à base de viande rouge »[52].
Pour ce qui concerne la viande rouge fraîche, cela signifie passer d’une consommation moyenne actuelle de 640 grammes par semaine à 300 grammes. Le Conseil souligne que pour les seniors, la viande est une source non négligeable et intéressante de protéines de qualité. La problématique est différente pour ce qui concerne les charcuteries, dont la cancérogénicité est plus élevée en raison des modes de fabrication des viandes transformées[53] : d'après le Conseil Supérieur de Santé belge, la consommation de charcuteries à base de viande rouge devrait quant à elle être exceptionnelle[50].
En résumé :
- ne pas s’exposer au tabac ;
- se limiter à 2-3 unités de consommation d'alcool par jour pour un homme et 1-2 unités de consommation pour une femme ;
- pratiquer une activité physique suffisante et régulière (au minimum 30 minutes de marche rapide par jour) ;
- avoir un régime riche en fibres et équilibré, en limitant la viande rouge (300 g par semaine) et en évitant autant que possible des charcuteries à base de viande rouge, qui peuvent donner naissance à des nitrosamines, à des nitrosamides et à du fer nitrosylé ;
- privilégier la consommation de volaille, d’œufs et de poisson, y compris du poisson gras, ainsi que par exemple remplacer une fois par semaine la viande rouge par des alternatives végétales ;
- lors de la cuisson et du rôtissage de la viande rouge, utiliser des épices et des herbes aromatiques, telles que du romarin et de l’ail, contenant naturellement des antioxydants, ne pas trop brunir la viande et en tout cas laisser les parties les plus brun foncé ou noires sur son assiette[50].
Il faut noter que les prescriptions ne sont pas une traduction stricte des conclusions de la recherche scientifique. Par exemple pour l'alcool, le risque augmente proportionnellement à la consommation d'alcool[54] et il n'y a pas de dose d'alcool sans risque[55].
- Chimioprévention : plus de 200 produits, notamment les micronutriments cités ci-dessus, ainsi que d'autres nutriments comme le calcium ou l'acide folique (une vitamine B), et des médicaments comme l'aspirine inhibent la cancérogenèse dans des modèles précliniques (chez l'animal). Dans certaines études, on inhibe complètement les tumeurs induites chimiquement dans le côlon des rats. D'autres études montrent l'inhibition importante des polypes intestinaux spontanés chez des souris mutées (souris Min). Les essais cliniques de chimioprévention chez des volontaires humains ont eu moins de succès, mais peu de produits ont été testés à ce jour. Des suppléments de calcium ou d'aspirine donnés chaque jour pendant trois à cinq ans après l'enlèvement d'un polype, ont diminué la réapparition des polypes chez les volontaires (de 15 à 20 %)[réf. nécessaire]. La base de données de chimioprévention de l'INRA[56] donne les résultats de toutes les études publiées sur les agents de chimioprévention chez l'homme et chez les rongeurs. L'aspirine, par ailleurs, semble améliorer le pronostic des formes tumorales avec sur-expression de la cyclooxygénase de type 2 (COX-2)[57].
Les produits laitiers diminuent aussi le risque de cancer colorectal (selon un suivi de près de 480 000 hommes et femmes de la cohorte épidémiologique European Prospective Investigation into Cancer and Nutrition (EPIC) durant onze ans, quel que soit le produit laitier (lait entier ou écrémé, yaourt, fromage) et sans lien avec sa teneur en matières grasses. Et l'effet protecteur du calcium serait limité au calcium d’origine laitière[58],[59].
Pronostic
modifierLa seule classification utilisée en préopératoire est la classification TNM dont la 7e version date de 2010[60].
Classification TNM
modifierT (tumeur) :
- Tx : Tumeur primitive non évaluable ;
- T0 : Pas de tumeur primitive ;
- Tis : Envahissement de l'épithélium ou de la lamina propria ;
- T1 : Envahissement de la sous-muqueuse ;
- T2 : Envahissement de la musculeuse ;
- T3 : Envahissement de la sous-séreuse ou des tissus péricolorectaux non péritonisés ;
- T4 : Atteinte de la séreuse ou des structures adjacentes :
- T4a : perforation du péritoine viscéral,
- T4b : adhésion ou invasion d'un organe de voisinage.
N (ganglion) :
- Nx : Ganglions non évalués ou moins de 8 ganglions examinés ;
- N0 : Pas de métastase ganglionnaire régionale ;
- N1 : 1 à 3 ganglions métastatiques régionaux :
- N1a : un seul ganglion,
- N1b : deux ou trois ganglions,
- N1c : nodule(s) tumoraux, c'est-à-dire satellite(s) dans la sous-séreuse, ou dans les tissus non péritonisés péricoliques ou périrectaux sans métastase ganglionnaire régionale ;
- N2 : 4 ou plus ganglions métastatiques régionaux :
- N2a : quatre à six ganglions,
- N2b : sept ganglions ou plus.
M (métastase) :
- M0 : Pas de métastase ;
- M1 : Métastases à distance (dont ganglions sus-claviculaires) :
- M1a : métastase localisée à un autre organe, autre que régional (foie, poumon, ovaire, ganglion lymphatique),
- M1b : métastases dans plusieurs organes ou péritonéales
Stadification
modifierÀ partir des données de la classification TNM, les cancers du côlon sont classés en quatre stades. Les chances de guérison varient considérablement du stade I au stade IV. Pour chacun des stades est noté entre parenthèses le taux de survie cinq ans après le traitement (données 2004[61] ; en 2016, ces chiffres ne semblaient pas avoir évolué significativement, sauf pour les cancers au stade IV[62]). La stratégie thérapeutique est également adaptée à chacun de ces stades.
- Stade I (93,2 %) : pT1-T2 N0 M0
- Stade II : pT3-T4 N0 M0
- Stade IIA (84,7 %) : pT3 N0 M0
- Stade IIB (72,2 %) : pT4 N0 M0
- Stade III : tous T N1-N2 M0
- Stade IIIA (83,4 %) : pT1T2N1M0
- Stade IIIB (64,1 %) : pT3T4N1M0
- Stade IIIC (44,3 %) : tous T N2M0
- Stade IV (8,1 %) : métastases à distance
Le pronostic est plus mauvais en cas d'occlusion ou de perforation, de cancer colloïde muqueux ou indifférencié[réf. nécessaire]. Il est meilleur en cas de phénotype MSI+. Il est également médiocre s'il existe une mutation sur le gène BRAF (gène) (V600 E), ce qui représente environ 10 % des cas[63].
Traitement
modifierLa prise en charge du cancer du côlon a fait l'objet de la publication de plusieurs recommandations. Celles de la Haute Autorité de santé et de l'Institut national du cancer, organismes français, datent de 2011[64].
Une détection à un stade précoce est favorable. Le taux de survie à 5 ans des patients diagnostiqués en 1999-2005 a été de 90,8 % pour le stade local. Il chutait à 11,3 % pour les patients diagnostiqués au stade métastasique[16]. Le premier traitement est la chirurgie, qui permet d'enlever la tumeur et les ganglions environnants (curage ganglionnaire). Les cancers très superficiels sont parfois totalement réséqués par voie endoscopique, sans chirurgie complémentaire nécessaire s'il n'y a pas franchissement de la muqueuse musculaire. On y associe des traitements adjuvants : chimiothérapie, si le curage contient des métastases ganglionnaires ou s'il existe des métastases hépatiques ou pulmonaires ; radiothérapie si l’exérèse chirurgicale n'a pu être totale, avec reliquat tumoral individualisé sur un organe vital.
Dans le cas du cancer du bas et du moyen rectum, la présence de ganglions visibles sur le scanner ou l'échoendoscopie (donc une stadification N+) est une indication de radiochimiothérapie préopératoire (dite néoadjuvante).
Par ailleurs, les cancers du haut rectum ont une prise en charge généralement identique à ceux du côlon.
Méthodes thérapeutiques
modifierEndoscopie
modifierTout polype enlevé en endoscopie est étudié en anatomie pathologique. La présence de dysplasie (état précancéreux) ou de cancérisation très superficielle (pas d'envahissement de la musculaire muqueuse, c'est-à-dire stade Tis) fait que la résection endoscopique est curative. La présence de cancer sur une berge d'exérèse ou un envahissement en profondeur (stade T1 ou plus) entraîne une indication de chirurgie complémentaire systématique (sauf si l'état général du patient ne le permet pas).
Chirurgie
modifierLe but de la chirurgie est d'enlever la tumeur et les ganglions qui sont autour par curage ganglionnaire. Les ganglions accompagnant les vaisseaux sanguins irriguant le côlon (situés dans le mésocôlon, lame graisseuse s'étendant entre l'aorte et le côlon), on se trouve donc à enlever un segment de côlon et non simplement la tumeur. L'exérèse, pour être suffisante, doit emporter au moins 5 cm de côlon de part et d'autre du cancer, et au moins 12 ganglions dans le curage.
Du fait de l'anatomie vasculaire du côlon, les interventions les plus couramment pratiquées sont :
- l'hémicolectomie droite, avec anastomose iléotransverse, emportant tout le mésocôlon jusqu'au bord droit de l'artère mésentérique supérieure ;
- l'hémicolectomie gauche vraie, avec anastomose entre le côlon transverse et le haut rectum. Le curage ganglionnaire emporte l'artère mésentérique inférieure, liée à 1 cm de son origine sur l'aorte et ses branches ;
- la sigmoïdectomie avec ligature vasculaire après émergence de l'artère colique supérieure gauche ;
- les résections du côlon transverse sont plus atypiques et dépendent de l'anatomie vasculaire mise en évidence en préopératoire.
Enlever la tumeur est le moyen le plus rapide et le plus efficace d'éliminer le cancer. Cependant, si la tumeur a déjà envoyé des métastases loin du côlon, l'exérèse chirurgicale ne suffit pas à guérir le malade.
Ces interventions peuvent être faites par laparotomie (ouverture du ventre) ou par cœlioscopie (on travaille dans un ventre gonflé par du CO2 grâce à des instruments introduits par des orifices de 1 cm. Le cancer est sorti par une petite incision à la fin de l'intervention).
Des travaux ont montré que les techniques de récupération rapide après chirurgie permettent de réduire le nombre de complications de 50 % et d'accélérer le rétablissement du patient, ce qui permet un retour du patient à domicile non seulement plus rapide, mais aussi dans de meilleures conditions.
La présence d'une incontinence anale non curable, de complications du cancer à type d'occlusion ou de perforation, ou l'impossibilité de conserver le sphincter anal, conduisent à pratiquer une stomie (ou anus artificiel) : le côlon est abouché à la peau de l'abdomen, et les selles sont récupérées dans une poche que le patient positionne lui-même tous les jours ou tous les 3 jours. Les appareillages actuellement disponibles assurent un confort (relatif) de qualité.
S'il y a découverte de métastases hépatiques pendant la chirurgie d'un cancer du côlon, la résection est envisagée : de façon synchrone (dans le même temps opératoire) si l'exérèse apparaît facile, de façon métachrone (plus tard) en cas de métastases multiples. De récentes études ont montré que la taille et le nombre de lésions avaient peu d'influence sur la survie après chirurgie[réf. nécessaire]. Certaines techniques comme l'échographie préopératoire, la chimiothérapie néoadjuvante (avant la chirurgie hépatique) ainsi que l'embolisation de la branche de la veine porte du segment atteint, la radiofréquence, permettent d'augmenter le nombre de patients opérables de leurs métastases et la précision du geste chirurgical.
Si le patient n'est pas opérable, des alternatives existent : chimiothérapie ou plus récemment l'application de traitements physiques sur les métastases (ablation par radiofréquence, traitements thermiques). Les métastases pulmonaires d'un cancer colorectal doivent elles aussi être opérées quand c'est possible. Dans le cas contraire, ici aussi chimiothérapie et traitements physiques sont possibles.
Chimiothérapie
modifierLa chimiothérapie consiste à administrer au malade un médicament cytotoxique destiné à tuer les cellules cancéreuses. Ce traitement, quand il est efficace, peut éliminer les métastases ou empêcher leur apparition et/ou rétrécir les tumeurs ou ralentir leur croissance. La chimiothérapie est généralement un traitement adjuvant effectué en plus de l'opération chirurgicale pour augmenter les chances de succès. Parfois aussi, le traitement est palliatif quand la chirurgie est impossible, ou permet de diminuer la taille de la tumeur avant l'opération (néoadjuvant).
Les drogues les plus utilisées sont :
- le 5-fluorouracile (5-FU), c'est le médicament de référence en cancérologie intestinale ;
- l'oxaliplatine (LOHP) est synergique du 5-FU ; c'est une drogue majeure dans le traitement du cancer du côlon. Au stade métastatique, il est utilisé associé au 5FU (Protocole Folfox) et parfois avec le bévacizumab (Folfox-Avastin). En deuxième ligne métastatique, après une première ligne de chimiothérapie à base d'Irinotécan, l'association Folfox-Avastin est plus efficace que le Folfox seul. En situation adjuvante, après une chirurgie d'exérèse complète, le Folfox4 pendant six mois est plus efficace qu'une chimiothérapie à base de 5FU (LV5FU2 ou Fufol). Les résultats actualisés en 2007 de l'étude Mosaic montrent[65] :
- six ans après la chirurgie pour un cancer du côlon de stade III, 73 % des patients traités par Folfox4 sont en vie contre 68,6 % des patients traité par LV5FU2. En revanche, il n'y a pas d'avantage pour les patients traités pour un cancer de stade II,
- cinq ans après la chirurgie, chez les patients traités pour un cancer du côlon de stade III ou de stade II (avec des facteurs de mauvais pronostic), le taux de rechute est plus faible avec le Folfox qu'avec le LV5FU2.
Le risque d'alopécie est plus faible sous oxaliplatine que sous CPT11. En revanche, on observe des neuropathies invalidantes sous oxaliplatine responsables de dysesthésies (fourmillements) au niveau des doigts et des orteils, parfois invalidantes et prolongées.
- l'Irinotécan (CPT-11) peut avoir des effets secondaires graves, diarrhée sévère notamment (inhibiteur de la topoisomerase 1, non reconnu par le MDR) ;
- le raltitrexed (en) (Tomudex), peut entraîner des neutropénies ;
- le cétuximab (Erbitux) est un anticorps monoclonal qui bloque l'action du récepteur de l'EGF, celui-ci étant présent le plus souvent à la surface des cellules de l'épiderme (d'où son nom), mais aussi à la surface des cellules cancéreuses. Il améliore significativement le pronostic de certains cancers du côlon, même si le gain reste, toutefois, faible (quelques mois)[66] ;
- la 3-déazaneplanocine A qui est aussi un inhibiteur de la synthèse de la S-adénosylhomocystéine.
Il existe en France actuellement deux médicaments spécifiques donnés en association avec le 5-FU : le cétuximab (Erbitux, fabriqué par le laboratoire allemand Merck), le bévacizumab (Avastin, laboratoires Roche). Un 3e médicament a reçu l'autorisation de mise sur le marché : le panitumumab (Vectibix, laboratoires Amgen). Ces trois molécules sont dites « anticorps monoclonaux » et sont voisines dans leur action puisqu'elles inhibent l'action des facteurs de croissance cellulaire. L'Avastin bloque le signal de prolifération des néovaisseaux irriguant les tumeurs (il bloque la néovascularisation). En empêchant l'apparition de ces vaisseaux, on diminue l'apport sanguin vers la tumeur, donc on limite son développement. De plus, il semblerait que ces molécules augmentent l'efficacité des chimiothérapies. Les effets secondaires sont moins lourds que les chimiothérapies conventionnelles. L'Erbitux a pour effet secondaire principal l'apparition d'éruption acnéiforme (folliculite qui marque souvent l'efficacité du traitement) de même que le Vectibix dont le mécanisme d'action est très proche (anti-EGFR). L'Avastin quant à lui peut provoquer des saignements plus ou moins importants ainsi que des retards de cicatrisation (il doit être arrêté deux mois avant une intervention). Ces anticorps, du fait de leur composition, ont cependant un risque d'accident allergique (choc anaphylactique) malgré tout très faible. En effet, ils sont produits à partir d'anticorps d'origine animale, le plus souvent, qui sont ensuite « humanisés », d'où le risque allergique. Ce n'est pas le cas du Vectibix, car il dérive d'anticorps d'origine humaine, ce qui réduit le risque d'allergie.
Radiothérapie
modifierOn irradie parfois la tumeur pour tuer les cellules cancéreuses, avant ou après opération chirurgicale. La radiothérapie peut être associée à une chimiothérapie qui sensibilise la tumeur à l'effet létal des rayons. La radiothérapie est le plus souvent utilisée pour les cancers du rectum, parfois en préopératoire. Dans les cancers du côlon, elle peut être utile si le cancer ne peut être réséqué en totalité du fait d'un envahissement (uretère, vaisseaux iliaques).
Soutien nutritionnel
modifierToute résection d'un cancer du côlon peut entraîner des diarrhées, parfois invalidantes. De même, les chimiothérapies utilisées provoquent souvent une accélération du transit. Les patients se voient donc proposer un régime sans résidu plus ou moins restrictif : éviter de manger des crudités, des légumes riches en fibres ou des viandes en sauce peut améliorer le confort de vie. De même, des épaississants digestifs type Smecta ou des ralentisseurs du transit type lopéramide peuvent aider.
Soutien psychologique
modifierVoir l'article Psycho-oncologie > Psychothérapie, soutien psychologique et aide à la gestion des symptômes.
Stratégie thérapeutique
modifierCancer du côlon localisé
modifierLe traitement du cancer du côlon localisé est un traitement curatif. Le premier temps consiste à enlever la tumeur, le plus souvent au cours d'une chirurgie. Ensuite, un traitement adjuvant par chimiothérapie est proposé si le risque de rechute est important. En 2008, une chimiothérapie est proposée systématiquement lorsqu'il existe des métastases ganglionnaires (Stade III). En l'absence de métastases ganglionnaires, la chimiothérapie adjuvante est proposée dans les cas suivants :
- T4N0 ;
- emboles lymphatiques ;
- occlusion ;
- perforation ;
- nombre de ganglions prélevés insuffisants ;
- aneuploïdie.
Dans ces deux (?) cas, le protocole de chimiothérapie le plus fréquemment utilisé est le protocole FOLFOX4, une injection tous les quinze jours pendant 6 mois.
Cancer du côlon ou du rectum métastatique d'emblée
modifierEn phase métastatique, la chimiothérapie est réalisée soit entre deux chirurgies pour réduire la taille des métastases et faciliter l’exérèse, soit en traitement principal si le cancer ne peut pas être opéré[16]. Quand les métastases ne sont pas opérables, une chimiothérapie est proposée, qui comportera au moins une association de 5-fluorouracile et d’acide folinique. Afin d’augmenter les taux de réponses mais aussi la survie, on y associe de l’oxaliplatine ou de l’irinotécan. Ces protocoles de chimiothérapie se font habituellement tous les 15 jours et la réponse est évaluée tous les 3 mois. Effets secondaires principaux de ces drogues :
- 5-fluorouracile = diarrhée, mucite, syndromes pied-main ;
- oxaliplatine = neurotoxicité, toxicité hématologique ;
- irinotécan = toxicité hématologique, toxicité digestive, syndrome cholinérique aigu.
Cancer du côlon ou du rectum secondairement métastatique
modifierSurveillance
modifierEn cas de traitement curatif (endoscopique ou chirurgical, trois attitudes sont possibles : la simple surveillance clinique, le dosage répété des antigènes carcinoembryonnaires ou la réalisation de scanners systématiques. Il n'est pas démontré de différence de survie suivant l'une ou l'autre de ces attitudes[67].
Dépistage
modifierAnciennement réalisé via un test de recherche de sang occulte dans les selles (Hémoccult), le dépistage organisé pour la population asymptomatique à risque modéré est aujourd'hui réalisé par un test immunologique de recherche de sang occulte dans les selles tous les 2 ans entre 50 et 74 ans, suivi d'une coloscopie en cas de positivité[43].
En cas de risque élevé ou très élevé, le dépistage exige une coloscopie à une fréquence adaptée au niveau de risque. Cela comprend les personnes ayant un antécédent familial de cancer colorectal chez un apparenté au 1er degré ou un antécédent personnel d'adénome ou de cancer colorectal, celles atteintes d'une polypose adénomateuse familiale ou d'un syndrome de Lynch[43].
Autres
modifierLe coloscanner n'a pas été évalué dans le dépistage systématique. La biopsie liquide atteint une sensibilité de 85 %[68].
Un axe de recherche possible : la détection de composés organiques volatils. Une équipe de chercheurs japonais a fait flairer, par une chienne retriever entraînée, des échantillons d'air expiré (33 patients et 132 témoins) et de selles liquides (37 patients et 148 témoins) ; la chienne a reconnu 37 des 38 échantillons de selles et 32 des 36 échantillons d'air expiré de patients porteurs d'un cancer colorectal[69]. Un étude américaine a montré un taux de détection de 76 % des cancers par des analyses bactériologiques conjointes des selles et du microbiote bucal[70], alors que le taux du test Hemoccult serait inférieur à 70 %[71].
Notes et références
modifier- ↑ (en) Dimitrios Raptis, Ignaz Schneider, Klaus E. Matzel et Oliver Ott, « The Differential Diagnosis and Interdisciplinary Treatment of Anal Carcinoma », Deutsches Aerzteblatt Online, (ISSN 1866-0452, PMID 25891807, PMCID PMC4413245, DOI 10.3238/arztebl.2015.0243, lire en ligne, consulté le )
- ↑ « Dépistage gratuit du cancer colorectal entre 50 et 74 ans », sur www.ameli.fr (consulté le )
- ↑ « Examens et dépistage du cancer colorectal | Fondation contre le Cancer », sur www.cancer.be (consulté le )
- ↑ Zone Santé- ICI.Radio-Canada.ca, « Dépister le cancer du côlon chez soi : une pratique qui devrait devenir la norme », sur Radio-Canada.ca (consulté le )
- ↑ (en) WHO Disease and injury country estimates (2009) World Health Organization
- ↑ (en) Boyle P, Ferlay J, Cancer incidence and mortality in Europe 2004, Ann Oncol, 2005;16:481-8
- « Cancer du colon rectum », sur www.santepubliquefrance.fr (consulté le ).
- (en) Katarina Zimmer (2019) Some experts blame our modern, sugary diet, while others think that gut microbiome changes and sedentary lifestyles may play a role. Altogether, the causes are far from clear. |The Scientist|26 aout 2019.
- ↑ (en) Marcos Díaz-Gay, Wellington dos Santos, Sarah Moody et Mariya Kazachkova, « Geographic and age variations in mutational processes in colorectal cancer », Nature, , p. 1–11 (ISSN 1476-4687, DOI 10.1038/s41586-025-09025-8, lire en ligne, consulté le )
- ↑ « Explosion du cancer colorectal chez les jeunes : une toxine bactérienne en cause ? | National Geographic », sur www.nationalgeographic.fr (consulté le )
- ↑ « Cancer colorectal : ce type de pain est à éviter selon une étude | Santé Magazine », sur www.santemagazine.fr, (consulté le )
- ↑ (en) Lynch HT, de la Chapelle A, « Hereditary colorectal cancer » N Engl J Med. 2003;348:919-932.
- ↑ (en) Chan JA, Meyerhardt JA, Niedzwiecki D et al. « Association of family history with cancer recurrence and survival among patients with stage III colon cancer » JAMA. 2008;299:2515-2523
- ↑ « INCA - Les cancers en France », sur www.e-cancer.fr
- ↑ (en) Rockey DC, Cello JP, « Evaluation of the gastrointestinal tract in patients with iron-deficiency anemia » N Engl J Med. 1993;329:1691-5.
- Sébastien Antonini Étude de la véracité des articles médicaux sur Wikipédia (Doctoral dissertation, Aix Marseille Université, 2017).
- ↑ SNFGE 1999 Cancer du côlon et du gros intestin, septembre 1999.
- ↑ (en) "YouTube, à 1 min 48 s, Healthwatch: Artificial Intelligence Colonoscopy, 11 janvier 2019.
- ↑ "Science-directe:A Confocal Endoscope for Cellular Imaging"
- ↑ (en) "Nature:An in vitro proof-of-principle study of sonobactericide"
- ↑ « La coloscopie virtuelle, qu'est-ce que c'est ? », sur VIDAL (consulté le )
- ↑ « Cancers colorectaux - Les tumeurs du côlon | Institut National Du Cancer », sur www.e-cancer.fr (consulté le )
- ↑ "mai 2015:Cancer du côlon : les biofilms de bactéries favorisent l’oncogenèse."
- ↑ (en) "You tube:Do Polyps Start as Bacteria Biofilm?"
- ↑ (en) "Nbci,2015: Metabolism links bacterial biofilms and colon carcinogenesis."
- ↑ "Futura sciences:Le cancer du côlon associé à la présence de biofilms"
- ↑ "octobre 2015:Polyamines, cancer et douleurs chroniques : quels liens ?"
- ↑ (en) "Springer: A wider role for polyamines in biofilm formation"
- ↑ "British Journal of cancer, 2015: Role of dietary polyamines in a phase III"
- ↑ "Cell Metabolism, juin 2015: Metabolism Links Bacterial Biofilms and Colon Carcinogenesis"
- ↑ "Nature 2017, fig 1:High-resolution bacterial 16S rRNA gene profile meta-analysis and biofilm status reveal common colorectal cancer consortia"
- ↑ "Journal of Cancer, avril 2017: Linking Gut Microbiota to Colorectal Cancer"
- ↑ "Futura santé:L’imagerie combinatoire pourrait diagnostiquer le cancer du côlon"
- ↑ (en) "Septembre 2018:Bacterial biofilm formation inside colonic crypts may accelerate colorectal carcinogenesis"
- ↑ (en) "Juin 2017, Trends in molecular Medicine:Bacterial Biofilms in Colorectal Cancer Initiation and Progres"
- ↑ "2017: Intestinal microbiota and colorectal cancer: a new aspect of research, p8/19"
- ↑ (en) "Decembre 2014:Microbiota organization is a distinct feature of proximal colorectal cancers"
- ↑ "New-York Times, 2018: Gut Microbes Combine to Cause Colon Cancer, Study Suggests"
- ↑ "Adecaso, cancer du côlon"
- ↑ "1995:De l'adénome au cancer colorectal : données récentes "
- ↑ (en) Ramani Soundararajan, Michelle M. Maurin, Jetsen Rodriguez-Silva et Gunjan Upadhyay, « Integration of lipidomics with targeted, single cell, and spatial transcriptomics defines an unresolved pro-inflammatory state in colon cancer », Gut, (ISSN 0017-5749 et 1468-3288, PMID 39658263, DOI 10.1136/gutjnl-2024-332535, lire en ligne, consulté le )
- ↑ « Cancers du côlon : les points clés - Cancer du côlon », sur www.e-cancer.fr
- « Cancer colorectal : modalités de dépistage et de prévention chez les sujets à risque élevé et très élevé », sur Haute Autorité de Santé (consulté le )
- ↑ Communiqué CNRS
- ↑ Travaux publiés en ligne dans PNAS, par Daniel Louvard (CNRS et centre de recherche de l'Institut Curie) et l'équipe Spýros Artavánis-Tsákonas) : (en) Silvia Frea et al. « Notch and Wnt Signals cooperatively control cell proliferation and tumorigenesis in the intestine » Proc. Natl. Acad. Sci. U S A., février 2009, Lire l'article en ligne (open access)
- (en-US) « Colorectal cancer statistics », sur WCRF International (consulté le )
- ↑ HAS, « Dépistage et prévention du cancer colorectal Actualisation du référentiel de pratiques de l'examen périodique de santé (EPS) », sur has-sante.fr,
- ↑ (en) Gur C, Ibrahim Y, Isaacson B, Yamin R, Mandelboim O et al., « Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack », Immunity, vol. 42, no 2, , p. 344-55. (PMID 25680274, DOI 10.1016/j.immuni.2015.01.010)
- ↑ « Comment une bactérie de notre bouche accélère la progression des cancers du côlon », Le Monde.fr, (lire en ligne, consulté le )
- « Red meat, processed red meats and the prevention of colorectal cancer », PUBLICATION DU CONSEIL SUPERIEUR DE LA SANTE N° 8858, Conseil Supérieur de la Santé, (consulté le ).
- ↑ Dans ce rapport, il faut entendre par « viande rouge » (principalement bœuf, porc, mouton ou agneau, mais aussi d’autres espèces animales à l’exception des volailles), la viande rouge fraîche qui n’a pas subi d’autres traitements que la réfrigération, congélation et/ou fragmentation pour être mélangée avec d’autres viandes rouges et du sel (ex. : hachis). La « charcuterie à base de viande rouge » est définie dans ce rapport comme étant la viande rouge, qui a subi un saumurage (le plus souvent par ajout de nitrite et/ou de nitrate) suivi d’un ou plusieurs traitements additionnels — dont le fumage — pour la conservation. Ceci concerne la plupart des charcuteries à l’exception des produits préparés exclusivement avec du poulet ou d’autres volailles. Dans ce contexte, cette définition diffère donc de la classification actuelle proposée dans l'encyclopédie et c'est particulièrement important pour la viande de porc qui est un facteur de risque de cancer au même titre que les autres viandes rouges alors qu'elle est habituellement considérée comme une viande blanche.
- ↑ Conseil Supérieur de la Santé, « Viande rouge, charcuterie à base de viande rouge et prévention du cancer colorectal, Résumé », Conseil supérieur de la santé, décembre 2013, janvier 2014, p. 3 (lire en ligne).
- ↑ (en) Véronique Bouvard, Dana Loomis, Kathryn Z Guyton et Yann Grosse, « Carcinogenicity of consumption of red and processed meat », The Lancet Oncology, vol. 16, no 16, , p. 1599–1600 (DOI 10.1016/s1470-2045(15)00444-1, lire en ligne, consulté le )
- ↑ (en) Relations between amount and type of alcohol and colon and rectal cancer in a Danish population based cohort study
- ↑ Institut National du Cancer - page alcool
- ↑ chimioprévention
- ↑ (en) Chan AT, Ogino S, Fuchs CS, Aspirin use and survival after diagnosis of colorectal cancer, JAMA, 2009;302:649-658.
- ↑ (en) Neil Murphy & al. (2013) Consumption of Dairy Products and Colorectal Cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC), 2013-09-02 ; DOI:10.1371/journal.pone.0072715
- ↑ (en) Jarvinen R, Knekt P, Hakulinen T, Aromaa A (2001) Prospective study on milk products, calcium and cancers of the colon and rectum. Eur J Clin Nutr 55: 1000–1007. doi: 10.1038/sj.ejcn.1601260
- ↑ « Cancer colon et rectum, stade TNM » SNFCP », sur SNFCP, (consulté le )
- ↑ (en) O'Connell JB, Maggard MA, Ko CY, « Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging », J Natl Cancer Inst, vol. 96, no 19, , p. 1420-5. (PMID 15467030, DOI 10.1093/jnci/djh275, lire en ligne [html])
- ↑ (en) Taux de survie des cancers colorectaux, sur cancer.org, consulté le 3 octobre 2016.
- ↑ (en) Tran B, Kopetz S, Tie J et al. Impact of BRAF mutation and microsatellite instability on the pattern of metastatic spread and prognosis in metastatic colorectal cancer, Cancer, 2011;117:4623-4632
- ↑ Haute Autorité de santé, Prise en charge des patients atteints de métastases hépatiques synchrones du cancer colorectal, mars 2011
- ↑ ASCO 2007
- ↑ (en) Jonker DJ, O'Callaghan CJ, Karapetis CS et al. « Cetuximab for the treatment of colorectal cancer » N Eng J Med. 2007;357:2040-2048
- ↑ Primrose JN, Perera R, Gray A et al. Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer, The FACS Randomized Clinical Trial, JAMA, 2014;311:263-270
- ↑ "Nbci, 2018:Circulating Cell-Free DNA and Colorectal Cancer: A Systematic Review"
- ↑ Dépistage du cancer colorectal grâce à l'odorat du chien (en) Hideto Sonoda, Shunji Kohnoe, Tetsuro Yamazato, Yuji Satoh, Gouki Morizono, Kentaro Shikata, Makoto Morita, Akihiro Watanabe, Masaru Morita, Yoshihiro Kakeji, Fumio Inoue, Yoshihiko Maehara, « Colorectal cancer screening with odour material by canine scent detection », Gut, vol. 60, no 6, , p. 814-819 (ISSN 1468-3288, PMID 21282130, DOI 10.1136/gut.2010.218305, lire en ligne, consulté le )
- ↑ "Octobre 2017:The oral microbiota in colorectal cancer is distinctive and predictive"
- ↑ "SFED: Le cancer colo-rectal"
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier
- Ressources relatives à la santé :
- Classification internationale des maladies oncologiques
- Classification internationale des soins primaires
- Diseases Ontology
- DiseasesDB
- Genetic and Rare Diseases Information Center
- Héritage mendélien chez l'humain
- ICD-10 Version:2016
- ICD9Data.com
- Medical Dictionary for Regulatory Activities Terminology
- MedlinePlus
- National Cancer Institute
- PatientLikeMe
- Store medisinske leksikon
- WikiSkripta
- Ressource relative à la recherche :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Classification TNM 2009 sur Oncolie