Concentration minimale inhibitrice
En microbiologie, la concentration minimale inhibitrice (CMI) est la plus faible concentration d'un produit chimique, généralement un médicament, qui empêche la croissance visible d'une ou de plusieurs bactéries. La CMI dépend du micro-organisme considéré, de l'être humain affecté (in vivo uniquement) et de l'antibiotique lui-même[1].
La CMI est déterminée en préparant des solutions du produit chimique in vitro à diverses concentrations croissantes, en incubant les solutions avec des groupes séparés de bactéries en culture et en mesurant les résultats en utilisant une méthode de dilution standardisée (agar ou microdilution). Les résultats se classent ensuite comme « sensible », « intermédiaire » ou « résistant » à un antimicrobien particulier en utilisant un point d'arrêt. Les points d'arrêt sont des valeurs convenues, publiées dans les directives d'un organisme de référence, comme le US Clinical and Laboratory Standards Institute (CLSI), la British Society for Antimicrobial Chemotherapy (BSAC) ou le Comité européen sur les tests de sensibilité aux antimicrobiens (EUCAST)[2]. On a pu constater des écarts importants au niveau des points d'arrêt de divers pays européens au fil des ans, et entre ceux de l'EUCAST et du CLSI[3].
Alors que la CMI est la concentration la plus faible d'un agent antibactérien nécessaire pour inhiber la croissance visible, la concentration bactéricide minimale (CBM) est la concentration minimale d'un agent antibactérien qui entraîne la mort bactérienne. Plus la CMI est proche de la CBM, plus le composé est bactéricide[4].
La première étape de la découverte d'un médicament est souvent le dépistage d'un médicament candidat de banque de données pour les CMI contre les bactéries d'intérêt[5]. En tant que tels, les CMI sont généralement le point de départ pour de plus grandes évaluations précliniques de nouveaux agents antimicrobiens[6]. Le but de la mesure de la concentration minimale inhibitrice est de s'assurer que les antibiotiques sont choisis efficacement pour augmenter le succès du traitement.
Contexte
modifierHistoire
modifierAprès la découverte et la commercialisation d'antibiotiques, le microbiologiste, pharmacologue et médecin Alexander Fleming développe la technique de dilution en bouillon en utilisant la turbidité du bouillon de culture pour l'estimation[7]. On pense généralement qu'il s'agit du moment de conception des concentrations minimales inhibitrices[8]. Plus tard dans les années 80, le Clinical and Laboratory Standards Institute a consolidé les méthodes et les normes pour la détermination des CMI et leur utilisation clinique. À la suite de la découverte de nouvelles molécules antibactériennes, de pathogènes et de leur évolution, les protocoles de CLSI sont également continuellement mis à jour pour refléter ce changement[9]. Les protocoles et les paramètres définis par le CLSI sont considérés comme la « référence absolue » aux États-Unis et sont utilisés par les autorités réglementaires, telles que la FDA, pour effectuer des évaluations[10].
Utilisation clinique
modifierDe nos jours, la CMI est utilisée dans les tests de sensibilité aux antimicrobiens. La CMI est indiquée en fournissant l'interprétation du niveau de sensibilité à côté de chaque antibiotique. Les différentes interprétations du niveau de sensibilité sont : S (sensible), I (intermédiaire) et R (résistant). Ces interprétations ont été créées et mises en œuvre par le Clinical and Laboratory Standards Institute (CLSI). Dans les cliniques, le plus souvent, l'identification exacte des pathogènes ne peut pas être facilement déterminée par les symptômes du patient. De plus, même si l'agent pathogène est déterminé, différents sérotypes d'agents pathogènes, tels que Staphylococcus aureus, possèdent différents niveaux de résistance aux antimicrobiens. En tant que tel, il est difficile de prescrire des antimicrobiens corrects[11]. Dans de tels cas, la CMI est déterminée en faisant croître l'isolat pathogène du patient sur une plaque (milieu solide) ou dans un bouillon (milieu liquide), qu'on utilise ensuite dans le test[12]. Ainsi, la connaissance de la CMI fournira au médecin des informations précieuses pour faire une prescription. L'utilisation exacte et précise d'antimicrobiens est également importante dans le contexte des bactéries multirésistantes. Les microbes tels que les bactéries ont au fil des années gagné en résistance aux antimicrobiens auxquels ils étaient auparavant sensibles[13]. L'utilisation d'antimicrobiens à des niveaux incompatibles ou inférieurs à la CMI fournit une pression sélective qui a accéléré l'évolution de la résistance des agents pathogènes bactériens[14]. En tant que tel, il est de plus en plus important de déterminer la CMI afin de faire le meilleur choix dans la prescription d'antimicrobiens.
En clinique, on préfère utiliser la CMI plutôt que la CBM parce que la CMI est plus facile à déterminer[9]. La concentration bactéricide minimale (CBM), qui est la concentration antibactérienne minimale entraînant la mort microbienne, est définie par l'incapacité de remettre les bactéries tuées en culture. De plus, l'efficacité du médicament est généralement similaire lorsqu'on le prend à la fois aux concentrations de CMI et de CBM car le système immunitaire de l'hôte peut expulser l'agent pathogène lorsque la prolifération bactérienne est à l'arrêt[15]. Lorsque la CBM est beaucoup plus élevée que la CMI, la toxicité du médicament rend la prise de la CBM du médicament préjudiciable au patient. La toxicité antimicrobienne peut prendre de nombreuses formes, telles que l'hypersensibilité immunitaire et la toxicité hors cible[16].
Méthodes
modifierTest de la dilution en bouillon
modifier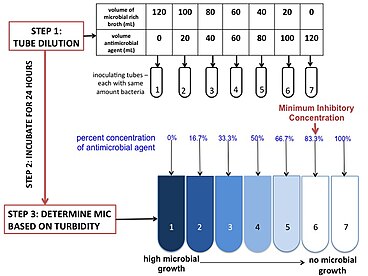
Trois réactifs principaux sont nécessaires pour exécuter ce test : un milieu de culture, un agent antimicrobien et le microbe que l'on veut tester. Le milieu le plus couramment utilisé est le bouillon de Mueller Hinton à cations ajustés, en raison de sa capacité à soutenir la croissance de la plupart des agents pathogènes et du fait qu'il ne contient pas d'inhibiteurs envers les antibiotiques courants[17]. Selon l'agent pathogène et les antibiotiques testés, le milieu peut être changé et/ou ajusté (au niveau de la concentration de ses composés). La concentration d'antimicrobiens est ajustée à la concentration correcte d'intérêt en mélangeant l'antimicrobien d'origine avec le milieu. L'antimicrobien ajusté est dilué en série dans plusieurs tubes (ou puits lorsqu'on travaille en microplaques) pour obtenir un gradient. Le taux de dilution peut être ajusté en fonction du point d'arrêt et des besoins du praticien. Le microbe, ou l'agent d'inoculation, doit provenir de la même unité formant colonie et doit être à la bonne concentration. Cela peut être ajusté par le temps d'incubation et la dilution. Pour vérification, le contrôle positif est repiqué sur plaque dans une dilution au centuple pour compter les unités formant colonie. On inocule les microbes dans les tubes (ou la plaque) et on les incube pendant 16 à 20 heures. La CMI est généralement déterminée par la turbidité : un milieu trouble signifiera que la culture a poussé et donc que la concentration n'est pas assez importante ; à l'inverse, un milieu transparent sera la preuve que la culture n'a pas poussé.
Tests epsilon
modifier
Les tests epsilon (Etests) peuvent également être utilisés comme méthode alternative pour déterminer les valeurs de CMI d'une large gamme d'agents antimicrobiens contre différents groupes d'organismes, qui a été largement utilisée dans les laboratoires de microbiologie du monde entier. Fabriquées par bioMérieux, les Etests sont des bandelettes réactives en plastique non poreuses prêtes à l'emploi avec un gradient d'antibiotique prédéfini, couvrant une plage de concentration continue[18].
Voir aussi
modifierNotes
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Minimum inhibitory concentration » (voir la liste des auteurs).
Références
modifier- McKinnon, PS and Davis, SL. Pharmokinetic and pharmacodynamic issues in the treatment of bacterial infectious diseases. in: VL Yu, G Edwards, PS McKinnon, C Peloquin, G Morse (Eds.) Antimicrobial therapy and vaccines, volume II: antimicrobial agents. ESun Technologies, Pittsburgh, PA; 2005: 5–19
- Andrews, « Determination of minimum inhibitory concentrations », Journal of Antimicrobial Chemotherapy, vol. 48, no suppl 1, , p. 5–16 (PMID 11420333, DOI 10.1093/jac/48.suppl_1.5)
- Seydina M Diene, Cédric Abat, Jean-Marc Rolain, Didier Raoult. How artificial is the antibiotic resistance definition? Lancet Infectious Diseases, Volume 17, No. 7, p690, July 2017. DOI: https://dx.doi.org/10.1016/S1473-3099(17)30338-9
- K.D. Tripathi, Essentials of Medical Pharmacology, New Delhi, India, , 7e éd., 696, 697 (ISBN 978-93-5025-937-5, lire en ligne)
- Turnidge JD, Ferraro MJ, Jorgensen JH (2003) Susceptibility Test Methods: General Considerations. In PR Murray, EJ Baron, JH Jorgensen, MA Pfaller, RH Yolken. Manual of Clinical Microbiology. 8th Ed. Washington. American Society of Clinical Microbiology. p 1103 (ISBN 1-55581-255-4)
- O'Neill et Chopra, I, « Preclinical evaluation of novel antibacterial agents by microbiological and molecular techniques. », Expert Opinion on Investigational Drugs, vol. 13, no 8, , p. 1045–63 (PMID 15268641, DOI 10.1517/13543784.13.8.1045)
- Fleming, Alexander, Sir 1881-1955., On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae, H.K. Lewis, (OCLC 25424051)
- Wheat, « History and development of antimicrobial susceptibility testing methodology », Journal of Antimicrobial Chemotherapy, vol. 48, no suppl_1, , p. 1–4 (ISSN 1460-2091, PMID 11420332, DOI 10.1093/jac/48.suppl_1.1)
- Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically : approved standard, Wayne, Pa, , 9e éd., 68 p. (ISBN 978-1-56238-784-6, OCLC 1016466655)
- Performance standards for antimicrobial susceptibility testing : twenty-second informational supplement, Wayne, PA, Clinical and Laboratory Standards Institute, , 184 p. (ISBN 978-1-56238-785-3, OCLC 795927370)
- Cameron, Howden et Peleg, « The Interface Between Antibiotic Resistance and Virulence in Staphylococcus aureus and Its Impact Upon Clinical Outcomes », Clinical Infectious Diseases, vol. 53, no 6, , p. 576–582 (ISSN 1058-4838, PMID 21865195, DOI 10.1093/cid/cir473)
- Antimicrobial susceptibility testing protocols, Boca Raton, CRC Press, , 432 p. (ISBN 978-1-4200-1449-5, OCLC 666899344, lire en ligne)
- World Health Organization, Global antimicrobial resistance surveillance system : manual for early implementation., Geneva, Switzerland, , 41 p. (ISBN 978-92-4-154940-0, OCLC 950637154)
- (en) Geisinger et Isberg, « Interplay Between Antibiotic Resistance and Virulence During Disease Promoted by Multidrug-Resistant Bacteria », The Journal of Infectious Diseases, vol. 215, no suppl_1, , S9–S17 (ISSN 0022-1899, PMID 28375515, PMCID 5853982, DOI 10.1093/infdis/jiw402)
- Gallagher, Jason C. author., Antibiotics simplified, , 352 p. (ISBN 978-1-284-11129-3, OCLC 952657550, lire en ligne)
- Guengerich, « Mechanisms of Drug Toxicity and Relevance to Pharmaceutical Development », Drug Metabolism and Pharmacokinetics, vol. 26, no 1, , p. 3–14 (ISSN 1347-4367, PMID 20978361, PMCID 4707670, DOI 10.2133/dmpk.DMPK-10-RV-062)
- Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically : approved standard, Wayne, Pa., Tenth, , 68 p. (ISBN 978-1-56238-783-9, OCLC 932608948)
- (en) « ETEST », bioMérieux (consulté le )