Fructose-6-phosphate
Le fructose-6-phosphate, parfois abrégé en Fru-6-P, est un composé organique qui se rencontre dans un très grand nombre de cellules vivantes sous forme de l'isomère β-D-fructose-6-phosphate. L'essentiel du glucose et du fructose métabolisé par la cellule est converti, à un moment ou à un autre, en fructose-6-phosphate.
| D-fructose-6-phosphate | |
  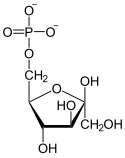 Structure du β-D-fructose-6-phosphate (en bas : projections de Fischer et de Haworth) |
|
| Identification | |
|---|---|
| Synonymes |
Fru-6-P |
| No CAS | |
| No ECHA | 100.010.360 |
| No CE | 211-395-6 |
| PubChem | 69507 |
| ChEBI | 15946 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H11O9P |
| Masse molaire[1] | 258,119 9 ± 0,008 3 g/mol C 27,92 %, H 4,3 %, O 55,79 %, P 12 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Rôle dans la glycolyse
modifierBiosynthèse
modifier

Glc-6-P Fru-6-P Glucose-6-phosphate isomérase – EC
Le α-D-glucose-6-phosphate produit au cours de la glycolyse est isomérisé en β-D-fructose-6-phosphate par la glucose-6-phosphate isomérase. Cette réaction est réversible, et demeure orientée vers la droite en raison de la concentration en Fru-6-P, maintenue assez faible en raison de sa consommation immédiate par l'étape suivante de la glycolyse.
Dégradation
modifier
+ ATP → ADP + H+ + 
Fru-6-P Fru-1,6-BP Phosphofructokinase-1 – EC
Le β-D-fructose-6-phosphate est phosphorylé en β-D-fructose-1,6-bisphosphate (Fru-1,6-BP) par la phosphofructokinase-1 à partir d'une molécule d'ATP, convertie en ADP. Cette consommation d'énergie rend cette étape irréversible, et constitue un point de régulation majeur de la vitesse de la glycolyse. Un cation Mg2+ intervient comme cofacteur.
Il existe, essentiellement chez des organismes autres que les animaux, des enzymes différentes capables de phosphoryler le D-fructose-6-phosphate à partir de pyrophosphate inorganique au lieu d'ATP. C'est le cas de la diphosphate fructose-6-phosphate 1-phosphotransférase (PFP), qu'on trouve chez de nombreuses plantes, certaines bactéries, des archées et des protistes. De rares archées possèdent une variante de la phosphofructokinase utilisant, cette fois, de l'ADP et non de l'ATP.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.


