Halocétone
En chimie organique, une halocétone, halogénocétone ou cétone halogénée est un groupe fonctionnel consistant en un groupe cétone ou plus généralement un groupe carbonyle avec un atome d'halogène substituant au moins l'un des carbones α. Leur formule semi-développée générale est donc R'R"C(X)C(=O)R, où R, R' R" sont des groupes alkyles ou aryles, et X un atome d'halogène.

La conformation préférentielle des halocétones est pseudo-cis avec l'halogène et le carbonyle partageant le même plan car l'encombrement stérique avec le groupe alkyle du carbonyle est généralement plus grand[1].
Synthèse
modifierLes halocétones et les composé halogénocarbonylés en général sont synthétisés par réaction entre le composés carbonylée et un agent d'halogénation :
- les halogènes, le dibrome et le dichlore produisent des monosubstitutions, le difluor des polysubstitutions
- le tribromure de tétrabutylammonium
- le N-bromosuccinimide
- la 1,3-dibromo-5,5-diméthylhydantoïne (en) (DBDMH)
Dans l'halogénation de Hell-Volhard-Zelinski, un acide carboxylique réagit avec les brome en présence du tribromure de phosphore. Dans la réaction de Nierenstein, un chlorure d'acyle réagit avec le diazométhane pour former une halocétone.
Synthèse asymétrique
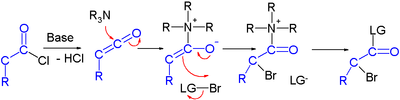
modifierDe nombreux efforts ont été faits pour développer des synthèses asymétriques d'halocarbonyles via des catalyses organiques (en). Dans une étude, un chlorure d'acyle est converti en α-halo-ester avec une base forte (hydrure de sodium), un donneur de brome et un catalyseur organique à base de proline et de quinine[2] :

Le mécanisme réactionnel proposé postule tout d'abord un conversion du chlorure d'acyle en cétène par la base, le catalyseur organique introduit ensuite la chiralité via la fonction amine tertiaire de son quininoïde, formant un adduit de céténe.
Réactions
modifierLes halocétones peuvent participer à plusieurs types de réaction. Face à une nucléophile, elles présentent deux sites électrophiles, et face aux bases, elles comportent plusieurs protons acides du fait des deux groupes électro-attracteurs. La liaison carbone-halogène connaît une accroissement de sa polarité du fait de l'effet inductif du groupe carbonyle, ce qui rend l'atome de carbone encore plus encore plus électropositif.
- Dans les réactions de substitution nucléophile aliphatique, la 1-chloro-2-propanone réagit plus rapidement que le chlorure de n-propyle avec l'iodure de potassium dans l'acétone, d'un facteur de 36 000.
- Dans le réarrangement de Favorskii, une base arrache un proton α acide ; le carbanion ainsi formé élimine ensuite l'halogène.
- La même séquence est observée dans la réaction de Bingel avec les fullerènes.
- Dans les aldolisations croisées entre halocétones et aldéhydes, le produit initial de la réaction est une halohydrine qui peut ensuite former un oxirane en présence d'une base.
- Les halocétonessont importantes dans la chimie des hétérocycles. On peut par exemple citer l'utilisation d'halocétones dans la synthèse de Hantzsch de pyrrole (en) et la synthèse de Hantzsch de thiazole.
- Les halocétones réagissent avec les phosphites par la réaction de Perkow.
- Le groupe halogène peut être retiré par dés-halogénation réductive des halocétones (en).
- Historiquement, le traitement des halocétones par la poussière de zinc dans la réaction de Réformatski fut la première méthode fiable de synthèse des énolates non-stabilisés. Cette méthode a depuis largement été rendue obsolète par l'usage de bases telles que le diisopropylamidure de lithium.
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Haloketone » (voir la liste des auteurs).
- (en) Ayman W. Erian, Sherif M. Sherif et Hatem M. Gaber, « The Chemistry of -Haloketones and Their Utility in Heterocyclic Synthesis », Molecules, vol. 8, , p. 793-865 (lire en ligne).
- (en) Cajetan Dogo-Isonagie, Tefsit Bekele, Stefan France, Jamison Wolfer, Anthony Weatherwax, Andrew E. Taggi, and Thomas Lectka, « Scalable Methodology for the Catalytic, Asymmetric -Bromination of Acid Chlorides », J. Org. Chem., vol. 71(23), , p. 8946-8949 (DOI 10.1021/jo061522l).