Hydroboration
L'hydroboration est une réaction de chimie organique transformant un alcène en alcool par utilisation de borane, elle fut découverte par Herbert C. Brown, chimiste britannique lauréat du Prix Nobel de chimie en 1979. L'hydrogène et le groupement hydroxyle se fixent en position cis réalisant ainsi une synhydroxylation. L'hydroboration est une réaction qui suit l'inverse de la règle de Markovnikov car l'alcool se trouve sur l'atome de carbone le plus hydrogéné (le moins substitué).
Le bilan global de la réaction est le suivant:
où THF désigne le tétrahydrofurane, solvant type associé à cette réaction.
Mécanisme
modifierRéactivité du Borane
modifierHistoriquement, Brown réalisa la première hydroboration en 1957 en synthétisant de l'hexan-1-ol à partir d'hex-1-ène.

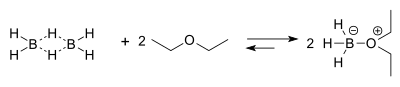
Le borane existe à l'état naturel sous sa forme dimérisé diborane, gaz incolore et toxique. Le diborane présente une liaison à trois centres et deux électrons, fait assez rare en chimie, non prévu par le modèle de Lewis lui permettant de satisfaire la règle de l'octet réduisant ainsi son électrophilie. Cependant ce dernier reste un acide de Lewis puissant grâce à son orbitale p vacante. La dimérisation du borane est instantané rendant impossible l'isolation de borane pur. Cependant, ce dernier traité dans l'éther ou dans une amine forme un complexe entre le doublet non-liant de l'oxygène ou de l'azote et la lacune du borane. Ce complexe possède les propriétés chimiques du borane. Les solutions de BH3 complexés dans l'éther ou dans le tétrahydrofurane sont plus facilement trouvables dans le commerce, et donc dans les laboratoires, que le diborane gazeux.
Mécanisme
modifierL'addition de borane sur l'alcène est une réaction concertée avec formations et ruptures de plusieurs liaisons simultanément. On peut visualiser l'étape intermédiaire en représentant un hypothétique état de transition de la façon suivante:

Tout en sachant que le bore sera plus tard remplacé par un groupement hydroxyle, cette étape peut être considérée comme déterminante dans le processus de régiosélectivité. Le bore se fixe en effet sur le carbone le moins substitué. Ceci est dû à la présence dans l'intermédiaire d'un carbocation sur le carbone le plus substitué dont la stabilité dépend justement de ces substituants. Cette étape se répète 3 fois de telle sorte que les 3 hydrogènes initialement présents sur le borane soient remplacés par les groupements alkyles issus des alcènes. Ainsi, on peut utiliser le 9-BBN qui ne comporte qu'un hydrogène réactif sur le bore, cette étape sera alors unique.
Oxydation
modifierAu cours d'une deuxième étape, un anion dérivant d'un hydroperoxyde (souvent l'eau oxygénée alcaline) réalise une attaque nucléophile sur l'atome de bore. Un groupement alkyle migre alors vers l'atome d'oxygène, la réaction se répétant autant de fois qu'il y a de groupements alkyles sur le bore. Finalement le composé obtenu est hydrolysé pour libérer les alcools formés.

Une animation du mécanisme:
Annexes
modifierArticles connexes
modifierLiens externes
modifier
- Ressource relative à la recherche :
- Notices dans des dictionnaires ou encyclopédies généralistes :

