Isotopes du neptunium
Le neptunium (Np) est un élément synthétique qui n'a par conséquent pas de masse atomique standard. Comme tous les éléments synthétiques, il ne possède aucun isotope stable. Le premier isotope synthétisé en 1940 fut le neptunium 239 (239Np) en bombardant 238U avec des neutrons pour produire 239U, qui subit ensuite une désintégration β pour former 239Np.
Descriptions
modifier20 radioisotopes du neptunium ont été caractérisés, le plus stable étant le neptunium 237 (237Np) avec une demi-vie de 2,14 millions d'années, suivi du neptunium 236 (236Np) avec une demi-vie de 154 000 ans et du neptunium 235 (235Np) avec une demi-vie de 396,1 jours. Tous les autres isotopes ont une demi-vie inférieure à 4,5 jours et la majorité inférieure à 50 minutes. Le neptunium possède aussi quatre isomères nucléaires, le plus stable étant 236mNp (t½ 22,5 heures).
Les isotopes du neptunium ont une masse atomique comprise entre 225,0339 u (225Np) et 244,068 u (244Np).
Le principal mode de désintégration pour les isotopes plus légers que 237Np, isotope le plus stable, est la capture électronique (avec aussi une bonne partie d'émission α), et pour les éléments plus lourds l'émission β. Les principaux produits de désintégration pour les isotopes légers sont des isotopes de l'uranium et du protactinium, ceux des isotopes plus lourds des isotopes du plutonium.
Isotopes notables
modifierNeptunium 235
modifierLe neptunium 235 (235Np) possède un noyau à 142 neutrons et 93 protons. Il a une demi-vie de 396,1 jours et une masse molaire de 235,044 063 3 g/mol. Cet isotope se désintègre :
- par capture électronique quasi exclusivement (à plus de 99,99% des cas), avec une énergie de désintégration de 0,125 MeV, produisant l'uranium 235 ;
- par émission de particule α, avec une énergie de désintégration de 5,2 MeV, produisant le protactinium 231.
Neptunium 236
modifierLe neptunium 236 (236Np) possède un noyau à 143 neutrons et 93 protons. Il a une demi-vie de 154 000 années et une masse molaire de 236,046 57 g/mol.
Il peut se désintégrer :
- par capture électronique, avec une énergie de désintégration de 0,95 MeV, produisant l'uranium 236 ;
- par émission de particule β, avec une énergie de désintégration de 0,94 MeV, produisant le plutonium 236 ;
- par émission de particule α, avec une énergie de désintégration de 5,024 MeV, produisant le protactinium 232.
C'est un matériau fissile, avec une masse critique de 6,79 kg[1].
Il peut être produit à partir de l'américium 240, par radioactivité α.
Neptunium 237
modifier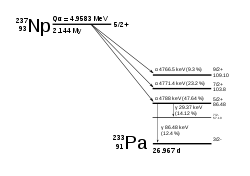
Le neptunium 237 (237Np) possède un noyau à 143 neutrons et 93 protons. Il a une demi-vie de 2,144 millions d'années.
237Np se désintègre selon la série du neptunium en thallium, contrairement à la plupart des actinides qui se désintègrent en isotopes du plomb.
Il a été montré récemment que 237Np peut entretenir une réaction en chaîne avec des neutrons rapides, comme dans une arme nucléaire[2]. Cependant, il a une faible probabilité de fission lorsqu'il est bombardé par des neutrons thermiques, ce qui rend inenvisageable de l'utiliser comme carburant dans un réacteur nucléaire.
237Np est le seul isotope du neptunium produit en quantité significative par dans le cycle du combustible nucléaire, à la fois et de façon successive par capture neutronique sur l'uranium 235 (qui subit des fissions la plupart du temps, mais pas tout le temps) et sur l'uranium 236, ou par réaction (n,2n) où un neutron rapide peut occasionnellement entrer en contact avec un neutron libéré par l'uranium 238 ou un des isotopes du plutonium. À long terme, 237Np se forme aussi à partir du combustible nucléaire usagé, comme produit de désintégration de l'américium 241.
237Np serait l'un des isotopes les plus mobiles dans le centre de stockage de déchets nucléaires de Yucca Mountain.
Dans l'environnement
modifierOrigines
modifierLe neptunium est présent sous forme de trace dans la nature, issu de la capture neutronique par des atomes d'uranium dans un réacteur nucléaire naturel.
Le 237Np a d'abord été principalement issu des retombées des essais nucléaires atmosphériques (par la capture de neutrons par l’uranium). L'activité des retombées au sol de 237Np produit à cette occasion a été évaluée à 4 × 1013 Bq pour l'hémisphère nord, avec une activité de 0,2 Bq m−2 estimée en Europe pour 1954-1983, mais l'IRSN rappelle que les données anciennes sont « incertaines du fait de méthodes de mesure peu performantes »[3] alors qu'on sait maintenant le doser à 0,1 mBq kg−1[3].
Depuis, la source principale (rejets de 237Np) est devenu le traitement du combustible nucléaire usé, avec par exemple pour 1999, les rejets de 237Np estimés à 2 × 108 Bq dans les effluents liquides rejetés en Manche par l'usine de La Hague[3] et à 3 × 1010 Bq en 1997 pour l'usine jumelle de Sellafield[3].
Radioécologie
modifierLes isotopes du neptunium sont tous radioactifs et émetteurs alpha (bien qu'également émetteurs β pour certains).
Une quantité significative de Np 239 a par exemple été libérée par la catastrophe de Fukushima en 2011 surtout trouvé dans le sol et les plantes (plus de 1 000 Bq/kg de sol), dès le premier mois ayant suivi l'accident et jusqu'à des dizaines de kilomètres de la centrale[4].
Les impacts environnementaux réels ou potentiels des isotopes du Np, ainsi que leurs cinétiques environnementale et métabolique sont mal connus.
L'IRSN a publié une fiche pédagogique sur le 237Np (celui qui a la plus longue période radioactive ; 2,14 × 106 ans, pour une activité massique de 2,61 × 107 Bq g−1) et l'environnement[3].
« relativement mobile dans l’environnement terrestre », il migre moyennement dans les sols (mieux en milieu acide), mais plus que ne le font le plutonium, l'américium ou le curium[3] qu'il peut donc devancer dans un panache de pollution souterraine. Selon l'IRSN, son « temps de résidence (demi-vie) dans l’horizon superficiel d’un sol cultivé de prairies est d’environ 4 à 8 ans »[3] et son « absorption racinaire augmente avec la diminution du pH »[3]. Il semble y avoir peu de données (quelques études sur des rats de laboratoires) sur les transferts du végétal à l'animal et sa cinétique dans les organismes. L'IRSN signale une « augmentation de l’absorption gastrointestinale du neptunium chez les femelles allaitantes »[3] et un transfert à la viande de bœuf qui serait « 100 fois plus important que pour les autres transuraniens »[3]. Faute de données, on suppose que son comportement dans l'environnement peut être comparé à celui du plutonium (bien qu'on ait montré qu'il migre plus vite dans les sols et que « en milieu marin (mer d'Irlande), l’adsorption sur les matières en suspension est moins importante que pour les autres transuraniens ; plus faible de deux à trois ordres de grandeur que pour le plutonium) » selon Coughtrey & Jackson, 1984 cités par IRSN[3] qui citent des analyses d'algues faites en aval en aval du site nucléaire de Hanford (Columbia river) laissant penser que les algues pourraient le bioaccumuler. Selon l'IRSN, en mer, la biodisponibilité du neptunium serait cependant moindre que celle d'autres transuraniens (par exemple « d’un ordre de grandeur inférieure à celle du plutonium »[3]).
Table des isotopes
modifier| Symbole de l'isotope |
Z (p) | N (n) | masse isotopique | Demi-vie | Mode(s) de désintégration[5],[n 1] |
Isotope(s)-fils[n 2] | Spin nucléaire |
|---|---|---|---|---|---|---|---|
| Énergie d'excitation | |||||||
| 225Np | 93 | 132 | 225,03391(8) | 3# ms [>2 µs] | α | 221Pa | 9/2-# |
| 226Np | 93 | 133 | 226,03515(10)# | 35(10) ms | α | 222Pa | |
| 227Np | 93 | 134 | 227,03496(8) | 510(60) ms | α (99,95 %) | 223Pa | 5/2-# |
| β+ (0,05 %) | 227U | ||||||
| 228Np | 93 | 135 | 228,03618(21)# | 61,4(14) s | β+ (59 %) | 228U | |
| α (41 %) | 224Pa | ||||||
| β+, FS (0,012 %) | (varié) | ||||||
| 229Np | 93 | 136 | 229,03626(9) | 4,0(2) min | α (51 %) | 225Pa | 5/2+# |
| β+ (49 %) | 229U | ||||||
| 230Np | 93 | 137 | 230,03783(6) | 4,6(3) min | β+ (97 %) | 230U | |
| α (3 %) | 226Pa | ||||||
| 231Np | 93 | 138 | 231,03825(5) | 48,8(2) min | β+ (98 %) | 231U | (5/2)(+#) |
| α (2 %) | 227Pa | ||||||
| 232Np | 93 | 139 | 232,04011(11)# | 14,7(3) min | β+ (99,99 %) | 232U | (4+) |
| α (0,003 %) | 228Pa | ||||||
| 233Np | 93 | 140 | 233,04074(5) | 36,2(1) min | β+ (99,99 %) | 233U | (5/2+) |
| α (0,001 %) | 229Pa | ||||||
| 234Np | 93 | 141 | 234,042895(9) | 4,4(1) j | β+ | 234U | (0+) |
| 235Np | 93 | 142 | 235,0440633(21) | 396,1(12) j | CE (99,9974 %) | 235U | 5/2+ |
| α (0,0026 %) | 231Pa | ||||||
| 236Np | 93 | 143 | 236,04657(5) | 1,54(6) × 105 a | CE (87,3 %) | 236U | (6-) |
| β− (12,5 %) | 236Pu | ||||||
| α (0,16 %) | 232Pa | ||||||
| 236mNp | 60(50) keV | 22,5(4) h | CE (52 %) | 236U | 1 | ||
| β− (48 %) | 236Pu | ||||||
| 237Np[n 3],[n 4] | 93 | 144 | 237,0481734(20) | 2,144(7) × 106 a | α | 233Pa | 5/2+ |
| FS (2 × 10−10 %) | (varié) | ||||||
| DC (4 × 10−12 %) | 207Tl 30Mg | ||||||
| 238Np | 93 | 145 | 238,0509464(20) | 2,117(2) j | β− | 238Pu | 2+ |
| 238mNp | 2300(200)# keV | 112(39) ns | |||||
| 239Np | 93 | 146 | 239,0529390(22) | 2,356(3) j | β− | 239Pu | 5/2+ |
| 240Np | 93 | 147 | 240,056162(16) | 61,9(2) min | β− | 240Pu | (5+) |
| 240mNp | 20(15) keV | 7,22(2) min | β− (99,89 %) | 240Pu | 1(+) | ||
| TI (0,11 %) | 240Np | ||||||
| 241Np | 93 | 148 | 241,05825(8) | 13,9(2) min | β− | 241Pu | (5/2+) |
| 242Np | 93 | 149 | 242,06164(21) | 2,2(2) min | β− | 242Pu | (1+) |
| 242mNp | 0(50)# keV | 5,5(1) min | 6+# | ||||
| 243Np | 93 | 150 | 243,06428(3)# | 1,85(15) min | β− | 243Pu | (5/2-) |
| 244Np | 93 | 151 | 244,06785(32)# | 2,29(16) min | β− | 244Pu | (7-) |
- Abréviations :
DC : désintégration par émission de cluster ;
CE : capture électronique ;
TI : transition isomérique ;
FS: fission spontanée. - Isotopes stables en gras.
- Isotope fissile.
- Isotope le plus commun.
Remarques
modifier- Les valeurs marquées # ne sont pas purement dérivées des données expérimentales, mais aussi au moins en partie à partir des tendances systématiques. Les spins avec des arguments d'affectation faibles sont entre parenthèses.
- Les incertitudes sont données de façon concise entre parenthèses après la décimale correspondante. Les valeurs d'incertitude dénotent un écart-type, à l'exception de la composition isotopique et de la masse atomique standard de l'IUPAC qui utilisent des incertitudes élargies.
Références
modifier- (en) Final Report, Evaluation of nuclear criticality safety data and limits for actinides in transport, Institut de Radioprotection et de Sûreté Nucléaire, Département de Prévention et d'étude des Accidents.
- (en) P. Weiss, « Little-studied metal goes critical - Neptunium Nukes? », Science News, (consulté le )
- IRSN Fiche radionucléide ; 237Np et l'environnement
- Katsumi Shozugawa, Norio Nogawa, Motoyuki Matsuo (20122), Deposition of fission and activation products after the Fukushima Dai-ichi nuclear power plant accident ; Environmental Pollution, Volume 163, April 2012, Pages 243-247 (résumé)
- (en) Universal Nuclide Chart
- Masse des isotopes depuis :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- Compositions isotopiques et masses atomiques standards :
- (en) J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor, « Atomic weights of the elements. Review 2000 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 75, no 6, , p. 683–800 (DOI 10.1351/pac200375060683, lire en ligne)
- (en) M. E. Wieser, « Atomic weights of the elements 2005 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 78, no 11, , p. 2051–2066 (DOI 10.1351/pac200678112051, résumé, lire en ligne)
- Demi-vies, spins et données sur les isomères sélectionnés depuis les sources suivantes :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- (en) National Nuclear Data Center, « NuDat 2.1 database », Brookhaven National Laboratory (consulté en )
- (en) N. E. Holden et D. R. Lide (dir.), CRC Handbook of Chemistry and Physics, CRC Press, , 85e éd., 2712 p. (ISBN 978-0-8493-0485-9, lire en ligne), « Table of the Isotopes », Section 11
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Isotopes of neptunium » (voir la liste des auteurs).
Voir aussi
modifierArticles connexes
modifier
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |