Sapajus apella
Capucin brun, Sapajou apelle, Capucin à houppe noire
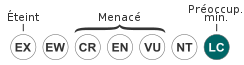
Statut CITES
Le Capucin brun (Sapajus apella) est une espèce de primates d'Amérique du Sud relativement communs au Brésil. Son alimentation est constituée de fruits, de germes, de feuilles et d'insectes.
Noms vernaculaires
modifierLe Capucin brun[1],[2],[3] est nommé aussi Sapajou apelle, Sajou noir, Sajou apelle[4] ou Capucin à houppe noire[5].
En Guyane (seul territoire francophone où il vit naturellement à l'état sauvage), il porte les noms de Capucin brun (français), macaque noir (créole), Ka'i (wayãpi, Teko), Meku (wayana, Kali'na), Fodi ou Howâ (Arawak)[6], Keskesi (nenge tongo), Mongi (Aluku tongo), Maka-kou (Saramaka) et Macaco prego (portugais du Brésil)[2],[3].
Ailleurs, on l'appelle Brown tufted capuchin ou guianan tufted capuchin (anglais), Macaco prego au Brésil, Nakú-jabu (langue des Warao, Venezuela), Mutsaap, bruine rolstaartaap ou keskesi au Suriname.
Il serait aussi parfois désigné en français sous les noms de Apelle, sapajou de Guyane, sapajou brun, sapajou cornu ou par les noms génériques sajou, saï[réf. nécessaire].
Description
modifier
Silhouette bréviligne, présence d’une crête sagittale chez le mâle adulte, ouverture nasale plus haute que large, front bombé, canines relativement courtes et épaisses, base de la mandibule irrégulière, caryotype : 2n = 54 (caractéristiques valables pour tous les sapajous). Chez les Sapajus, la femelle dispose d’un clitoris allongé semblable à un pénis et d’un os clitoridien. Vertèbres (pour tous les cébidés) : cervicales (7), thoraciques (12), lombaires (5,5), sacrales (3) et caudales (26).
On ne constate pas de dimorphisme sexuel marqué chez cette espèce, même si le mâle est généralement plus lourd que la femelle. La crête sagittale du mâle adulte est peu développée, le pelage court et soyeux, les épaules marron, un vandyke et parfois jaunes (plus souvent jaunes au nord qu’au sud de l’Amazone). Dos, croupe et flancs marron vandyke. Raie dorsale marron noirâtre, nette, continue (i.e. depuis la couronne jusqu’à l’extrémité de la queue), contrastante, plus large au niveau de la croupe. Ventre, thorax et gorge marron roussâtre. Surface latérale des bras bicolore, jaune en haut et noir en bas. Surface médiale des bras et des jambes marron roussâtre. Surface latérale des jambes marron vandyke. Queue marron noirâtre dessus et dessous, avec un pinceau noir contrastant. Queue préhensile portée avec un enroulement serré vers le bas à son extrémité (d’où son nom anglais de ringtail). Nuque noire. Couronne noire se prolongeant en triangle au milieu du front, avec de petites touffes érigées en forme de corne. Ces petites touffes sont plus souvent présentes chez les spécimens vivant au nord de l’Amazone qu’au sud. Les touffes sont souvent plus proéminentes chez les individus dominants, elles ont tendance à se réduire et à s’aplatir chez les individus âgés. Les femelles présentent plus souvent des touffes que les mâles (d’après C. Torres). Reste du front et tempes clairs formant un « arc gothique » de part et d’autre de la tête. Favoris et tract préauriculaire noirs (les favoris forment collier en se réunissant de chaque côté sous le menton, les tracts sont reliés à la couronne). Sourcils marqués (cette fois, plus souvent au sud qu’au nord de l’Amazone). Face brun gris clair. Barbe moyenne.
Cas d’albinisme total. Les variations individuelles par rapport au patron modal sont importantes (le dos peut être marron, marronnasse voire marron clair ; la région scapulaire peut être jaune roussâtre, marron roussâtre, jaune, marron jaune ou marron clair ; la raie dorsale peut être plus ou moins large ; le ventre peut être châtaigne roussâtre, marron pur ou orangé ; la calotte peut être marron sombre et plus ou moins étendue et les touffes petites ou grandes, pieds et mains sombres ou claires, barbe plus ou moins importante et plus ou moins sombre).
Mensurations
modifierCorps de 38 à 43 cm. Queue de 40 à 45 cm. Poids de 3,5 à 4 kg (jusqu’à 4,8 kg) pour le mâle et de 2,5 à 3 kg (jusqu’à 3,4 kg) pour la femelle. Cerveau : 71 g. Rapport longueur bras/jambes (x100) : 82. Caryotype : 2n = 54.
Comportements basiques
modifierDiurne. Arboricole. Opportuniste.
Alimentation
modifier

Généraliste opportuniste. Quasi-omnivore à tendance frugivore. Budget alimentaire (d’après J. F. Eisenberg) : fruits (66 %), graines (25 %), moelle des plantes (7 %), nectar (1 %) et proies (1 %). Il mange des fourmis, des guêpes, des mille-pattes et des scorpions. Il recherche les insectes dans les basse et moyenne strates de la forêt. Dans le Parc national de Jaú, au cœur de l’igapó, il se régale des gros vers cachés dans les troncs des palmiers Leopoldinia. Il s’attaque parfois aux reptiles, aux grenouilles sur les tiges de bambou, aux oiseaux, aux écureuils (Sciurus aestuans) jeunes et adultes, aux rats, aux chauves-souris et même aux petits opossums. Ses proies peuvent peser jusqu’à 900 g. En Amazonie orientale, on l’a observé en train de se nourrir de crabes et même capturer un jeune titi (Callicebus sp.).
Grâce à sa puissante mâchoire, le sapajou se nourrit de fruits à péricarpe coriace que sont incapables d’ouvrir les autres capucins (C. (C.) albifrons et olivaceus), leurs rivaux amazoniens, et c’est là l’un des points clés de son éclatant succès en Amazonie (à l’ouest du Guyana, où de tels fruits sont rares, il est en revanche absent alors qu’il est présent à l’est où abondent les palmiers kokerite (Attalea spp.). Si les fruits sont encore plus durs, il les frappe contre des branches. Au Suriname (Réserve naturelle de Raleighvallen sur la Coppename et Saramacca), il est ainsi assez habile pour briser les coques « inattaquables » des fruits des lécythidacées - une famille d’arbres abondamment représentée dans les vieilles forêts au sol pauvre du Bouclier guyanais) - en les cognant contre la boursouflure plane d’une grosse branche ou un tronc à l’aide d’une main pour les petits (Eschweilera longipes, Lecythis corrugata), des deux mains pour les plus gros (Couratari stellata, Couratari guianensis, Gustavia hexapetala, Lecythis davisii, Cariniana micrantha) voire en les frappant à l’aide d’un bâton (Couratari oblongifolia). Fait de même avec les capsules de Pachira aquatiqua, Cynometra spp., Vouacapoua americana, Hymenaea courbaril, Capparis maroniensis, Carapa procera et Phenakospermum guyannense. Il lui faut plus d’une demi-heure et plus d’une centaine de coups pour venir à bout d’une noix du Brésil (Bertholletia excelsa) : il donne 5 à 8 coups à la suite, inspectant ensuite les éventuelles fissures occasionnées et mâchonnant la moindre surface endommagée. Il apprend les techniques d’ouverture en 2-3 ans.
En Colombie (espèce C. (S.) macrocephalus), où les sols sont plus récents et fertiles que dans le Bouclier guyanais, les lécythidacées ne sont pas dominantes et la prédation de leurs graines se limite à deux espèces, le membrillo (Gustavia superba) et la sachamangua (Grias haughtii).
Dans la Réserve naturelle des Nouragues, il consomme les fruits de l’envira (Duguetia surinamensis), l’ambelanier acide (Ambelania acida), l’apocynacée Lacmellea aculeata, le dukali (Parahancornia fasciculata), le tapirira (Tapirira obtusa), le philodendron Philodendron insigne, le counana (Astrocaryum paramaca), le palmier pêcher (Bactris acanthocarpoides), le palmier maripa (Maximiliana maripa), l’ananas fleur (Ananas nanus), le canfin (Tetragastris panamensis), les wapa (Eperua spp.), le pouroumier tomenteux (Pourouma tomentosa), les gaulettes licania (Licania alba et L. latifolia), les cyclanthacées Ludovia lancifolia et Stelestylis surinamensis, l’arenillo (Dendrobangia boliviana), l’umarí de Guyane (Poraqueiba guianensis), le mahot (Eschweilera spp.), le canari macaque (Lecythis persistens), l’oranger du singe (Strychnos sp.), sept espèces d’ingá (Inga spp.), la bagasse (Bagassa guianensis), l’amourette (Brosimum guianensis), la passiflore (Passiflora crenata) aux fruits jaunes, la polygalacée Moutabea guianensis, le maripoil (Duroia eriopila), le « goyavier » du singe (Posoqueria latifolia), le pitoulier (Talisia sp.), les balatas pommes (Chrysophyllum spp.), le jaune-d’œuf (Ecclinusa lanceolata), le balata franc (Manilkara bidentata), les mamantin (Micropholis spp.), les poutériers (Pouteria spp.), la sapotacée (Pradosia ptychandra), le kobe (Sterculia frondosa), le cacaoyer de montagne (Theobroma subincanum) et l’achocon (Leonia glycycarpa).
Sur l’île de Margarita, il consomme 45 espèces de plantes de 24 familles, principalement des moracées, palmacées et broméliacées, ainsi que de nombreux insectes (fourmis, guêpes, sauterelles, scarabées, réduves).
Activité
modifierRéputé pour son intelligence qui s’expliquerait partiellement par son mode d’alimentation. Il casse les dures noix de palme en les frappant contre une branche, utilise des pierres pour ouvrir les coquilles et des outils rudimentaires pour faire sauter l’écorce des arbres. Frapper, frotter et faire levier sont des activités courantes chez cet animal. Il jette, secoue et transporte divers aliments et objets. Prend dans chaque main un fruit ou un escargot et les cogne l’un contre l’autre. Les premières observations de recours à l’outil en captivité remonte au moins à 1794 avec Erasmus Darwin, le grand-père du célèbre Charles. En captivité, des observations récentes ont montré que des individus jettent parfois des aliments à des groupes voisins dans le but avéré de partager la nourriture (cf. aussi encadré). S. J. Suomi rapporte le cas d’un sapajou se servant de deux fragments d’os comme d’un marteau et d’une enclume, alors que l’on pensait l’utilisation coordonnée de deux outils réservée au seul chimpanzé. Dans le parc zoologique de Goiânia (Brésil), on a observé un sapajou en train de pêcher et capturer des poissons à l’aide d’un appât. On ne sait si la captivité induit de tels comportements ou si au contraire elle doit inciter les chercheurs à chercher davantage à repérer de tels événements dans la nature. Toutefois, le sapajou, aussi évolué et malin soit-il, ne se reconnaît pas dans un miroir et l’on peut penser qu’il ne dispose pas d’une représentation de lui-même suffisamment différentielle pour qu’on puisse la nommer conscience.
Locomotion : Quadrupède. Sauteur. Suspension. Queue préhensile. Budget de locomotion (d’après Gebo) : déplacement quadrupède (86 %), sauts (7 %), grimper (6,5 %) et autres (0,5 %).
Structure sociale et système de reproduction
modifierGroupe multimâle-multifemelle. Polygamie.
Taille du groupe : 11 (de 1 à 20). 14 (Réserve naturelle de Brownsberg, Suriname).
Hiérarchie
modifierLe groupe social est généralement placé sous l’autorité d’un grand mâle âgé au regard de « tueur » et à la mine franchement patibulaire, possédant beaucoup de pouvoir. Par exemple il contrôle l’accès aux sites d’alimentation, davantage que chez les autres espèces de capucin (cette espèce évolue sur des arbres de taille modeste, plus facilement monopolisables). Le système social y est moins égalitaire, plus despotique. Même s’il existe une certaine tolérance entre mâles, la hiérarchie apparaît clairement. La majorité des décisions reviennent au maître qui joue aussi le rôle de protecteur et de sentinelle. C’est lui qui attaque le premier lors d’une interaction agressive avec un autre groupe (ce qui reste rare). C’est lui qui reste en première ligne en cas d’attaque d’un prédateur aérien. Il est le centre d’attraction. Un grand nombre de jeunes des deux sexes se retranchent derrière la star et forme des alliances stratégiques. En captivité, on observe un comportement qui confirme ce statut de star : à la tombée du jour, le mâle dominant descend à terre, les bras étendus et se laisse assaillir par les jeunes de la troupe. Parfois, c’est lui qui les attaque... Cette séance de jeu spectaculaire, qui regroupe plus d’une dizaine de participants, s’organise autour du leader.
Si une querelle éclate sur un arbre, ce sont le dominant et ses amis tolérés qui mangent les premiers. Tout contrevenant risque d’être rabroué. Le dominé ramasse le corps et baisse la tête en signe de soumission. Dans une troupe en mouvement, le dominant et consorts occupent la deuxième ligne, juste en arrière des éclaireurs qui sont souvent des femelles appréciées par le dominant accompagnées de leurs petits. Cette position stratégique leur permet à la fois de profiter des trouvailles des éclaireurs et de bénéficier de la vigilance des singes périphériques plus exposés à d’éventuels prédateurs. Les individus de moindre rang sont des adultes non tolérés à proximité et des subadultes. Ils voyagent en périphérie, à la traîne voire à l’écart de la troupe, ajustant sans cesse leur position par rapport à celle du dominant afin d’éviter à tout prix l’agression. Ils s’alimentent en dernier sur l’arbre nourricier.
Dispersion
modifierFemelle philopatrique. Le mâle émigre.
Reproduction
modifier
Cycle œstral : 18 jours. Œstrus : 2 à 4 jours. La femelle en chaleur ne présente aucun renflement. Durant les douze premiers jours, les femelles suivent et sollicitent constamment le mâle alpha avec des postures (approches suggestives), des gestes d’invite (elles touchent parfois le mâle, poussent son arrière-train ou lui mordent la queue.), des expressions faciales (relèvement les sourcils et du scalpet avec grimace) et des vocalisations particulières (sifflement doux et prolongé évoluant en un cri aigu trillé et puissant). La femelle attend que le mâle lui réponde de la même manière et l’accompagne, ce qui est loin d’être toujours le cas (il montre souvent peu d’intérêt voire une légère intolérance vis-à-vis de ces comportements). Celui-ci ne daigne copuler qu’une fois par jour. Après moult attouchements, les partenaires s’accouplent en position dorsoventrale. Après la copulation, cette espèce pratique la monte réciproque : à son tour, la femelle enlace le mâle à la taille et chevauche le bas du dos. Lors des deux derniers jours de chaleur, le mâle dominant resserre sa garde autour des femelles, éloignant les subordonnés. Mais dès qu’il relâche son attention, elles en profitent pour s’accoupler avec un autre prétendant, si bien qu’il ne peut être tout à fait certain de sa paternité. Le mâle alpha volera au secours d’un petit (qu’il estime avoir engendré) mais se montrera plus agressif envers les jeunes nés avant son arrivée au pouvoir.
Longévité
modifier20 ans, dans la nature. Jusqu’à 45 ans, en captivité.
Communication orale
modifierRiche répertoire vocal. L’appel le plus audible est le cri d’alarme émis à la vue d’un prédateur terrestre : un son haut perché précède un "chuck !" sonore. À la vue d’un aigle, le mâle alpha émet un puissant aboiement en restant à découvert tandis que le reste de la troupe s’enfuit.
L’appel le plus fréquent est une note de contact brève et nasale, semblable à un geignement de nourrisson affamé, que le primate émet lorsqu’il part en quête d’aliments dispersés (essentiellement des arthropodes). Les autres vocalisations incluent des appels de détresse (individu isolé ou jeune se sentant perdu), des trilles et des cris plaintifs. Il existe trois types de vocalisations agressives et la femelle en chaleur (lorsqu’elle suit langoureusement le mâle) sélectionne son propre mode de communication orale et visuelle. En captivité, les gloussements flûtés "woo-woo-woo-wooooo-woooooo" et les hurlements d’excitation des sapajous peuvent s’avérer particulièrement assourdissants !
Communication visuelle
modifierMouvements de tête. Écarquillement des yeux. Exhibition des dents.
Communication olfactive
modifierDépose de l’urine dans ses mains puis les frotte contre sa fourrure. Ce pourrait être un moyen pour les mâles de prévenir les femelles de leur maturité sexuelle.
Communication tactile
modifierLe toilettage social constitue un moment fort chez toutes les espèces de Sapajus, il renforce les liens et apaise les tensions (en captivité, les capucins bruns se réconcilient parfois après un combat, plus rarement à la suite d’une querelle hiérarchique).
Habitat et répartition
modifierDistribution
modifierNord et centre nord de l’Amérique du Sud. Incomplètement connue. Extrême sud du Venezuela au sud de l’Orénoque (État de Bolívar), à proximité du delta de l’Orénoque et sur l’île de Margarita dans ce même pays. Moitié est du Guyana (à l’est des Rios Rupununi et Essequibo), Suriname et Guyane française. Nord du Brésil (États de l’Amapá, Roraima, Amazonie, Rondônia, Mato Grosso, Pará, Maranhão et peut-être Tocantins), au nord-ouest depuis le Rio Negro et l’Orénoque, au sud-ouest le long du Rio Madeira vers le Rondônia jusqu’au Río Guaporé et au nord-est jusqu’à l’embouchure du Rio Itapicuru (limite de la forêt amazonienne, dans le Nordeste).
C’est peut-être l’espèce qui est présente au nord et centre de la Bolivie ainsi que dans l’interfluve Rio Negro-Rio Japurá jusqu’à l’extrême sud-est de la Colombie.
Habitat
modifierDivers. Forêt pluviale de plaine, de prémontagne et de petite montagne (Guyanes et Brésil), dont forêt de wapa et forêt marécageuse mésophile à mora (Mora excelsa). Au Suriname, il habite au moins cinq types de forêt différents : forêt pluviale de montagne, forêt pluviale de plaine, savane montagneuse, forêt de lianes et forêt marécageuse de palmier pinot (Euterpe oleracea). Llanos à saison sèche (Venezuela). Forêt de palmiers Cocais et forêt de palmiers babaçua, cerrado, caatinga (Brésil). Mangrove.
Domaine
modifierDe 25-40 ha jusqu’à 3,5 km2.
Densité
modifier19 km−2 (Réserve naturelle de la Trinité), de 5,7 à 24,4 km−2 (forêts de la Counami) et 15 km−2 (Réserve naturelle des Nouragues), en Guyane française.
Interaction écologique
modifierSympatrie et association
modifierS’associe au saïmiri commun (Saimiri sciureus), durant plusieurs heures (57,6 % de la journée à Raleighvallen), ce qui accroît l’efficacité alimentaire et la défense antiprédateur. On le rencontre aussi avec le saki à barbe (Chiropotes satanas), l’ouakari à tête noire (Cacajao melanocephalus) et certains ouistitis (Mico spp.).
Prédateurs
modifierRapace. En Guyane, il figure en deuxième place au menu de la Harpie féroce (Harpia harpyja).
Histoire de l'espèce et systématique
modifierL’ensemble du groupe des sapajous et capucins a été révisé en 2001 par José de Sousa e Silva Júnior.
Depuis 2012, la systématique a été revue et cette espèce est désormais considérée comme appartenant au genre Sapajus[7],[8].
Sous-espèces
modifierLa division en espèces et en sous-espèces des singes du genre Cebus est loin d'être consensuelle.
| Selon Groves (2005)[9] | Selon Rylands et Mittermeier (2009)[10] |
|---|---|
|
|
Le sapajou de l’île de Margarita (Cebus apella margaritae) serait confiné dans la région montagneuse de l’est de l’île de Margarita au large de Cumana (Venezuela).
L'espèce et l'homme
modifierMenaces
modifierDéforestation. Chasse. Trafic. Ils parvient à survivre dans les forêts secondaires ou dégradées et se montre difficile à chasser malgré ses mœurs bruyantes, car véloce et prompt à donner l’alarme. Grâce à son excellente vue, il détecte les chasseurs de loin. Toutefois, le sapajou de l’île de Margarita (C. a. margaritae), chassé comme nuisible pour cause de pillages dans les plantations de maïs et de canne à sucre, capturé comme animal de compagnie et concurrencé par le Capucin olive (C. olivaceus) introduit, pourrait disparaître à brève échéance de son île-refuge.
Conservation
modifierSapajou de l’île de Margarita (C. a. margaritae) : Parc national de Cerro El Copey (Venezuela).
Sapajou des Guyanes (C. (S.) a. apella) : Parc national de Duida-Marahuaca (es) et Parc national Parima Tapirapecó (Venezuela). Réserve naturelle de Brownsberg et Réserve naturelle du Suriname central (Suriname). Parc amazonien de Guyane, RN des Nouragues (Guyane française). Réserve de Cujubim, Parc national de Jaú et PE de Cuieiras (État d’Amazonie), Parc national de Tumucumaque (État de l’Amapá), Parc national de l'Amazonie et Fazenda Arataú (État du Pará), SE de Samuel (État du Rondônia), au Brésil. Refuge de Huanchaca, Réserve de Biosphère du Béni (es), Forêts de Chimanes et Rfa, des Rios Blanco y Negro (limite australe de l’espèce), en Bolivie – les spécimens boliviens sont peut-être des macrocephalus.
Statut
modifierSapajou de l’île Margarita (C. a. margaritae) : En danger critique d’extinction.
Réglementation en Guyane
modifier
Assez commun en Guyane, le macaque noir est autorisé à la chasse à raison d'un quota de 2 individus par personne et par sortie[11] mais n'est pas autorisé au commerce[12].
Aide aux handicapés
modifierCette espèce a été retenue pour les expériences d'aide simienne aux handicapés tétraplégiques.
Notes et références
modifier- Meyer C., ed. sc., 2009, Dictionnaire des Sciences Animales. consulter en ligne. Montpellier, France, Cirad.
- Éric Hansen et Cécile Richard-Hansen, Faune de Guyane. 2e édition, édition Roger Le Guen, (ISBN 978-2-9514396-1-0, lire en ligne)
- « Sapajus apella (Linnaeus, 1758) », Inventaire national du patrimoine naturel, (consulté le )
- (en) Murray Wrobel, Elsevier's Dictionary of Mammals : in Latin, English, German, French and Italian, Amsterdam, Elsevier, , 857 p. (ISBN 978-0-444-51877-4, lire en ligne), entrée N°977.
- Utilisation de singes capucins comme aide aux personnes tétraplégiques par le Département de Psychologie sur le site de la Facultés Notre-Dame de la Paix à Namur, consulté en nov 2011
- Marie-France Patte, La langue arawak de Guyane : présentation historique et dictionnaires arawak-français et français-arawak, Marseille, IRD, , 458 p. (ISBN 978-2-7099-1715-5, lire en ligne)
- (en) Jessica W. Lynch Alfaro, Jean P. Boubli, Link E. Olson et Anthony Di Fiore, « Explosive Pleistocene range expansion leads to widespread Amazonian sympatry between robust and gracile capuchin monkeys », Journal of Biogeography, vol. 39, no 2, , p. 272–288 (ISSN 0305-0270, DOI 10.1111/j.1365-2699.2011.02609.x, lire en ligne, consulté le )
- (en) JESSICA W. LYNCH ALFARO, JOSÉ DE SOUSA E SILVA et ANTHONY B. RYLANDS, « How Different Are Robust and Gracile Capuchin Monkeys? An Argument for the Use of Sapajus and Cebus », American Journal of Primatology, vol. 74, no 4, , p. 273–286 (ISSN 0275-2565, DOI 10.1002/ajp.22007, lire en ligne, consulté le )
- (en) Colin P. Groves, « Order Primates », dans Wilson, D.E. & Reeder, D.M., Mammal Species of the World : Third Edition, Baltimore, Johns Hopkins University Press, , p. 111–184.
- (en) Anthony B. Rylands et Russel A. Mittermeier, « The Diversity of the New World Primates (Platyrrhini): An Annotated Taxonomy », dans Garber, P. A., Estrada, A., Bicca-Marques, J. C., Heymann, E. W. & Strier, K. B., South American Primates : Comparative Perspectives in the Study of Behavior, Ecology, and Conservation, Springer, (ISBN 978-0-387-78704-6, lire en ligne)
- « Les quotas de chasse en Guyane », Office national de la chasse et de la faune sauvage, (consulté le )
- G. Simon, « Arrêté du 27 mars 1995 portant réglementation du commerce des espèces non domestiques en Guyane. Version consolidée au 13 décembre 2016 », Journal officiel : textes législatifs et réglementaires, (lire en ligne)
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- (en) Référence Mammal Species of the World (3e éd., 2005) : Cebus apella
- (en) Référence Catalogue of Life : Sapajus apella (Linnaeus, 1758) (consulté le )
- (fr) Référence CITES : taxon Cebus apella (sur le site du ministère français de l'Écologie) (consulté le )
- (fr + en) Référence ITIS : Cebus apella (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Cebus apella
- (en) Référence UICN : espèce Cebus apella (Linnaeus, 1758) (consulté le )
- (en) Référence NCBI : Sapajus apella (taxons inclus) (consulté le )
- (en) Référence CITES : espèce Cebus apella (Linnaeus, 1758) (+ répartition sur Species+) (consulté le )
- Étude de la capacité des capucins bruns (Cebus apella) à évaluer et à accepter un degré de risque dans l’échange alimentaire avec un expérimentateur humain. par Audrey Coulon (Résumé)
Bibliographie
modifier- Bodini, R. and Prez-Hernandez, R. 1987. Distribution of the species and subspecies of cebids in Venezuela. Fieldiana. Zoology, New Series (39): 231-244.
- Fedigan., L., Visalberghi, E. and Rylands A.B. 2003. Where and what are capuchins, and how did they get there? In: D. Fragaszy, L. Fedigan and E. Visalberghi (eds) The Complete Capuchin. Cambridge University Press, Cambridge.
- Groves, C. P., 2001. The Taxonomy of Primates. Smithsonian Institution Press, Washington, DC.
- Norconk, M.A., Sussman, R.W. and Phillips-Conroy, J. 1996. Primates of Guayana Shield forests: Venezuela and the Guianas. In: M.A. Norconk, A.L. Rosenberger and P.A. Garber (eds). Adaptive Radiations of Neotropical Primates. p. 69-83. Plenum Press, New York.
- Rudran, R. and Eisenberg, J.F. 1982. Conservation and status of wild primates in Venezuela. International Zoo Yearbook 22: 52-59.
- Silva Jr., J. de S. 2001. Especiao nos macacos-prego e caiararas, genero Cebus Erxleben, 1777 (Primates, Cebidae). Doctoral thesis, Universidade Federal do Rio de Janeiro, Rio de Janeiro.