2-Bromopropane
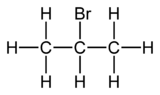
Le 2-bromopropane, également connu comme le bromure d'isopropyle, est un hydrocarbure bromé de formule brute C3H7Br et de formule semi-développée CH3–CHBr–CH3. Il se présente sous la forme d'un liquide incolore, utilisé principalement pour introduire un groupe fonctionnel isopropyle en synthèse organique.
| 2-Bromopropane | |||
    |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2-Bromopropane | ||
| Synonymes |
Bromure d'isopropyle, bromure de 2-propyle, bromure isopropylique |
||
| No CAS | |||
| No ECHA | 100.000.778 | ||
| No CE | 200-855-1 | ||
| No RTECS | TX4111000 | ||
| PubChem | 6358 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore de même odeur que le chloroforme[1] | ||
| Propriétés chimiques | |||
| Formule | C3H7Br [Isomères] |
||
| Masse molaire[2] | 122,992 ± 0,004 g/mol C 29,3 %, H 5,74 %, Br 64,97 %, |
||
| Propriétés physiques | |||
| T° fusion | −89 °C[3],[1],[4] | ||
| T° ébullition | 59 °C[3],[1] 59,38 °C[4] |
||
| Solubilité | eau 3,180 g·l-1[5] à 3,2 g·l-1[1] à 20 °C | ||
| Masse volumique | 1,31 g·cm-3 à 25 °C[3] | ||
| Point d’éclair | 19 °C[3] −20 °C[1] |
||
| Limites d’explosivité dans l’air | <4,6%[4] 3,3 vol. % soit 165 g/m3[1] |
||
| Pression de vapeur saturante | 28 kPa à 20 °C[4] 261 mbar à 20 °C 383 mbar à 30 °C 545 mbar à 40 °C 754 mbar à 50 °C[1] |
||
| Viscosité dynamique | 4,894 mPa s à 20 °C[réf. nécessaire] | ||
| Thermochimie | |||
| Cp | 135,6 J·K-1·mol-1[réf. nécessaire] | ||
| Propriétés optiques | |||
| Indice de réfraction | = 1,425[3] | ||
| Précautions | |||
| SGH[3] | |||
| H225, H360F, H373, P201, P210 et P308+P313 |
|||
| NFPA 704[4] | |||
| Transport[3],[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 4837 mg/kg (souris, i.p.)[5] | ||
| CL50 | 36 mg/m3 (inhalation, mammifère (espèce non spécifiée))[5] 31171 ppm/4h (inhalation, souris)[5] |
||
| LogP | 2,14 (octanol-eau)[5] | ||
| Composés apparentés | |||
| Isomère(s) | 1-bromopropane | ||
| Autres composés | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Préparation
modifierLe 2-bromopropane est disponible dans le commerce. Il peut être obtenu à partir du 2-propanol par réaction avec de l'acide bromhydrique, HBr[6],[7]. L'addition électrophile du bromure d'hydrogène sur le propène suivant la règle de Markovnikov, seul le 2-bromopropane est obtenu :
Le 2-bromopropane peut être aussi préparé de façon standard comme les autres bromures d'alkyle, c'est-à-dire par réaction de l'isopropanol avec du phosphore et du brome[8] ou avec du tribromure de phosphore, PBr3[9].
Enfin, le 2-bromopropane peut être aussi obtenu par une réaction d'Appel sur le 2-propanol avec le tétrabromure de carbone, CBr4 et la triphénylphosphine, PPh3 :
Usage
modifierL'atome de brome étant en position secondaire, la molécule de 2-bromopropane peut subir une déshydrohalogénation facilement pour donner du propène, CH2=CH-CH3, qui s'échappe sous forme de gaz. Par conséquent, ce réactif est utilisé en association avec des bases douces, telles que le carbonate de potassium, plutôt qu'avec des bases fortes.
Sécurité
modifierLes agents alkylants tels que 2-bromopropane sont souvent cancérigènes.
Autres données
modifierNotes et références
modifier- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « 2-Bromopropane » (voir la liste des auteurs) et en allemand « 2-Brompropan » (voir la liste des auteurs).
- Entrée « 2-Bromopropane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23/01/14 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 2-Bromopropane, analytical standard, consultée le 23/01/14., Fiche Sigma-Aldrich du composé 2-Bromopropane 99%, consultée le 23/01/14..
- Fiche MSDS (fichier dont l'extension .php doit être modifiée en .pdf pour être lisible).
- (en) « 2-Bromopropane », sur ChemIDplus.
- Organikum, 19e Ed., Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg, 1993, page 200. (ISBN 3-335-00343-8).
- Merck Index of Chemicals and Drugs, 9th ed. Monograph 5071.
- Oliver Kamm and C. S. Marvel, Alkyl and alkylene bromides, Org. Synth., coll. « vol. 1 », , p. 25
- C. R. Noller and R. Dinsmore, Isobutyl bromide, Org. Synth., coll. « vol. 2 », , p. 358
- données atomiques sur chemmol.com






