Leucoptérine
La leucoptérine est un composé de la famille des pigments ptériniques. Elle se présente sous la forme de cristaux incolores, légèrement soluble dans l'eau.
| Leucoptérine | |

| |
| Identification | |
|---|---|
| Synonymes |
2-amino-5,8-dihydro-4,6,7(1H)-ptéridintrione |
| No CAS | |
| No ECHA | 100.007.044 |
| PubChem | 135403796 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores |
| Propriétés chimiques | |
| Formule | C6H5N5O3 [Isomères] |
| Masse molaire[1] | 195,135 6 ± 0,007 1 g/mol C 36,93 %, H 2,58 %, N 35,89 %, O 24,6 %, |
| Propriétés physiques | |
| Solubilité | très légèrement soluble dans l'eau (environ 1,25 g·l−1 à 20 °C)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Occurrence
modifier
La leucoptérine est présente dans la nature chez certaines espèces de papillons blancs.
Elle a d'ailleurs été isolée pour la première fois en 1926 par Clemens Schöpf (de) et Heinrich Otto Wieland des ailes de Piéridés, le Piéride du chou et le Piéride du navet[3], ce qui est à l'origine de son nom (du grec leukos, blanc, et pteron, aile)[4]. Toutefois, la leucoptérine n'est pas responsable de la coloration des ailes de ces papillons. Cette couleur blanche vient en fait de la « réflexion de la lumière sur les écailles, dans lesquelles est emprisonné de l'air »[5].
Propriétés
modifierLa leucoptérine forme des cristaux quasi incolores contenant un demi-équivalent d'eau de cristallisation (hémihydrate). Tout comme la ptérine, la leucoptérine peut subir un équilibre céto-énolique, plus précisément dans ce cas une tautomérie lactame-lactime, se transformant ainsi en 2-amino-4,6,7-ptéridintriol, d'autres tautomères partiels étant également possibles. La comparaison de spectres UV avec ceux d'autres ptéridines substituées indique cependant que la forme lactame est prédominante[6].
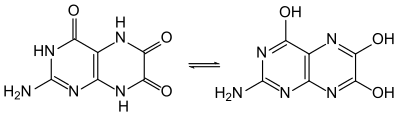
La leucoptérine est un acide faible et est donc dissoute par les substances alcalines, par exemple le carbonate de sodium ou la soude. L'ajout d'acide chlorhydrique permet de précipiter à nouveau le solide incolore, méthode qu'avaient utilisé Schöpf et Purrmann pour purifier la substance. L'acidité est la plus forte pour le groupe N(8)-H, suivie par le groupe N(3)-H et enfin le groupe N(5)-H. Il est possible de préparer des sels de sodium, de baryum et d'ammonium à partir de ce composé.
Biosynthèse
modifierUne étude radiochimique sur les chenilles et chrysalides de Piéride du chou (Pieris brassicae L.), à partir de composés marqués au carbone 14, a conclu que la leucoptérine des papillons était produite à partir de la guanine ou de la guanosine, des dérivés de la purine, le précurseur immédiat étant vraisemblablement la xanthoptérine. À partir de ce composé, le groupe oxo sur le carbone 8 peut être introduit par l'action de la xanthine oxydase[7].
Synthèse
modifierAfin de prouver sa formule structurelle, Robert Purrmann (de) a synthétisé en 1940 la leucoptérine à partir de la 2,4,5-triamino-1,6-dihydropyrimidin-6-one (2,4,5-triamino-6-hydroxypyrimidine), chauffée avec de l'acide oxalique en excès[8],[9] :

Notes et références
modifier- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Leukopterin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Beilsteins Handbuch der Organischen Chemie, 4. Ergänzungswerk, Bd. 26, p. 4017.
- (de) Clemens Schöpf, Heinrich Wieland, « Über das Leukopterin, das weiße Flügelpigment der Kohlweißlinge (Pieris brassicae und P.napi). », Berichte der deutschen chemischen Gesellschaft, vol. 59, , p. 2067–2072 (DOI 10.1002/cber.19260590865)
- (de) Clemens Schöpf, Rolf Reichert, « Zur Kenntnis des Leukopterins », Justus Liebigs Annalen der Chemie, vol. 548, , p. 82-94 (DOI 10.1002/jlac.19415480108)
- (de) Albert Gossauer, Struktur und Reaktivität der Biomoleküle : eine Einführung in die organische Chemie, Zurich, Helvetica Chimica Acta, , 650 p. (ISBN 978-3-906390-29-1, lire en ligne), p. 504
- (de) Wolfgang Pfleiderer, Manfred Ruckwied, « Zur Struktur des Leukopterins », Chem. Ber., vol. 94, , p. 118-124
- (de) Friedrich Weygand, H. Simon, G. Dahms, M. Waldschmidt, H. J. Schliep, H. Wacker, « Über die Biogenese des Leucopterins », Angewandte Chemie, vol. 73, , p. 402–407 (DOI 10.1002/ange.19610731111)
- (de) Robert Purrmann, « Über die Flügelpigmente der Schmetterlinge. VII. Synthese des Leukopterins und Natur des Guanopterins », Justus Liebigs Annalen der Chemie, vol. 544, , p. 182–190 (DOI 10.1002/jlac.19405440111)
- (de) Robert Purrmann, « Konstitution und Synthese des sogenannten Anhydroleukopterins. Über die Flügelpigmente der Schmetterlinge XII », Justus Liebigs Annalen der Chemie, vol. 548, , p. 284–292 (DOI 10.1002/jlac.19415480121)