Halohydrine
En chimie organique, les halohydrines ou halogénoalcools sont une famille de composés organiques dérivés halogénés des alcools. Selon la définition de l'IUPAC, ce sont des « alcools substitués par un atome d'halogène sur un carbone saturé qui ne porte autrement que des atomes d'hydrogène ou des groupes hydrocarbyle »[1]. Le terme « halohydrine » est souvent restreint aux seuls β-halogénoalcools, c'est-à-dire les composés où le groupe hydroxyle et l'atome d'halogène sont portés par des atomes de carbone voisins (vicinaux). Comme la définition ne s'applique qu'aux composés saturés, elle exclut par exemple les composé aromatiques tels que le 2-chlorophénol. Les halohydrines peuvent-être sous-catégorisées selon la nature de leur atome d'halogène, respectivement en fluorohydrines, chlorohydrines, bromohydrines et iodohydrines.


Certaines chlorohydrines, par exemple le 1-chloro-2-propanol (chlorohydrine de propylène), sont produites chaque année à hauteur de plusieurs mégatonnes, comme précurseurs de polymères.
Synthèse
modifierÀ partir d'alcènes
modifierLes halohydrines sont généralement préparées par traitement d'un alcène par le dihalogène en présence d'eau[2]. Cette réaction est une addition électrophile, similaire à la réaction de dihalogénation, qui se déroule comme une addition anti. Par exemple, l'équation de la conversion de l'éthylène en chlorohydrine d'éthylène (2-chloroéthanol) est:
- H2C=CH2 + Cl2 + H2O → H2(OH)C-CH2Cl + HCl
Pour la bromation, on utilise comme réactif le N-bromosuccinimide (NBS) plutôt que le dibrome, car cela produit moins de sous-produits.

À partir d'époxides
modifierLes halohydrines peuvent aussi être préparées par réaction entre un époxyde avec un acide halogénohydrique ou un halogénure de métal[3].
À partir de 2-chloroacides
modifierLes acides 2-chlorocarboxyliques peuvent être réduits par le tétrahydruroaluminate de lithium en 2-chloroalcools. Ces acides peuvent eux-mêmes être obtenus de diverses façons, par exemple par halogénation de Hell-Volhard-Zelinski. L'acide 2-chloropropanoïque (en) est produit par chloration du chlorure de propanoyle suivi par l'hydrolyse du chlorure de 2-chloropropanoyle ainsi obtenu. De l'acide (S)-2-chloropropanoïque énantiomériquement pur et divers composés apparentés peuvent être préparés à partir d'aides aminés par diazotisation[4].
Réactions
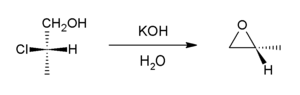
modifierEn présence d'une base, les halohydrines subissent une SN2 intramoléculaire pour former des époxydes. Industriellement, on utilise pour ça l'hydroxyde de calcium mais en laboratoire, on préfère en général utiliser l'hydroxyde de potassium.
Cette réaction est l'inverse de la formation des halohydrines à partir des époxydes, et peut être considérée comme une variante de la synthèse de Williamson. C'est par cette méthode qu'est produit la plupart de l'oxyde de propylène[5] :
ainsi que l'épichlorohydrine. En revanche, si un temps l'oxyde d'éthylène était produit à partir du 2-chloroéthanol, qui était pour cette occasion produit à grande échelle, l'oxyde d'éthylène est à présent produit directement par oxydation de l'éthylène[6].
De telles réactions ont également à l base de procédés plus complexes, la formation d'époxyde étant par exemple une étape-clé de la réaction de Darzens.
Cette réaction existe également dans la nature, chez les bactéries, où elle est catalysée par l'halohydrine déshalogénase (en).
Halohydrines halogénées
modifier
Des composés tels que le 2,2,2-trichloroéthanol, qui contiennent de multiples halogènes géminaux adjacents au groupe hydroxyle peuvent être considérés comme des halohydrines (même s'ils ne respectent pas strictement la définition de l'IUPAC) car ils possèdent une chimie similaire, en particulier ils peuvent subir une cyclisation intramoléculaire pour former des groupes dihaloépoxy. Ces espèces sont à la fois hautement réactives et utiles en synthèse, étant à la base de la réaction de Jocic (en), la réaction de Bargellini (en) et la réaction de Corey-Link (en)[7].
Sécurité
modifierComme pour tout groupe fonctionnel, les dangers des halohydrines sont difficiles à généraliser car elles peuvent faire partie d'une série presque illimitée de composés, chaque structure ayant une pharmacologie différente. En général, les composés simples de faible poids moléculaire sont souvent toxiques et cancérigènes (par exemple le 2-chloroéthanol, le 3-MCPD) du fait qu'ils sont des agents alkylants. Cette réactivité peut être mise à profit, par exemple dans le médicament anticancéreux mitobronitol (en). Il existe un certain nombre de corticoïdes synthétiques portant un motif fluorohydrine (triamcinolone, dexaméthasone).
Erreurs
modifierMalgré leur nom qui peut porter à confusion, ni l'épichlorohydrine (2-(chlorométhyl)oxirane), ni la chlorohydrine sulfurique (acide chlorosulfurique) ne sont des chlorohydrines.
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Halohydrin » (voir la liste des auteurs).
- (en) « halohydrins », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- William Reusch, « Addition Reactions of Alkenes » [archive du ], sur Virtual Textbook of Organic Chemistry.
- Carlo Bonini et Giuliana Righi, « Regio- and Chemoselective Synthesis of Halohydrins by Cleavage of Oxiranes with Metal Halides », Synthesis, vol. 1994, no 03, , p. 225–238 (DOI 10.1055/s-1994-25445)
- Bernhardt Koppenhoefer et Volker Schurig, « (S)-2-Chloroalkanoic Acids of High Enantiomeric Purity from (S)-2-Amino Acids: (S)-2-Chloropropanoic Acid », Organic Syntheses, vol. 66, , p. 151 (DOI 10.15227/orgsyn.066.0151)
- Dietmar Kahlich, Uwe Wiechern, Jörg Lindner “Propylene Oxide” in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. DOI 10.1002/14356007.a22_239 Article Online Posting Date: June 15, 2000
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a06_565.pub2), « Chlorohydrins »
- T.S. Snowden, « Recent applications of gem-dichloroepoxide intermediates in synthesis », Arkivoc, vol. 2012, no 2, , p. 24–40 (DOI 10.3998/ark.5550190.0013.204)