Titine (protéine)
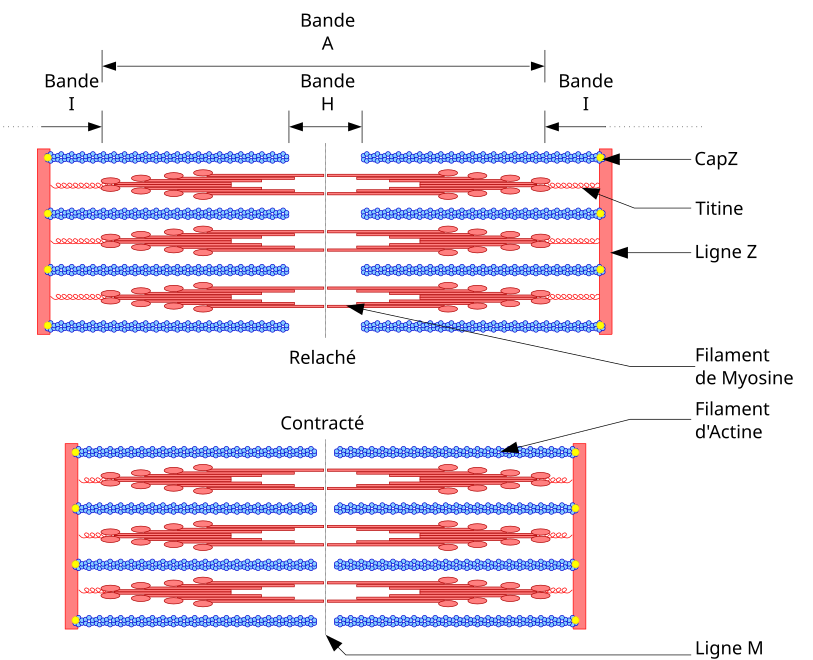
La titine (ou connectine), dont le nom scientifique comprend plusieurs dizaines de milliers de lettres (methionylthreonyl(...)isoleucine), est une protéine élastique impliquée dans le contrôle de l’assemblage des protéines sarcomériques et qui régule l’élasticité du sarcomère. Dans le muscle, elle est liée aux filaments épais (de myosine), et s'étend de la ligne Z de la bande I à la ligne M dans la bande H. Après la myosine et l’actine, la titine est la protéine la plus abondante dans le muscle strié, représentant quelque 10 % de la masse myofibrillaire. Chez l'être humain, elle est codée par le gène TTN, situé dans la bande 2q31 du chromosome 2 et qui comporte 363 exons[2] — un record.
| Titine | ||
 Module A71 d'une titine de myocarde humain modélisé par RMN (PDB 1BPV). | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | TTN | |
| N° EC | 2.7.11.1 | |
| Homo sapiens | ||
| Locus | 2q31.2 | |
| Masse moléculaire | 3 816 030 Da[1] | |
| Nombre de résidus | 34 350 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| N° EC | EC |
|---|
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Structure
modifierAvec environ 30 000 acides aminés et une masse moléculaire de 3 000 kDa (une mole de cette molécule a une masse d'environ 3 000 kg), la titine est la plus grande protéine connue chez l'être humain. Une seule molécule de titine s’étend de la strie Z à la ligne M, ce qui représente près d'un demi-sarcomère, soit plus d’un micromètre de longueur. C'est le même ordre de grandeur que la taille d'une bactérie. La titine est constituée de 244 régions repliées individuellement.
Au niveau de la bande A, la titine est principalement composée de structures répétitives de domaines similaires à l'immunoglobuline et la fibronectine 3. Elle possède de multiples sites de fixation avec la myosine, la protéine C ou l’AMP désaminase.
Au niveau de la bande I, la titine est liée à la calpaïne 3, enzyme protéolytique calcium-dépendante endogène responsable de la dégradation de la structure contractile du muscle.
Au niveau de la strie Z, l'association de la titine avec l’actine garantit le maintien de l’assemblage myofibrillaire au cours du travail musculaire.
Fonctions physiologiques
modifierLa titine est le principal constituant des filaments longitudinaux qui assurent le maintien de l’architecture myofibrillaire. C'est la coordination de l'action de la titine et de la téléthonine qui permet la stabilité (équilibre dynamique) des muscles. La titine contrôle l’intégrité et assure la stabilité mécanique du sarcomère grâce à sa fixation et aux interactions avec plusieurs protéines musculaires, dont :
Lors du travail musculaire, le déploiement de la titine génère une force capable de s’opposer à la tension d’étirement du sarcomère : pendant la contraction d'un muscle strié, la tension active provient de l'action des filaments minces d'actine sur les filaments épais de myosine et la tension passive résulte de l'extension de la titine[3]. Les deux protéines sont très solidement liées à échelles nanométrique mais uniquement dans l'axe de la fibre musculaire[4].
-
Structure d'un sarcomère illustrant la contraction musculaire (la titine figure en haut à droite).
La titine aurait un rôle important dans la myofibrillogenèse.
La titine s'exprimerait aussi dans les chromosomes, permettant leur condensation lors de la mitose.
Maladies
modifierLa titine est indispensable à la viabilité du sarcomère et sa dégradation affaiblit le muscle.
- Des mutations du gène de la titine sont responsables de cardiomyopathies dilatées[5] ou hypertrophique[6] ainsi que de dysplasies ventriculaires droites arythmogènes[7] et de dystrophies musculaires[8], sévères dans le cas des homozygotes.
Chez les personnes souffrant de bronchopneumopathie chronique obstructive, l'expression de la titine est modifiée, de telle sorte que la contractilité des fibres musculaires du diaphragme est altérée.
Nanotechnologies
modifierLa nanotechnologie s'intéresse aux propriétés des protéines des muscles pour d'éventuelles applications en biomimétique (nanorobots, muscles artificiels).
Nom
modifierLe nom court titine dérive de Titan, divinité géante de la mythologie grecque.
Outre ce nom d’usage, la titine admet, comme toute molécule, un nom formé de façon systématique qui décrit entièrement ses composantes et leur organisation. La titine étant gigantesque, son nom selon la nomenclature de l'UICPA fait plusieurs dizaines de milliers de lettres[9].
Voir aussi
modifierArticles connexes
modifierNotes et références
modifier- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Bang M.L., Centner T., Fornoff F. et al., The complete gene sequence of titin, expression of an unusual approximately 700-kDa titin isoform, and its interaction with obscurin identify a novel Z-line to I-band linking system, Circ. Res., 2001, 89, 1065–1072.
- Granzier H.L. et Labeit S., The giant protein titin: a major player in myocardial mechanics, signaling, and disease, Circ. Res., 2004, 94, 284–295.
- Dépêche idw, communiqué de presse de l'université technique de Munich, , reprise par ADIT- BE Allemagne 447 du .
- Itoh-Satoh M., Hayashi T., Nishi H. et al., Titin mutations as the molecular basis for dilated cardiomyopathy, Biochem. Biophys. Res. Commun., 2002, 291, 385–393.
- Satoh M., Takahashi M., Sakamoto T. et al., Structural analysis of the titin gene in hypertrophic cardiomyopathy: identification of a novel disease gene, Biochem. Biophys. Res. Commun., 1999, 262, 411–417.
- Taylor M., Graw S., Sinagra G. et al., Genetic variation in titin in arrhythmogenic right ventricular cardiomyopathy–overlap Syndromes, Circulation, 2011, 124, 876-885.
- Hackman P., Vihola A., Haravuori H. et al., Tibial muscular dystrophy is a titinopathy caused by mutations in TTN, the gene encoding the giant skeletal-muscle protein titin, Am. J. Hum. Genet., 2002, 71, 492–500.
- 64 060 lettres selon geekologie.com, 189 819 lettres selon le site web de Sarah McCulloch (mais le nom fourni sur cette page serait incorrect), 235 819 lettres selon flabdablet.nfshost.com.