Glace
La glace est l'eau (de formule chimique H2O) lorsqu'elle est à l'état solide. Cet élément est très étudié dans la nature et en laboratoire, par les scientifiques, à commencer par les glaciologues, les physiciens de la matière condensée et autres cryologues de spécialités différentes : il contient souvent beaucoup d'impuretés ou d'inclusions, d'origine diverse. Les météorologues suivent la formation des flocons à partir de vapeur d'eau entrant en atmosphère froide plus ou moins poussiéreuse, géologues et minéralogistes, rejoints par les spéléologues, ne le retrouvent pas seulement dans les endroits communément englacés, mais sous des formes insolites dans les déserts secs et arides, des lieux plus secs et abrités des montagnes comme au fond des grottes profondes et cavités glacées, où la glace subsiste longtemps.
| Glace Catégorie IV : oxydes et hydroxydes[1] | |
 Fleur de givre. | |
| Général | |
|---|---|
| Nom IUPAC | Ih ou glace hexagonale (terrestre) |
| Numéro CAS | |
| Classe de Strunz | 4.AA.05
|
| Classe de Dana | 04.01.02.01
|
| Formule chimique | H2O |
| Identification | |
| Masse formulaire[2] | 18,0153 ± 0,0004 uma H 11,19 %, O 88,81 %, |
| Couleur | incolore à blanc, bleutée ou verdâtre en couches épaisses, bleu-clair en masse épaisse, mais en pratique toutes les couleurs plus ou moins pâles suivant les impuretés |
| Système cristallin | hexagonal |
| Réseau de Bravais | a = 449,8 à 451 pm, c = 733,8 à 735 pm, Z = 4 |
| Classe cristalline et groupe d'espace | dihexagonale dipyramidale 6/mmm (6/m 2/m 2/m) groupe d'espace P63/mmc |
| Clivage | aucun, glissage sur {001} |
| Cassure | conchoïdale (fragile), forme de glace compacte éclatant en petit fragments |
| Habitus | cristaux étoilés de neige aplatis à six pointes, cristaux en auge, cristaux hexagonaux d'aspects très divers et complexes suivant la température de formation, la recristallisation ou la nature de la matière eau solide, liquide, gazeuse, l'âge du dépôt, masses blanches, givre en feuille d'acanthe, grêlons formés de plusieurs cristaux concentriques, agrégats granulaires insérés ou aplatis au niveau des roches supports, masses squelettiques, branches arborées, dendrites ou stalactites de glace nommée parfois glaçons, poudres, poussières. |
| Faciès | pelliculeux, prismatique, dentritique, massif |
| Jumelage | plan de jumelage (α) : {0001}, et (b): {0001¯} |
| Échelle de Mohs | 1,5 |
| Trait | blanc |
| Éclat | vitreux, parfois terne |
| Propriétés optiques | |
| Indice de réfraction | nω = 1,309, nε = 1,311 |
| Biréfringence | Uniaxe (+) δ = 0,001 |
| Fluorescence ultraviolet | non |
| Transparence | transparent à translucide |
| Propriétés chimiques | |
| Densité | 0,9167, située entre 0,91 à 0,93 |
| Température de fusion | 0 °C |
| Comportement chimique | à pression normale |
| Propriétés physiques | |
| Magnétisme | diamagnétique |
| Unités du SI & CNTP, sauf indication contraire. | |
| modifier |
|
| Formule chimique |
H₂O |
|---|
| Système cristallin | |
|---|---|
| Masse volumique |
0,92 gramme par centimètre cube, 917,5 kilogrammes par mètre cube, 918,9 kilogrammes par mètre cube, 919,4 kilogrammes par mètre cube, 919,4 kilogrammes par mètre cube, 919,6 kilogrammes par mètre cube, 920 kilogrammes par mètre cube, 920,4 kilogrammes par mètre cube, 920,8 kilogrammes par mètre cube, 921,6 kilogrammes par mètre cube, 922,4 kilogrammes par mètre cube, 923,3 kilogrammes par mètre cube, 924,1 kilogrammes par mètre cube, 924,9 kilogrammes par mètre cube, 925,7 kilogrammes par mètre cube |
| Dureté de Mohs |
1,5 |
|---|
| Point de fusion |
0 degré Celsius |
|---|
Le minéral glace
modifier
Le minéral glace abondant dans l'univers, minéral le plus abondant à la surface de la Terre[réf. nécessaire], surtout à haute altitude et à proximité des pôles, est décrit par plus d'une dizaine de variétés polymorphiques adaptées aux différentes gammes de pressions interstellaires et déterminées par diffraction X et spectroscopies, mais il n'existe en pratique qu'une seule forme naturelle terrestre, la glace cristalline ordinaire de symétrie hexagonale, notée en anglais scientifique Ih[a]. D'un point de vue cristallochimique, un atome d'oxygène est au centre d'un tétraèdre régulier formé par quatre autres atomes d'oxygène, placés à une distance de 0,276 7 nm, l'angle moléculaire HOH est fixé à 109° 47′ et la cohésion restante est assurée par des liaisons hydrogène. L'ensemble des zones de la surface terrestre où l'eau se trouve sous forme gelée est théoriquement la cryosphère[b].
À la pression atmosphérique normale (101 325 Pa), l'état de l'eau pure est en principe la glace lorsque sa température est inférieure à sa température de fusion qui est, par convention, 0 °C (soit 273,15 K). Cependant, en l'absence de germes ou cristaux de glace, de l'eau calme peut être facilement refroidie à des températures inférieures à 0 °C sans se congeler, dans un état d'équilibre instable appelé surfusion, et atteindre ainsi des températures allant jusqu'à −48 °C[3]. La température de fusion de la glace a servi de point fixe pour la définition originelle de l'échelle Celsius de températures, à l'origine du degré Celsius noté °C.
Les chimistes trouvent l'eau à la fois exceptionnelle et naturellement anormale, car la densité de la glace est inférieure à la densité du liquide eau[c]. En conséquence, les glaçons flottent sur l'eau, comme les icebergs voyagent sur la mer ou les revêtements glacés apparus lors du gel profond des plans d'eau ou des rivières sont charriés en surface lors de la débâcle et peuvent former des amas monstrueux lors de l'embâcle. Le minéral glace hexagonale désigne aussi bien la neige et ses flocons, le givre que les amas de neige ou névés[d].
La roche glace
modifierLa roche glace est un assemblage de cristaux de minéral glace, aux formes non régulières ni géométriques, dont les mécaniciens du solide connaissent bien les lois mécaniques de déformation[e]. La glace polycristalline, quels que soient ses impuretés ou inclusions, est pratiquement imperméable à l'eau liquide. Sa texture et ses caractéristiques sont extrêmement variées, selon ses origines ou sa formation, les métamorphoses et déformations qu'elle a subies, ou les milieux de conservation ou de préservation[f]. Un exemple de glace polycristalline est le produit de la congélation d'eau en masse au sein d'un nuage, dénommé grêle ou grêlon s'il parvient à chuter au sol sans fusion notable. La glace roche peut provenir en conséquence de la congélation d'eau en masse, c'est le cas de la glace de rivière, de lacs, de mer ou de la glace artificielle, elle est représentée aussi par les produits de congélation de l'eau sous diverses formes (vapeur d'eau dans l'air, eau fondue et refondue, eau insérée dans les sols ou les nappes), c'est le cas des champs de glace à l'aval des sources se reformant incessamment en cas d'apport d'eau et de température idoines, de la glace plaquée sur le sol par des courants d'air humide successifs, de la glace amoncelée dans les zones de glacières naturelles du fait du proche flux d'air frigorifiant sortant du sol, de la glace issue de la congélation de l'eau suintant des roches ou de revêtements fixateurs à l'origine des verglas, de tarines, de stalactites ou d'excroissances glacées diverses, mais aussi de la glace des sols gelés de manière éphémère ou permanente, comme le permafrost. La roche glace est encore représentée par la transformation des névés ou de vastes accumulations de neige en glaciers, eux-mêmes fracturés et dispersés dans la mer ou les lacs, en icebergs. Il existe encore la glace de la calotte polaire, formée, reformée et déformée très lentement à température basse, un type de roche glace encore mystérieux, car en pratique impossible à reproduire expérimentalement au laboratoire. La fusion de la roche glace permet l'apparition en général de vastes quantités liquides d'eaux douces. C'est l'objet d'étude de l'hydrologie glaciaire[g].
Physique de la glace dans l'Univers et sur Terre
modifier

La glace représenterait, avec les silicates de magnésium et de fer, tels que l'olivine, le minéral le plus répandu dans le système solaire. Il occupe surtout les planètes géantes excentrées et leurs satellites. La zone proche du soleil naissant a sans doute été asséchée de manière précoce et l'eau n'a pu y revenir que portée par les comètes venues de la périphérie du système solaire. Ce serait le cas sur la Terre en position moyennement chaude. Lorsqu'une comète s'approche du soleil, une fraction croissante de sa glace devient cubique[h].
La glace présente plus de onze variétés polymorphiques dont la plupart des domaines d'existence sont représentés dans le diagramme de phase ci-dessous. Elle existe aussi sous forme amorphe.
À la pression atmosphérique normale (et jusqu'à une pression d'environ 0,2 GPa ou 2 000 bars), les molécules d'eau de la glace ordinaire forment une structure cristalline suivant un réseau hexagonal (a = 4,52 Å, c = 7,37 Å), dont la stabilité est assurée par des liaisons hydrogène ; cette variété polymorphique est appelée « glace 1h » ou « glace Ih » (h pour hexagonal).
Cette structure présente une faible compacité, et la masse volumique de la glace ordinaire est inférieure à celle de l'eau (917 kg/m3 pour de la glace pure à 0 °C, pression atmosphérique normale).
Ceci explique que la température du point de fusion de la glace ordinaire s'abaisse avec l'augmentation de la pression (il s'agit d'une anomalie : les températures de fusion croissent normalement avec la pression) jusqu'à un minimum de −22 °C (cf. diagramme de phase de la glace) pour une pression d'environ 0,2 GPa (ici commence le domaine de la glace III).
En fonction des conditions de température et de pression, la glace peut adopter d'autres structures cristallines, généralement plus compactes que la glace ordinaire ; certaines de ces variétés de glace peuvent se rencontrer dans les conditions extrêmes régnant à la surface d'autres planètes ou de satellites de grosses planètes, tels Europe, Ganymède ou encore Callisto dans le système solaire :

| Phase | Caractéristiques |
|---|---|
| Glace amorphe | Une glace amorphe est une glace sans structure cristalline. La glace amorphe existe sous trois formes : basse densité à pression atmosphérique ou inférieure, haute densité et très haute densité se formant à plus hautes pressions. Elles sont obtenues par refroidissement ultra rapide de l'eau liquide. De la glace amorphe peut être obtenue par une trempe de gouttelettes d'eau. |
| Glace Ih | Glace cristalline à réseau hexagonal. Pratiquement toute la glace de la biosphère est de la glace Ih, avec un petit peu de glace Ic, VII, et XI. |
| Glace Ic | Forme métastable cubique à faces centrées de la glace. Les atomes d'oxygène sont arrangés comme dans la structure du diamant. Elle se produit entre 130 et 220 K, et peut exister jusqu'à 240 K[4],[5],où elle se transforme en glace Ih. Elle peut occasionnellement être présente en haute atmosphère[6]. Densité 0,9. |
| Glace II | Une forme orthorhombique centrée très ordonnée. Produite à partir de glace Ih par compression à la température de 190 à 210 K. Se transforme en glace III par chauffage. Densité env. 1,2. |
| Glace III | Une glace tétragonale produite en refroidissant de l'eau liquide à 250 K comprimée sous 300 MPa. Densité env. 1,1. |
| Glace IV | Une phase orthorhombique métastable. Peut être produite en chauffant de la glace amorphe haute densité lentement sous la pression de 810 MPa. Ne se forme pas facilement sans germe[7]. |
| Glace V | Phase monoclinique à base centrée. Produite en refroidissant de l'eau à 253 K sous 500 MPa. Structure la plus complexe[8]. Densité env. 1,2. |
| Glace VI | Une glace tétragonale produite en refroidissant de l'eau liquide à 270 K sous 1,1 GPa. Présente la relaxation de Debye[9]. Densité env. 1,3. |
| Glace VII | Phase cubique simple. Position des atomes d'hydrogène désordonnée. Les liaisons hydrogène forment deux réseaux imbriqués. Relaxation de Debye. Densité env. 1,7. De la glace VII naturelle a été observée sous la forme d'inclusions dans des diamants[10],[11] |
| Glace VIII | Une version plus ordonnée de la glace VII, où les atomes d'hydrogène occupent des positions fixes. Produite en refroidissant de la glace VII en dessous de −5 °C. |
| Glace IX | Phase tétragonale. Produite graduellement à partir de glace III en la refroidissant de 208 K à 165 K, stable à 140 K et sous pressions entre 200 MPa et 400 MPa. Densité 1,16. |
| Glace X | Glace en phase ordonnée par alignement symétrique des protons (proton-ordered symmetric), produite à environ 70 GPa[12] et stable jusqu'à au moins 170 GPa à 300 K[13]. Cette glace n'est pas constituée de molécules mais d'ions H+ et O2−[13]. |
| Glace XI | Forme orthorhombique à basse température de la glace hexagonale. Elle est ferroélectrique. La glace XI est considérée comme la forme la plus stable de la glace Ih. La transformation naturelle est très lente. De la glace XI aurait été trouvée dans la glace de l'Antarctique âgée de 100 à 10 000 ans. Une étude, controversée[14] suggère que cette glace XI se formerait dès en dessous de −36 °C[15], bien au-dessus de sa température de fusion de −192 °C. |
| Glace XII | Une phase tétragonale, métastable. Elle est observée dans l'espace de phase des glaces V et VI. Elle peut être produite en chauffant de la glace amorphe à haute densité de 77 K à 183 K sous 810 MPa. Densité env. 1,3 à 127 K. |
| Glace XIII | Phase monoclinique. Produite en refroidissant l'eau à 130 K sous 500 MPa. Forme à protons ordonnés de la glace V[16]. |
| Glace XIV | Phase orthorhombique. Produite sous 118 K à 1,2 GPa. Forme à protons ordonnés de la glace XII. |
| Glace XV | Forme à protons ordonnés de la glace VI produite en refroidissant l'eau entre 80 K et 108 K sous 1,1 GPa. |
| Glace XVI | Clathrate obtenu artificiellement en 2014, dans le vide, en deçà de 147 K. Densité 0,85.
Thermodynamiquement instable dans des conditions expérimentales, bien que l'on ait réussi à la préserver à des températures cryogéniques. Au-dessus de 145–147 kelvins sous des pressions positives, la glace XVI se transforme en glace Ic, puis en glace ordinaire Ih. Des études théoriques prévoient que la glace XVI soit thermodynamiquement stable sous des pressions négatives (c'est-à-dire sous tension)[17]. |
| Glace XVII | Clathrate obtenu artificiellement en 2016 sous atmosphère d'hydrogène à haute pression, qui, une fois formé, devient métastable à pression ambiante en deçà de 120 K[18].
Cette forme de glace est capable d'absorber, puis de relâcher de l'hydrogène à plusieurs reprises, jusqu'à 5 % de sa masse. Elle est aussi capable d'absorber efficacement d’autres gaz comme l'azote, ce qui permettrait peut-être de l'utiliser à l'avenir dans des applications de séparation industrielle des gaz[19]. |
| Glace XVIII (glace superionique) | Cette phase de l'eau, prédite en 1988, est obtenue artificiellement en 2018 et confirmée en 2019. Elle est produite à haute température (plus de 2000 °C) et haute pression. Contrairement aux autres phases, où les molécules d'eau restent individualisées, dans la glace XVIII, les ions oxygène O2− forment une structure cristalline cubique à travers laquelle les ions hydrogène H+ se déplacent librement, ce qui confère à cette glace XVIII une conductivité de 105 S/m, comparable à celle de l'arsenic ou du graphite[20],[21]. Il en existe deux polymorphes : cubique centré jusque vers 1 500–2 000 K (selon la pression) et cubique à faces centrées au-delà[13],[22]. |
Propriétés physiques de la glace ordinaire (glace Ih)
modifierD'un point de vue strict, il faudrait réserver au domaine de la minéralogie la description de la glace naturelle et ses multiples formes et occurrences naturelles. Ainsi la glace ménagère, les glaces de synthèse ou les banales glaces artificielles, la glace projetée sur les pistes de ski et celle équipant les patinoires ou anneaux de glace, ne sont pas un minéral (naturel). Il n'empêche que pour un physicien ou un physico-chimiste, elles peuvent être décrites de manière similaire.
La neige, précipitations ou météores communes sous forme de flocons ou cristaux hexagonaux plats de glace de taille largement inférieure à 7 mm, contient en pratique 85 % à 95 % d'air.
La glace granuleuse peut encore comprendre 85 % à 30 % d'air. Le firn ou la glace de névé ne contient plus que 30 % d'air à 20 % d'air, alors qu'en deçà de cette teneur, la glace bleue polycristalline n'en contient plus qu'à l'état quasi-expurgé de bulles d'air. Dans un glacier, les agrégats polycristallins peuvent englober des monocristaux individualisés exceptionnels de plus de 45 m. Les gros cristaux de gelée blanche ne peuvent atteindre que 10 m de long, en particulier dans les crevasses de glaciers, les grottes et anciennes mines sèches et froides.
Densité et masse volumique
modifier
La masse volumique de la glace est de 917 kg/m3 à 0 °C, et son coefficient de dilatation linéaire est d'environ 9 × 10−5 /K, toujours à 0 °C.

Une des particularités de la glace est de présenter une masse volumique plus faible que celle de l'eau liquide qui est d'environ 1 000 kg/m3 à 0 °C et sous la pression atmosphérique. La glace flotte donc à la surface de l'eau liquide, phénomène inhabituel car pour la plupart des matériaux, c'est le phénomène inverse qui se produit.
L'augmentation de volume consécutive à la congélation de l'eau favorise la cryoclastie, c'est-à-dire le fractionnement des roches (préalablement fissurées) par les alternances de gel et de dégel[i]. Elle joue un rôle dans la cryoturbation, c'est-à-dire les déplacements des particules du sol et des sols, sous l'effet de ces mêmes alternances.
Propriétés mécaniques
modifierLe coefficient de dilatation linéaire de la glace est environ 9 × 10−5 /K à 0 °C.
La compressibilité de la glace est de l'ordre de 12 e−12/Pa.
La limite d'élasticité de la glace varie énormément suivant la qualité de la glace utilisée : 10 kPa pour la glace de glacier, 60 kPa pour de la glace artificielle.
Les valeurs admises pour le module de Young de la glace se situent environ à 9,33 GPa[23].
Sa limite de plasticité est de 3,5 MPa (en compression). Le rapport limite de plasticité / limite d'élasticité de la glace, de 60 à 350, se range parmi les plus grands de tous les solides connus (environ 2 pour l'acier, et jusqu'à 10 pour le fer doux).
Une formule empirique permet de déterminer la pression supportable par une couche de glace ; si l'on considère H l'épaisseur de glace en centimètres, alors 4·H2 donnera le nombre de kg/m2 que la couche pourra supporter sans se briser.
Les propriétés mécaniques expliquent autant les bonnes capacités de vibration et d'acoustique de certaines glaces suffisamment cohérentes que la facile capacité de sculpture à partir de blocs de glace. Il est par exemple possible de réaliser de multiples instruments de musique, aussi insolites que de formes conventionnelles.
La dureté varie fortement avec la température subie. La glace en haute montagne ou en Antarctique, placée à −44 °C acquiert une dureté de 4, équivalente à celle de la fluorite[réf. souhaitée].
La glace portée à −196 °C (77 K : la température de l'azote liquide bouillant) a la dureté du feldspath, soit 6 sur l'échelle de Mohs[réf. souhaitée].
À noter que des autres morphologies de « glaces extraterrestres » peuvent être encore plus dures.
- La glace d'eau, de par son abondance dans le Système solaire externe et par sa grande dureté à basses températures, est le matériau constitutif de base des lunes des planètes géantes, ainsi que des objets de la ceinture de Kuiper et des comètes ; comme les roches le sont pour les corps du Système solaire interne : planètes telluriques et astéroïdes.
Propriétés thermiques
modifierÀ 0 °C, la chaleur latente de fusion de la glace est de 333 kJ kg−1 et sa capacité thermique massique est de 2,06 kJ kg−1 K−1 ; celle-ci n'est que la moitié de la capacité thermique massique de l'eau à 0 °C (4,217 kJ kg−1 K−1), et varie de façon quasi linéaire en fonction de la température (+0,17 %/K).
La conductivité thermique de la glace est de 2,1 W m−1 K−1 à 0 °C, et augmente avec l'abaissement de la température (pente de l'ordre de -0,57 %/K) ; elle est donc toujours bien supérieure à la conductivité thermique de l'eau à 0 °C, égale à 0,55 W m−1 K−1.
L'igloo arrondi typique autrefois des Inuits du Grand Nord est fabriqué à partir d'éléments de formes préfabriqués en neige compacte à grains fins taillée en bloc. Il est remarquablement isolant car bien à l'abri sous la structure accessible par un couloir surcreusé la température positive atteint facilement quelques degrés si bien qu' un être humain se découvre parce qu'il fait chaud.
Propriétés optiques
modifierLes effets lumineux du matériau polycristallin qu'est la roche glace paraissent innombrables suivant ces facettes transparentes et les jeux de lumière qui les traversent. Ils sont utilisés par les sculpteurs de glace et les éclairagistes experts des installations ou autres hôtels ou villes de glace éphémères.
La couleur blanche de la glace commune est due aux inclusions gazeuses d'air. D'une manière générale, la glace compacte réfléchit le bleu et absorbe les autres couleurs du spectre visible.
Classification pétrologique et informations paléoclimatologiques
modifierLa glace roche a fait l'objet d'études pétrologiques prolifiques, il en résulte parfois une distinction entre la glace dite :
- magmatique, obtenue par cristallisation d'eau liquide ou recristallisation de glace fondue en totalité ;
- sédimentaire, par exemple la neige, l'eau de neige, la glace accumulée en dépôts de neige plus ou moins glacé, désigné par le nom anglais firn[j], le givre, la gelée blanche, les grêlons, bref le minéral glace défini préalablement ;
- métamorphique, par exemple dans les glaciers où les masses de glace ont subi de fortes pressions. Cette roche glace ne contient pratiquement plus d'air que sous forme de bulles d'air sous pression et peut subir des déformations et des recristallisations. C'est le cas aussi de la glace des calottes polaires.
Il est apparu évident que les carottes de glace, qui peuvent être vieilles de plus de 300 000 ans, recelaient par leurs impuretés des informations sur les paléoclimats. Des modèles permettent à partir des bulles d'air piégées de redécouvrir l'évolution de l'état de l'atmosphère, et surtout percevoir les fines particules ou poussières des éjectas volcaniques ayant perturbé durablement l'atmosphère à un niveau planétaire. Il est alors possible de proposer des températures modèles, d'analyser et de tenter de séparer les retombées volcaniques, terrestres, marines, cosmiques, voire humaines à partir des polluants atmosphériques fossiles ou chimiques récents.
Glace à température ambiante
modifier
En 2005, l'équipe coréenne de Heon Kang, de l'université de Séoul, a pu obtenir une glace d'eau à température ambiante (20 °C). Pour ce faire, un champ électrique est appliqué entre la pointe d'un microscope à effet tunnel et une surface d'or, où est disposé un film d'eau liquide, d'une épaisseur de l'ordre du nanomètre.
Dans cette expérience, l'eau se transforme en glace car les dipôles électrostatiques des molécules d'eau s'alignent sur le champ électrique. L'intensité du champ électrique à laquelle ce changement apparait (106 V m−1) est mille fois moins importante que ce que les modèles prédisaient.
Malgré la très faible épaisseur de la couche d'eau utilisée, ce phénomène pourrait, d'après les auteurs, intervenir au sein de nuages d'orages ou de microfissures de roches, ainsi que dans des équipements nanotechnologiques.
Mélanges
modifierFusion eutectique
modifier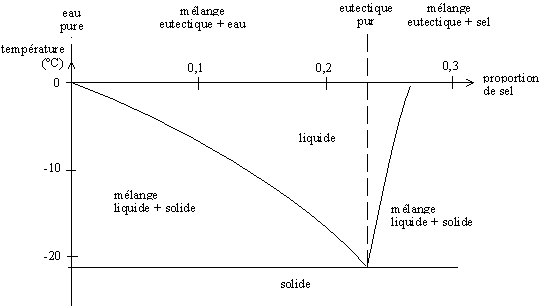
En hiver, les routes sont salées afin de faire fondre la glace. Plus rigoureusement, ce n'est pas la glace qui fond, mais un mélange binaire glace-sel.
Lorsque le sel NaCl (Na+, Cl−) entre en contact avec la glace, les ions se dissocient et se réarrangent autour des molécules d'eau, car celles-ci sont polaires (H2δ+, Oδ−, ce qui permet de former un composé (H2O) (NaCl).
Ce réarrangement nécessite seulement de petits mouvements des atomes, et se fait donc en phase solide.
Lors du salage, le sel (solide) est en excès. Il va donc se réarranger avec l'eau afin de créer une solution eutectique (~23 % en masse). La température de fusion d'un tel mélange est d'environ −21,6 °C. Le sel va donc permettre de faire fondre toute glace en contact si celle-ci n'a pas une température inférieure à −21,6 °C. En Russie, par exemple, par grand froid, l'ajout de sel sur les routes est complètement inefficace. Il faut donc trouver un autre moyen pour permettre de rendre les voies praticables.
Lorsque tout le sel solide s'est dilué dans la glace fondue, la phase liquide obtenue va continuer de faire fondre la glace en contact. La concentration en sel (limité à 23%m) va diminuer progressivement, jusqu'à atteindre un équilibre dicté par la température. Il est possible, à partir du diagramme de phase eau-sel, de déterminer cette concentration finale.
Le diagramme de phase suivant représente la température de fusion du mélange en fonction de la proportion eau-sel.
Histoire
modifierLe mot féminin en latin classique était glacĭēs, ēī, signifiant « glace, glaçon » (mais aussi « dureté, rigidité typique de l'airain ») est bien corrélé au verbe glăciāre signifiant « changer en glace, geler, voire glacer d'effroi ou de peur », mais aussi « durcir, solidifier » ou encore en forme intransitive, « durcir, se congeler, se glacer, se caséifier… ». Mais c'est surtout le mot de latin populaire glacia qui a abouti à l'italien ghiaccio et au français glace. Les langues germaniques ont préservé une autre racine indo-européenne isa, commune au monde celte, ainsi le nordique[Quoi ?] îs, le suédois is, l'allemand Eis, l'anglais ice… alors que les langues slaves pérennisaient led, lo...

Le temps d'irruption probable de la glace, de la neige ou du gel puis de son maintien éventuel est aussi un temps d'hibernation autant pour les hommes que nombre d'animaux, à l'origine de la dénomination de la saison hiver. Mais la glace suffisamment lisse ou la neige porteuse est un support idéal pour la glisse ou le déplacement de charge en traîneau ou de char adapté par le charron en engin glissant. Paradoxalement, les cultures paysannes maîtrisant la traîne demeurent alors actives dans les forêts ou les hauteurs montagnardes, assurant le transport de multiples matériaux ou nourritures humaines ou animales. L'hibernation reste surtout une métaphore agricole avec des réserves engrangées en automne, ainsi qu'une assurance protectrice des plus faibles ou des moins équipés face aux intempéries dans la demeure, bien protégée ou isolée sous sa couche maîtrisée de neige ou de glace[k]. Un des matériaux collectés était parfois la glace ou la neige.
Les plus vieilles bâtisses ou constructions dénommées glacière ayant servi à conserver la glace datent d'il y a quatre mille ans et se trouvent en Mésopotamie. Ce sont des constructions en terre de forme conique inversée.

On retrouve des puits à neige ou puits à glace destinés au commerce de la glace et servant à la conservation de cette denrée partout à travers le monde : Chine depuis le VIIIe siècle av. J.-C., Corée, Méditerranée sans doute avant l'époque romaine, Espagne, Algérie, France, etc., et qui sont apparus dès le XVIe siècle en ce qui concerne l'Europe occidentale. Ces grands bâtiments, parfois sous gestion collective, pouvaient conserver de la glace toute l'année ou au moins jusqu'à la fin d'un été nullement caniculaire afin de fournir les villes et villages les plus proches. En effet, dès la Renaissance, grâce à une période prospère tant sur le plan économique que politique, des échanges interculturels entre France, Italie et Espagne ont permis la redécouverte de ce produit. La glace servait à confectionner des crèmes glacées, rafraîchir boissons et aliments, et surtout à conserver les denrées ou aliments par congélation, tout en étant même prescrite par les médecins pour calmer douleurs, fièvres, anesthésier, etc.
En Angleterre ou en Amérique du Nord, les abris réfrigérants ou glacières, caractérisée par une fosse profonde et une rampe de chargement d'accès facile sont communes dès le XVIIe siècle. Pour renforcer l'isolation de la structure, outre la toiture très souvent en chaume, les gestionnaires des glacières utilisent abondamment la paille isolante, en sous-toit ou sous-enveloppe comme en séparateur de blocs. Pour un abri de capacité de bonne capacité, il n'est pas rare qu'il fallait collecter une centaine de tonnes de glace. La glace épaisse des mares aménagés ou des lacs gelés était souvent préférée par commodité de récolte.
Les « glacières » ont été exploitées jusqu'à la fin du XIXe siècle, c'est-à-dire jusqu'à l'apparition des usines de fabrication de glace permettant de produire la glace industriellement, au jour le jour, sans l'aléa des saisons.


Il existe des hôtels de glace en Suède à Jukkasjärvi, à Québec, en Alaska, en Groënland ou au Canada, voire des villes de glace éphémères en Chine. Elles engloutissent parfois communément jusqu'à 20000 tonnes de neige et 3000 tonnes de glace[réf. souhaitée].
Laboratoire
modifierQuelques laboratoires étudient spécifiquement la glace :
- l'Anti-icing Material International Laboratory (AMIL)[24] ;
- l'Institut des géosciences de l’environnement à Grenoble.
Expressions
modifierLorsqu'on patine sur glace mince, la sécurité est associée à la vitesse. Traduction de la phrase In skating over thin ice, our safety is our speed, citée par le philosophe américain Ralph Waldo Emerson dans la première partie de ses Essays intitulée Prudence et éditée en 1841[25].
Notes et références
modifierNotes
modifier- À l'origine pour Ice hexagonal, mais en réalité la première classe de forme cristalline connue notée I ou 1 de maille hexagonale
- Les théories géologiques décrivant la terre boule de neige au Précambrien supposent une cryosphère globale et parfaite. En réalité, elle a été percée rapidement en quelques points précis grâce aux manifestations volcaniques.
- Aux pressions supérieures à 200 mégapascals, les glaces (de formes II à IX) sont normales, c'est-à-dire plus denses que l'eau.
- L'examen des mécanismes physiques gouvernant la formation des cristaux de neige montre l'influence extrêmement sensible de la température, de la pression de vapeur saturante, de la sursaturation interne et d'autres paramètres externes, expliquant non un monocristal semblable mais les multiples et différentes formes cristallines observés, selon Kenneth G. Libbrecht, The physics of snow crystals, opus cité.
- En pétrographie, le nom est le même, au contraire du couple quartz (minéral)/quartzite (roche). Il faut prendre en compte les typologies différentes des glaces. Par exemple, les glaces des glaciers alpins, tempérés, islandais, n'ont pas les mêmes caractéristiques. Les derniers forment par exemple plus facilement des glaciers de calotte.
- Le glaciologue étudie la taille, la forme, l'agencement des grains ou cristaux individualisés. Mais aussi sa fabrique ou croissance selon les orientations statistiques des axes de symétrie hexagonaux, sa teneur en inclusions :
- gazeuses : bulles d'air fossilisées,
- liquides : gouttelettes d'eau plus ou moins salées ou en surfusion,
- solides : impuretés diverses, (micro)cristaux, clastes de roches, etc.
- Quelques références anciennes en lien externe.
- La glace Ic apparaît à pression très faible et à température de l'hydrogène liquide.
- L'éclatement d'un récipient suffisamment rempli initialement d'eau liquide, par exemple une bouteille en verre, s'observe lors de la congélation de l'eau en glace.
- Le firn, c'est-à-dire ici la glace de névé, neige compacte et partiellement recristallisée en grain par tassement et fusion partielle, alimentant les glaciers, par exemple de calottes, serait potentiellement instable à une dizaine de mètres sous la surface d'amoncellement et pourrait parfois fondre en générant de vastes réservoirs ou poches d'eau au sein du glacier. Il serait à l'origine des eaux infiltrées dans les glaciers. La couche de firn représente pourtant le début et le cours de la métamorphose en glace roche, notamment par élimination progressive de l'air. Sur une piste de ski de fond ou de traîneau traditionnelle, le firn représente déjà la matière visible par la trace verglacée. C'est aussi la vieille neige en partie granuleuse et dense. À noter que le terme der Firn désigne en suisse allemand la vieille neige résiduelle blanchâtre de l'an passé, de masse volumique comprise entre 0,4 et 0,83 g/cm3.
- La glace est un minéral imperméable et isolant, bien sûr si elle reste glace et ne fond pas.
Références
modifier- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- L’eau peut être liquide jusqu’à -48 °C !, sur sciencesetavenir.fr.
- (en) Benjamin J. Murray, « Formation and stability of cubic ice in water droplets », Physical Chemistry Chemical Physics, vol. 8, no 1, , p. 186–192 (PMID 16482260, DOI 10.1039/b513480c, Bibcode 2006PCCP....8..186M, lire en ligne)
- (en) Benjamin J. Murray, « The Enhanced formation of cubic ice in aqueous organic acid droplets », Environmental Research Letters, vol. 3, , p. 025008 (DOI 10.1088/1748-9326/3/2/025008, Bibcode 2008ERL.....3b5008M, lire en ligne)
- (en) Benjamin J. Murray, « The formation of cubic ice under conditions relevant to Earth’s atmosphere », Nature, vol. 434, no 7030, , p. 202–205 (PMID 15758996, DOI 10.1038/nature03403, Bibcode 2005Natur.434..202M)
- (en) Chaplin, Martin, « Ice-four (Ice IV) », Water Structure and Science, London South Bank University, (consulté le )
- (en) Chaplin, Martin, « Ice-five (Ice V) », Water Structure and Science, London South Bank University, (consulté le )
- (en) Chaplin, Martin, « Ice-six (Ice VI) », Water Structure and Science, London South Bank University, (consulté le )
- (fr) « Des cristaux de glace incrustés dans des diamants révèlent des poches d’eau profondément insérées dans le manteau de la Terre », sur gurumed.org, consulté le 20 mars 2018.
- (en) O. Tschauner, S. Huang, E. Greenberg, V. B. Prakapenka, C. Ma3 et al., « Ice-VII inclusions in diamonds: Evidence for aqueous fluid in Earth’s deep mantle », Science, vol. 359, no 6380, , p. 1136-1139 (DOI 10.1126/science.aao3030).
- (en) Chaplin, Martin, « Ice-seven (Ice VII) », Water Structure and Science, London South Bank University, (consulté le )
- (en) Heather M. Hill, « Ice is two-faced under pressure », Physics Today, (DOI 10.1063/PT.6.1.20220425a, lire en ligne
 , consulté le ).
, consulté le ).
- A. D. Fortes, I. G. Wood, D. Grigoriev, M. Alfredsson, S. Kipfstuhl, K. S. Knight et R. I. Smith, No evidence for large-scale proton ordering in Antarctic ice from powder neutron diffraction, J. Chem. Phys. 120 (2004) 11376.
- (en) Chaplin, Martin, « Hexagonal Ice (Ice Ih) », Water Structure and Science, London South Bank University, (consulté le )
- (en) Chaplin, Martin, « Ice-twelve (Ice XII) », Water Structure and Science, London South Bank University, (consulté le )
- (en) A. Falenty, « Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate », Nature, vol. 516, no 7530, , p. 231–233 (DOI 10.1038/nature14014)
- (en) Leonardo del Rosso, Milva Celli et Lorenzo Ulivi, « New porous water ice metastable at atmospheric pressure obtained by emptying a hydrogen-filled ice », Nature Communications, vol. 7, no 13394, (DOI 10.1038/ncomms13394, lire en ligne, consulté le )
- « « Glace XVII » : nouvelle frontière pour l’énergie propre », Ministère français des Affaires étrangères, (consulté le )
- (en) Charles Day, « Superionic ice observed at extreme pressure and temperature », Physics Today, (DOI 10.1063/PT.6.1.20190517a, lire en ligne).
- (en) Marius Millot, Federica Coppari, J. Ryan Rygg, Antonio Correa Barrios, Sebastien Hamel et al., « Nanosecond X-ray diffraction of shock-compressed superionic water ice », Nature, vol. 569, , p. 251-255 (DOI 10.1038/s41586-019-1114-6).
- (en) Gunnar Weck, Jean-Antoine Queyroux, Sandra Ninet, Frédéric Datchi, Mohamed Mezouar et Paul Loubeyre, « Evidence and Stability Field of fcc Superionic Water Ice Using Static Compression », Physical Review Letters, vol. 128, no 16, , article no 165701 (DOI 10.1103/PhysRevLett.128.165701).
- V. F. Petrenko, Physics of Ice
- « LIMA-AMIL », sur www.uqac.ca (consulté le )
- Texte intégral
Voir aussi
modifierBibliographie
modifier- Ch. Martins, G. Chancel, Pressions dues à la congélation de l'eau, dans Annales des ponts et chaussées. Mémoires et documents relatifs à l'art des constructions et au service de l'ingénieur, 1874, 1er semestre, p. 160-164 (lire en ligne)
- Ada Acovitsioti-Hameau, « L'artisanat de la Glace en Méditerranée Occidentale », supplément no 1 au Cahier de l'ASER, 3e éd., 120 p., 2001.
- Textes réunis par Ada Acovitsioti-Hameau, « De Neiges en Glaces… », Actes de la première rencontre internationale sur le commerce et l'artisanat de la glace (Brignoles 1994), supplément no 5 au Cahier de l'ASER, 230 p., 28 articles, 1996.
- Ada Acovitsioti-Hameau, Maxime Duminil et Cédric Rey, « Génies Givrés : les inventeurs du froid artificiel », supplément no 9 au Cahier de l'ASER, 106 p., 2003.
- Ronald L. Bonewitz, Margareth Carruthers, Richard Efthim, Roches et minéraux du monde, Delachaux et Niestlé, 2005, 360 p. (traduction de l'ouvrage anglo-saxon, publié par Dorling Kindersley Limited, London, 2005), en particulier chapitre glace p. 154-155 (ISBN 2-603-01337-8)
- Eun-Mi Choi, Young-Hwan Yoon, Sangyoub Lee, Heon Kang, « Freezing Transition of Interfacial Water at Room Temperature under Electric Fields », Physical Review Letters, no 95, .
- Kenneth G. Libbrecht, « The physics of snow crystals », in Reports on Progress in Physics, vol. 68, Institut of physics publishing, 2005, p. 855-895.
- Louis Lliboutry, Traité de glaciologie, 2 tomes, édition Masson, Paris, 1964.
- Louis Lliboutry, article sur la glace, Encyclopædia Universalis, Paris, 2001.
- Revue La GéoGraphie no 5 sur le thème « Neige & glaces », 2009. En particulier, l'article de Béatrice Collignon surs les « Inuits Peuple du froid » et l'entretien de Gilles Fumey avec Claude Lorius sur les glaces sentinelles.
- (en) Christoph G. Salzmann, « Advances in the experimental exploration of water’s phase diagram featured », Journal of Chemical Physics, vol. 150, no 6, , article no 060901 (DOI 10.1063/1.5085163)
Articles connexes
modifier- Aiguille de surface
- Banquise, frasil, névasse, nilas
- Calotte glaciaire
- Cryergie
- Cryoconite
- Eau
- Gel
- Givre
- Glacier
- Glaçon
- Iceberg
- Neige et pluie verglaçante
- Patinoire
- Permafrost, pergélisol et études de cryopédologie
- Production du froid
- Verglas
- Dans le Wikilivre de Tribologie, des données concernant le frottement sur la glace
- Brise-glace, navire à double action, brise-glace nucléaire.
Liens externes
modifier- Musée de la Glace de Mazaugues
- (en) Présentation du minéral glace ou ice en anglais
- (en) Données minérales, sur webmineral.com
- (en) Cours de physique sur la glace
- (en) Références sur l'hydrologie glaciaire, éditée en 1982
- (en) Ordonnancement des protons dans la glace cubique Ic : spectroscopie et simulations numériques

