Hydrocarbure aromatique
Un hydrocarbure aromatique ou arène[1] est un hydrocarbure dont la structure moléculaire comprend un cycle possédant une alternance formelle de liaisons simples et doubles, et respectant la règle de Hückel sur l'aromaticité. Le qualificatif « aromatique » fut attribué à ces molécules avant la découverte du phénomène physique d'aromaticité, du fait qu'elles dégagent une odeur en général douce.
La configuration aromatique de six atomes de carbone est nommée cycle benzénique, d'après le plus simple hydrocarbure aromatique possible, le benzène. Les hydrocarbures aromatiques peuvent être monocycliques ou polycycliques.
Cycle benzénique
modifier

Le benzène, C6H6, est le plus simple hydrocarbure aromatique, et fut le premier considéré en tant que tel, par la nature de ses liaisons décryptée pour la première fois par Friedrich Kekulé von Stradonitz au cours du XIXe siècle. Par nature, chaque atome de carbone du cycle hexagonal possède 4 électrons de valence qu'il partage avec le système. L'un d'eux est occupé par une liaison covalente avec l'électron de valence d'un atome d'hydrogène et deux autres pour la liaison covalente avec chacun des atomes de carbone voisins. Reste un électron que l'atome de carbone peut partager avec l'un des deux atomes de carbone voisins, pour former une seconde liaison (liaison π), ce qui, formellement, forme un cycle hexagonal avec une alternance de liaisons doubles et simples.
En réalité, ces liaisons π ne sont pas localisées, et les électrons π se retrouvent délocalisés sur tout le cycle, dans une orbitale moléculaire de la taille du cycle, stabilisant la molécule par aromaticité et maintenant la structure du cycle plane (contrairement par exemple au cyclohexane). Les liaisons carbone-carbone du cycle sont environ d'ordre 1,5, et leur longueur est la même partout sur le cycle (dans un système localisé, les liaisons doubles sont plus courtes que les liaisons simples). En 1925, Sir Robert Robinson a introduit, pour mieux rendre compte de cette délocalisation, une représentation en cercle du système π du cycle benzénique, représentation popularisée à partir de 1959 par le manuel de chimie organique Morrison & Boyd. L'usage propre de cette représentation est débattu, servant dans certaines publications à représenter tout système π cyclique, alors que d'autres l'utilisent uniquement pour représenter un système π cyclique aromatique obéissant à la règle de Hückel. William B. Jensen, lui, affirme[2] qu'au regard de la proposition originale de Robinson, l'usage de la représentation par un cercle doit être limitée à des systèmes à six électrons π monocycliques. Dans cette optique, le symbole du cercle pour une liaison 6c–6e peut être comparé au symbole Y pour une liaison 3c-2e.
Les composés comportant un cycle benzénique partagent un certain nombre de propriétés, notamment :
- ils sont en général aromatiques (à quelques exceptions) ;
- leur ratio carbone-hydrogène est élevé ; de ce fait, ils brûlent avec une flamme jaune dégageant beaucoup de fumée ;
- la forte concentration en charge négative sur le cycle le rend nucléophile, et favorise les réactions de type substitution électrophile aromatique.
Le cycle benzénique a aussi la propriété de stabiliser les charges. Par exemple, dans le cas du phénol (C6H5-OH), lorsque le groupe hydroxyle (OH) est déprotoné, la charge négative sur l'atome d'oxygène est partiellement délocalisée sur le cycle benzénique, par mésomérie, ce qui stabilise la forme anionique, et rend de fait le proton du phénol bien moins basique (pKA=9,95) que celui d'un alcool linéaire (pKA entre 18 et 20). Cette délocalisation de la charge favorise les réactions sur le cycle, tels que les substitutions nucléophiles aromatiques et les substitutions électrophiles aromatiques.
Dérivés benzéniques
modifierOn parle de dérivé benzénique (ou de dérivé du benzène) pour les composés comportant un noyau central de benzène substitué par un à six groupes. Par exemple, le phénol et le toluène sont des dérivés benzéniques monosubstitués, le premier possédant un groupe hydroxyle, le second un groupe méthyle attaché au noyau benzénique. Lorsque le noyau benzénique possède plus d'un substituant leur répartition spatiale est la cible d'une nomenclature spéciale, et on répartit les composés dans les différents groupes, ortho, méta et para en fonction de la position respective de chaque groupe. Par exemple, il existe trois isomères du crésol, en fonction de la disposition des groupes hydroxyle et méthyle sur le cycle ; si les deux groupes sont voisins, il s'agit de l'isomère ortho (1,2-méthylphénol), s'ils sont séparés par un atome de carbone non substitué, il s'agit de l'isomère méta (1,3-méthylphénol) et s'ils sont opposés sur le cycle, il s'agit de l'isomère para (1,4-méthylphénol). De même, le xylénol possède deux groupes méthyle et un groupe hydroxyle, ce qui lui donne six isomères.
- Représentation de dérivés benzéniques
-
Acide acétylsalicylique
(aspirine) -
Trinitrotoluène (TNT)
Hydrocarbures aromatiques polycycliques
modifierUne importante famille des hydrocarbures aromatiques sont les hydrocarbures aromatiques polycliques (HAP). Ce sont des composés comportant plusieurs cycles benzéniques fusionnés.
| Composé chimique | Structure | Composé chimique | Structure |
|---|---|---|---|
| Anthracène | Benzo[a]pyrène | 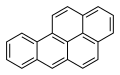
| |
| Chrysène |  |
Coronène | 
|
| Corannulène |  |
Tétracène | |
| Naphtalène | Pentacène | ||
| Phénanthrène | Pyrène | 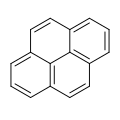
| |
| Triphénylène |  |
Ovalène | 
|
On compte parmi les HAP les plus courants le naphtalène, constitué de deux cycles benzéniques fusionnés, l'anthracène qui en compte trois, alignés, le tétracène (quatre, alignés) et le pentacène (cinq, alignés). Le phénanthrène et le triphénylène sont des exemples d'HAP avec connexions non linéaires. Des HAP plus « exotiques » sont par exemple les hélicènes et le corannulène.
Ces composés sont particulièrement présents dans les dérivés lourds du pétrole et du charbon (goudron de houille). Ils font partie des polluants organiques persistants les plus répandus, restant dans l'environnement marin sur les plages très longtemps après une marée noire. Ils sont toxiques et généralement cancérogènes.
Synthèse
modifierUne réaction formant un hydrocarbure aromatique à partir d'un composé cyclique saturé ou partiellement insaturé est simplement appelée « aromatisation ». Il existe de nombreuses méthodes de laboratoire pour la synthèse organique d'arènes à partir de précurseurs non-arènes. Beaucoup d'entre elles reposent sur les réactions de cycloaddition. On peut citer parmi celles-ci la trimérisation des alcynes, une cyclisation [2+2+2] de trois alcynes, la réaction de Wulff-Dötz, réaction entre un alcyne, le monoxyde de carbone et un complexe carbène-chrome. La réaction de Diels-Alder d'un alcyne avec la pyrone ou la cyclopentadiénone avec dégagement de dioxyde de carbone ou de monoxyde de carbone forme aussi un hydrocarbure aromatique. On peut aussi citer la cyclisation de Bergman, avec pour réactifs un ényne et un donneur d'hydrogène.
Un autre ensemble de méthodes repose sur l'aromatisation de cyclohexanes et d'autres cycles aliphatiques ; on utilise pour ça des réactifs et des catalyseurs utilisés en hydrogénation, comme le platine, le palladium et le nickel (hydrogénation inverse), les quinones et les éléments soufre et sélénium[3].
Réactions
modifierLes hydrocarbures aromatiques réagissent par de nombreuses réactions organiques.
Substitutions aromatiques
modifierLa substitution aromatique est le remplacement d'un des substituants du noyau arénique, souvent un atome d'hydrogène, par un autre substituant. Les deux principaux types sont la substitution électrophile aromatique quand l'autre réactif est un électrophile, et la substitution nucléophile aromatique lorsqu'il est nucléophile. Dans la substitution nucléophile aromatique radicalaire, l'autre réactif est un radical. On peut citer comme exemple de substitution aromatique la nitration de l'acide salicylique[4] :
Réactions de couplage
modifierDans les réactions de couplage, un métal catalyse le couplage entre deux radicaux formels. Les couplages communs avec les hydrocarbures aromatiques donnent :
- une nouvelle liaison carbone-carbone, par exemple des alkylarènes, des vinyl arènes, des biraryls ;
- une nouvelle liaison carbone-azote (aniline) ou une nouvelle liaison carbone-oxygène (composé aryloxy).
On peut citer l'exemple de l'arylation du pentafluorobenzène par le parabromométhylbenzène[5] :
Hydrogénation
modifierL'hydrogénation des arènes crée des cycles saturés ou partiellement insaturés. Le napht-1-ol est complètement réduit en un mélange d'isomères de décalinol[6] :
La résorcine, hydrogénée avec le nickel de Raney en présence d'hydroxyde de sodium aqueux, forme un énolate qui peut être alkylé par l'iodométhane en 2-méthyl-1,3-cyclohexandione[7] :
Cycloadditions
modifierLes réactions de cycloaddition sont peu communes sur les hydrocarbures aromatiques. On peut observer une réactivité thermique inhabituelle de type Diels-Alder dans la réaction de Wagner-Jauregg. D'autres cycloadditions photochimiques peuvent se produire via des excimères.
Articles connexes
modifierNotes et références
modifier- ↑ (en) « arenes », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- ↑ William B. Jensen, The Origin of the Circle Symbol for Aromaticity, 424, Journal of Chemical Education, vol. 86, no 4, avril 2009
- ↑ Jerry March, Advanced Organic Chemistry, 3e éd., (ISBN 0-471-85472-7)
- ↑ K. Webb, « A mild oxidation of aromatic amines », Tetrahedron Letters, vol. 36, , p. 2377–2378 (DOI 10.1016/0040-4039(95)00281-G)
- ↑ M. Lafrance, C. Rowley, T. Woo et K. Fagnou, « Catalytic intermolecular direct arylation of perfluorobenzenes. », Journal of the American Chemical Society, vol. 128, no 27, , p. 8754–8756 (PMID 16819868, DOI 10.1021/ja062509l)
- ↑ Organic Syntheses, Coll. vol. 6, p. 371 (1988) ; vol. 51, p. 103 (1971). http://orgsynth.org/orgsyn/pdfs/CV6P0371.pdf
- ↑ Organic Syntheses, Coll. vol. 5, p. 743 (1973) ; vol. 41, p. 56 (1961), http://orgsynth.org/orgsyn/pdfs/CV5P0567.pdf
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Aromatic hydrocarbon » (voir la liste des auteurs).