Micro-ARN
Les micro-ARN (abréviation : miARN ou miR) constituent une catégorie de petits ARN (en) simple brin, non codants et propres aux cellules eucaryotes[1]. Ils ont une longueur moyenne de 22 nucléotides (21 à 24 en général), nettement moins que la plupart des autres ARN (au moins une centaine).

Les miARN sont des régulateurs post-transcriptionnels capables d’extinction de l’expression d’un gène[2],[3] ; leur appariement à un ARN messager (ARNm) cible peut conduire à l'inhibition de sa traduction ou à sa dégradation, selon le degré de complémentarité entre la séquence du miARN et celle de son ARNm cible[4]. Parce qu’ils affectent l’expression de nombreux gènes, les miARN interviennent dans la plupart des processus biologiques, allant du développement[5] à la formation de tumeurs[6].
Le génome humain contiendrait environ 2 000 gènes à l’origine de la transcription de miARN[7],[8] qui cibleraient environ 60 % des gènes [9],[10]. Il a été mis en évidence que les miARN peuvent être exprimés différentiellement d’un tissu ou d’un type cellulaire à l’autre. Ils sont abondants dans plusieurs types cellulaires chez l'humain[réf. souhaitée].
L’expression aberrante de certains miARN est associée à de nombreuses pathologies[5]. Des thérapies fondées sur une correction de leur abondance sont actuellement à l’étude[11].
Historique
modifierLe premier miARN, lin-4 (en), a été caractérisé au début des années 1990 chez le nématode Caenorhabditis elegans[12]. Les auteurs de cette étude ont découvert que ce petit ARN s'exprimait à la fin du premier stade du développement larvaire. Il se fixait alors à l'ARNm de la protéine LIN-14, inhibait sa synthèse et, ce faisant, induisait la transition entre les deux premières phases larvaires. lin-4 avait donc un rôle fondamental dans le contrôle de la séquence des phases du développement.
Il fallut toutefois attendre le début des années 2000 et la découverte de let-7 (en) chez C. elegans, ainsi que celle d'autres miARN chez différentes espèces, pour qu'un mécanisme de régulation post-transcriptionnel par les miARN puisse être généralisable[13].
Le prix Nobel de médecine a été décerné aux Américains Victor Ambros et Gary Ruvkun le 7 octobre 2024 pour leurs découvertes sur les micro-ARN[14].
Biosynthèse
modifier
Origine et évolution
modifierLes miARN sont bien conservés chez les organismes eucaryotes et seraient une composante ancestrale et indispensable de la régulation de l’expression des gènes[réf. souhaitée]. La voie des miARN, chez les animaux et chez les plantes, pourrait avoir une origine différente et être apparue de manière indépendante[15]. La voie des miARN dériverait d'un système plus ancestral, l'interférence par ARN[16]. Les enzymes Dicer sont notamment responsables de la production de petits ARN interférents (pARNi) à partir de longs ARN double brin[17]. Ce processus, décrit chez la plante, agit comme défense antivirale[18].
Traitement nucléaire
modifierLes miARN sont transcrits, de manière canonique, par une ARN polymérase de type II sous la forme de longs précurseurs tige-boucle appelés miARN primaires (pri-miARN)[1] (figure 1, gauche). Ces pri-miARN sont ensuite clivés par un complexe protéique hétérotrimérique nommé « microprocesseur » (en), formé, notamment, d'une molécule de la ribonucléase III Drosha (en) et deux molécules de son partenaire DGCR8 (en) (Di George syndrome Critical Region 8 - appelé Pasha chez la drosophile et le nématode)[19]. Un produit intermédiaire appelé miARN précurseur (pré-miARN) est ainsi produit.
Un certain nombre de miARN échappent au traitement par Drosha. Dans certains cas, les pré-miARN sont produits à partir d'introns par le splicéosome lors de l'épissage, et alors appelés « miRtrons »[20] (figure 1, droite). Dans d'autres cas, les pré-miARN sont produits à partir d'ARNt[21] ou de petits ARN nucléolaires (snoRNA pour small nucleolar RNAs)[22].
Le pré-miARN a une longueur d'environ 60 nucléotides, replié en tige-boucle imparfaite par complémentarité de bases entre la première moitié et la deuxième moitié de sa séquence.
Les pré-miARN sont transportés de manière active, dépendante du GTP, depuis le noyau vers le cytosol par l'exportine 5 (en).
Traitement cytoplasmique
modifierLe pré-miARN est clivé par un complexe enzymatique comprenant un membre de la famille de la ribonucléase III Dicer et son partenaire protéique TRBP (appelé Loquatious chez la drosophile). La protéine Dicer reconnaît les deux nucléotides de l'extrémité 3' cohésive en utilisant ses domaines protéiques plateforme et PAZ[23]. Dicer agit comme une règle en mesurant 22 nucléotides à partir de l'extrémité 5' ou 3' déterminant ainsi le site de clivage du pré-miARN[24],[25]. Les pré-miARN possédant une extrémité 5' relativement instable (mésappariements, paires G-U ou A-U) s’insèrent dans la poche 5' du domaine plateforme de Dicer. Le site de clivage est alors déterminé à partir de l'extrémité 5', on parle de règle de comptage 5' (5' counting rule)[24]. Lorsque l'extrémité 5' est stable (paire G-C), c'est l’extrémité 3' du pré-miARN qui interagit avec la poche 3' de Dicer localisée dans le domaine PAZ ; dans ce cas, le site de clivage est localisé à 22 nucléotides de l'extrémité 3' (règle de comptage 3')[25]. Dicer permet l'hydrolyse de la structure boucle du pré-miARN et libère un miARN mature, aux extrémités 3' cohésives, appelé « duplex miARN/miARN* (lire miARN étoile) » - ou miARNdb (db pour double brin) - avec un brin guide et un brin passager (figure 1).
Il existe au moins une exception à la maturation des miARN par Dicer, c'est le cas de miR-451 (en), un miARN spécifique des vertébrés et impliqué dans l’érythropoïèse. Dans ce cas, c'est la protéine AGO2 (de la famille Argonaute) qui clive la structure tige-boucle au milieu du bras 3'[26],[27]. Une ribonucléase (PARN) rogne ensuite dans le sens 3' vers 5' pour générer le brin guide de miR-451[28].
Mode d'action
modifier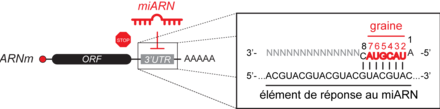
Un brin du duplex miARN/miARN* interagit avec une protéine de la famille Argonaute (AGO1 à 4) pour former un complexe RISC (RNA-induced silencing complex) parfois appelé « miRISC » (figure 3). Les protéines de la famille Argonaute possèdent un domaine PAZ et un domaine PIWI. Chez les mammifères, les miARN semblent chargés indifféremment par l'un des quatre membres de la famille Ago. Ce n'est pas le cas chez la mouche où il n'existe que deux Ago et où les miARN sont préférentiellement orientés vers AGO1.
Le complexe RISC, d'environ 160 kDa, a été décrit comme suffisant à l'activité de gene silencing des miARN, cependant d'autres protéines tel que la géminine peuvent s'y associer pour former des complexes allant jusqu'à 550 kDa[réf. souhaitée]. Le complexe RISC s'associe à d'autres partenaires comme les protéines de la famille GW182 qui recrute à son tour d'autres effecteurs impliqués, notamment, dans la destruction de la queue poly(A), l'élimination de la coiffe 5' ou l'interférence avec l'initiation de la traduction de l'ARNm cible.

Au cours de la formation du miRISC, il y a passage d'un miARNdb à un miARNsb (sb=simple brin). La sélection du brin associé au miRISC s'effectue selon deux règles principales, avec en général une voie majeure pouvant coexister avec une voie mineure[29]. Au sein de la protéine Ago, le domaine MID joue un rôle central dans l'interaction avec l'extrémité 5' du brin guide. La sélection du brin par Ago repose sur l'instabilité de l'extrémité 5' du miARN le rendant plus accessible au domaine MID de la protéine[30]. D'autre part, Ago favorise la présence d'un nucléotide A ou U à l'extrémité 5'[31],[1]. Une fois le miARN chargé, la protéine AGO présente vers l'extérieur de la molécule les nucléotides 2 à 8 du brin guide.
L'ARNm cible est ensuite chargé au sein du complexe miRISC selon la règle de complémentarité des bases avec le miARN. L’hybridation des miARN à leur cible est cependant déterminée préférentiellement par une région restreinte du miARN s’étendant des nucléotides 2 à 7 et appelée « graine » (figure 2). Un miARN peut donc cibler plusieurs sites sur un même ARNm ou cibler plusieurs ARNm ayant une séquence de reconnaissance similaire, appelée élément de réponse aux miARN (MRE, pour miRNA Response Elements) (figure 2). Chez les métazoaires, le site d’hybridation se trouve majoritairement dans la région 3’ non traduite (3’UTR).
Deux voies de « silencing » sont alors possibles, soit un clivage endonucléolytique de l'ARNm cible si la complémentarité avec le miARN est importante, soit une répression de la traduction, associée à une dégradation exonucléolytique des ARNm, dans le cas où la complémentarité entre miARN et ARNm est imparfaite (figure 3). La dégradation des ARNm semble cependant dominer sur l'inhibition de la traduction.
Chez les plantes
modifier
Il existe certaines différences entre la biosynthèse et le mode d'action des miARN chez les plantes et chez les métazoaires. Chez les plantes, le nombre de miARN serait plus restreint et il n'y aurait pas d'intermédiaires pri-miARN (figure 4). La formation du duplex miARN/miARN* par DCL1 (en) (Dicer-like 1, un homologue de Dicer) a lieu dans le noyau ; le duplex mature est ensuite transporté dans le cytoplasme par l'exportine HASTY. De plus, la répression post-transcriptionnelle implique généralement une hybridation parfaite ou quasi parfaite entre le miARN et son ARNm cible, elle va induire une coupure de l'ARNm au milieu du site d'hybridation du miARN[33]. Enfin, chez les plantes, si le site d’hybridation avec le miARN peut se trouver dans la région 3’UTR de l'ARNm, il se situe le plus souvent dans la séquence codante[réf. souhaitée].
Dans certains cas, comme chez la mousse Physcomitrella patens, l'accumulation de duplex miARN:ARN cible pourrait participer à la formation d'un complexe appelé « RITS (en) » (RNA-induced initiation of transcriptional gene silencing) qui, s'associant directement à l'ADN induirait sa méthylation conduisant à une « extinction » de cibles des miARN[34]. Il n'est pas exclu qu'un tel processus existe chez l'animal[réf. souhaitée].
Régulations
modifierLes miARN sont régulés transcriptionnellement comme les gènes codant des protéines. Les miRtrons sont pour leur part régulés transcriptionnellement de la même manière que leur gènes hôtes[35].
Fonctions
modifierLes miARN sont impliqués dans un grand nombre de fonctions physiologiques essentielles[36] telles que :
- la croissance[37] et la différenciation cellulaire[38] ;
- l'apoptose[39] ;
- le métabolisme[40].
Apprentissage et mémoire
modifierContexte
modifierLa mémoire à long terme dépend de l'expression génique, protéique et de modifications structurales des neurones. Par ailleurs, elle repose sur des mécanismes de plasticité synaptique au niveau d'un nombre restreint de synapses spécifiquement impliquées dans la modification du comportement mémorisé[41]. L'expression génique induite par la formation de la mémoire à long terme ayant lieu au niveau nucléaire, se pose la question de savoir si le produit de l'expression des gènes est véhiculé jusqu'aux quelques synapses impliquées dans le comportement à mémoriser ou s'il est réparti de manière homogène dans le neurone, puis traduit localement[42]. Il s'agit de questions majeures dans l’étude de la biologie de la mémoire[43],[44],[45]. La traduction locale, et dépendante de l'activité neuronale, d'ARNm localisés au niveau des axones et des dendrites permettrait de renforcer localement l'efficacité synaptique et de constituer ainsi une « trace » de l'apprentissage et de la conserver en mémoire[43],[46].
Les miARN auraient un rôle central dans ce processus[47]. Les ARNm seraient exprimés et répartis de manière homogène dans l'ensemble des neurones mais verrouillés (locked) par des miARN et le complexe RISC. Lors d'une activité particulière au niveau d'une synapse, le complexe RISC libérerait des ARNm qui seraient alors traduits localement[48],[49]. Les protéines ainsi traduites participeraient à une modulation de l’efficacité synaptique et permettraient la formation d'un trace mémorielle locale[50],[51],[52]. Plusieurs processus pourraient conduire à une modulation locale de la synthèse protéique : maturation de certains miARN, libération d'ARNm verrouillés, ou bien encore dégradation de miARN spécifiques.
Implication du complexe RISC
modifierLa première équipe à avoir impliqué le complexe RISC dans la formation de la mémoire à long terme a utilisé un conditionnement classique chez la mouche du vinaigre[48]. Dans ce modèle de mémorisation, les mouches apprennent à associer une odeur (stimulus conditionnel) à un choc électrique léger (stimulus inconditionnel)[53]. Lorsque les mouches sont ensuite soumises à cette odeur, elles vont chercher à s'en éloigner, il sera possible d'évaluer leur mémoire en analysant leur comportement. Un intérêt du système olfactif est que chaque odorant y active des régions spécifiques des lobes antennaires (équivalent des bulbes olfactifs chez les mammifères).
Les auteurs de l'étude ont mis en évidence qu'un protocole induisant une mémoire à long terme stimulait le transport de l'ARNm de la CaMKII, une protéine importante pour la mémoire, vers les dendrites et induisait la synthèse protéique locale. La région 3'-UTR de la CaMKII, ainsi que de composants (chaîne lourde de la Kinésine, Staufen) de la machinerie de transport des ARNm[54], contiennent des sites cibles de miARN (miR-280, miR-289 et miR-305 (en)). L'apprentissage olfactif induit une dégradation d'un composant associé au complexe RISC - Armitage, orthologue de Mov10l1 (en) chez les vertébrés - par le protéasome, spécifiquement dans les régions activées par l'odorant appris. Cette dégradation d'Armitage déstabiliserait le complexe RISC libérant les ARNm qu'il verrouille, permettant leur traduction et participant à la formation d'une trace à long terme de l'apprentissage dans les réseaux du lobe antennaire sous la forme d'une modification de l'efficacité synaptique.
À la suite de cette étude, un certain nombre de questions demeurent. En effet, les auteurs n'interviennent pas (par inactivation ou sur-expression) sur les miARN identifiés qui, s'ils peuvent théoriquement se lier à la région 3'UTR de la CaMKII, ne présume pas qu'ils aient effectivement une action répressive en conditions physiologiques. Par ailleurs, la protéine Armitage intervient dans la physiologie d'un autre type d'ARN, les ARN interagissant avec Piwi (piRNA) suggérant qu'un autre type d'ARN puisse intervenir dans le processus d'apprentissage et de mémorisation.
Implication du complexe transline/trax
modifierPlus récemment, un autre mécanisme a été décrit. Le complexe transline (en)/trax (en) pourrait être recruté par les synapses activées et participer à la dégradation de miARN libérant ainsi l'expression protéique localement[55]. L'affinité de liaison à l'ARN de la transline est modulée par phosphorylation, lui permettant de se lier à des ARNm cibles, de plus, elle se lie à l'actine lui permettant de se déplacer le long du cytosquelette. Dans l'hippocampe, à la suite d'un apprentissage, la transline serait transloquée vers le compartiment synaptique (en réalité des synaptosomes (en)). Le complexe transline/trax, ayant une activité endonucléolytique, grâce à trax, dégraderait plusieurs miARN dont let-7c (en), miR-125b et miR-128. Ces miARN participant tous à l'inhibition de l'expression du récepteur à l'Activine (ACVR1C (en)), leur dégradation libère la traduction de ce récepteur et contribue ainsi au renforcement de l'efficacité synaptique en lien avec la mémorisation à long terme[49].
MiARN spécifiques
modifierPlusieurs miARN[56] ont été plus spécifiquement impliqués dans la mémorisation comme miR-124 (en)[57], miR-128b[58], miR-132 (en)[59], miR-134 (en)[60], miR-181a (en)[61], ou miR-182[62].
MiR-124
modifierMiR-124 est le premier miARN à avoir été impliqué dans un processus de plasticité synaptique en lien avec l'apprentissage et la mémorisation[63]. Il s'agit d'un miARN fortement conservé par l'évolution, le plus abondant dans le système nerveux central et connu à l'origine pour son rôle dans la différenciation neuronale. L'équipe du Pr Eric Kandel étudiait alors une forme de plasticité synaptique appelée sensibilisation chez un mollusque, le lièvre de mer. Lors de ce phénomène, la rétraction réflexe des branchies, lors d'un stimulus sensoriel neutre sur le siphon, est amplifiée par un stimulus nociceptif préalable sur une autre partie du corps. Ce stimulus conduit à la libération de sérotonine, un neurotransmetteur, sur les neurones sensoriels, amplifiant ainsi leur réponse.
L'équipe du Pr Kandel a mis en évidence que l'application répétée de sérotonine induisait une diminution rapide de l'abondance de miR-124 dans les neurones sensoriels. Cette diminution, dépendante de la MAPK, libérait l'expression de la protéine CREB1, un facteur de transcription central pour la formation de la mémoire à long terme. CREB1 induisait ensuite l'expression de gènes précoces immédiats (en) impliqués dans les modifications neuronales support de la mémorisation. Les auteurs en ont conclu que miR-124 faisait partie des nombreux « verrous » à lever lors de la formation de la mémoire à long terme et qu'il s'agissait d'un mécanisme fortement régulé[57].
MiR-181a, maturation locale et dépendante de l'activité neuronale
modifierEn , l'équipe du Dr Erin Schuman (en) - neurobiologiste spécialiste de la synthèse protéique locale et actuellement directrice de l'institut Max-Planck pour la recherche sur le cerveau - a publié dans la revue Science une étude démontrant qu'un miARN pouvait contrôler l'expression protéique au niveau d'une seule synapse[64].
Les auteurs ont tout d'abord mis en évidence que le précurseur de miR-181a (en) (pré-miR-181a) était fortement exprimé dans les dendrites des neurones de la région CA1 de l'hippocampe, une région cérébrale ayant un rôle central dans la formation de la mémoire. En utilisant une sonde fluorescente permettant de visualiser le clivage du pré-miARN en miARN mature, ils ont montré que l'activité neuronale, sous forme de potentiels d'action, induisait une maturation de miR-181a. Cette maturation était effectuée par Dicer dont l'activité était stimulée par une augmentation de la concentration intracellulaire en via les récepteurs au glutamate de type NMDA. En utilisant une autre technique, dites des neurotransmetteurs « cagés »[65], les auteurs ont libéré du glutamate par photostimulation (en) à proximité immédiate d'une seule synapse afin de n'activer que celle-ci. Ils ont ainsi mis en évidence que miR-181a était maturé uniquement dans cette synapse et qu'il inhibait l'expression de la CaMKII, seulement dans cette synapse. Ce mécanisme permettrait ainsi de contrôler l'expression des gènes au niveau de chaque synapse de manière individuelle et ainsi participer aux mécanismes de plasticité synaptique locaux associés à la formation de la mémoire[43].
Controverse
modifierOn a pu spéculer que les miARN contenus dans des aliments comme le riz, pouvaient être retrouvés dans l'organisme hôte et influencer son métabolisme, si bien qu'ils pourraient être considérés comme une nouvelle classe de micronutriments, au même titre que les vitamines, les phytohormones et les autres phytonutriments[66],[67]. Ceci pouvait pourtant paraître surprenant car les acides nucléiques sont normalement hydrolysés en nucléotides (mono, di et tri) par les nucléases pancréatiques[68]. Les enzymes de la bordure en brosse (nucléosidases et phosphatases) hydrolysent à leur tour les nucléotides en bases azotées et en pentoses avant que ces derniers ne pénètrent dans les entérocytes supprimant ainsi la séquence des miARN et par la même leur caractère informatif. L'hypothèse a été invalidée par la suite, une première étude contestant tout d'abord la reproductibilité des résultats[69] puis une seconde démontrant que l'utilisation des outils de séquençage de nouvelle génération, extrêmement sensibles, n'avaient fait que détecter une contamination des échantillons de l'hôte par des miARN de plantes[70].
Cette controverse pourrait paraître anecdotique si elle ne traduisait pas des enjeux majeurs de la recherche scientifique à l'heure actuelle. Il y a tout d'abord un besoin de reproductibilité des expériences, ensuite, la nécessité d'établir des groupes contrôles adaptés. Par ailleurs, elle alimente un débat qui agite depuis longtemps la biologie de l'évolution et qui pourrait se résumer en un « affrontement » des théories de Charles Darwin et de Jean-Baptiste de Lamarck[71]. En bref, une des problématiques est de déterminer l'influence que peut avoir l'environnement (les « circonstances externes ») sur le patrimoine génétique, s'y inscrire, et dans quelle mesure ces influences pourraient se transmettre d'une génération à l'autre. Le débat est relancé de manière récurrente par des idéologies comme le lyssenkisme, ou à l'occasion de nouvelles découvertes comme le récent développement de l'épigénétique, à laquelle participent les miARN[72].
Autres rôles
modifierMitochondrial
modifierLe rôle central des mitochondries dans le métabolisme cellulaire induit qu'elles soient l'objet d'une régulation fine et réactive. Les gènes importants pour la fonction mitochondriale, et localisés dans le noyau, sont la cible d'une régulation par les miARN, notamment par miR-210 (en)[73]. D'autres liens entre miARN et mitochondrie ont été suggérés par la découverte de miARN localisés dans la mitochondrie et nommés « mitomiR »[74], ainsi que par la présence de la protéine AGO2[75]. De manière surprenante, il a été mis en évidence que miR-1 (en), lors de la différentiation des cellules musculaires, pénétrait dans la mitochondrie où il stimulait la traduction de gènes mitochondriaux, au lieu de la réprimer comme on s'y serait attendu pour un miARN[76]. Plusieurs autres études sont venues confirmer la présence de miARN dans la mitochondrie, ainsi que la présence de composants du complexe RISC, et renforcer de cette manière l'idée selon laquelle les mitomiRs influenceraient le métabolisme mitochondrial et auraient un potentiel impact physiopathologique[77],[78]. La possibilité d'utiliser une régulation de l'expression des miARN pour moduler directement l'homéostasie et la fonction mitochondriales a donc été proposée et un brevet déposé dans ce sens[79].
Viral
modifierQuelques équipes ont étudié l'impact des miARN sur le fonctionnement viral. En effet, certains miARN des cellules hôtes seraient capables de cibler des ARN viraux, conférant un rôle antiviral aux miARN, ou au contraire permettraient au virus de s'accumuler dans la cellule[80]. Cette situation a été notamment décrite pour miR-122, spécifiquement exprimé dans le foie, il favoriserait la réplication de l'ARN des virus de l'hépatite B et C[81].
Pathologies
modifierBilharziose
modifierLes schistosomes sont des vers plats parasitaires causant une maladie appelée la schistosomiase ou bilharziose[82]. Les infections par schistosomes sont chroniques et peuvent perdurer pendant des décennies suggérant que le parasite altère le système immunitaire de son hôte afin de ne pas être éliminé.
Une étude récente indique que Schistosoma japonicum, une des cinq espèces pathogènes, utiliserait des miARN pour détourner la réponse immunitaire de son hôte et ainsi faciliter sa survie dans son hôte[83]. Les auteurs de cette étude ont montré que S. japonicum relargue des vésicules extracellulaires contenant des miARN, principalement miR-125b et bantam. Leurs résultats suggèrent que les miARN sont internalisés par des cellules immunitaires périphériques, les macrophages. Une fois internalisés, ces miARN modifieraient l'expression de nombreux gènes de l’hôte et, ce faisant, augmenteraient la prolifération des macrophages ainsi que la production de TNF-α. Les auteurs suggèrent que ces mécanismes permettent à S. japonicum d’altérer le système immunitaire de l’hôte et mettent en évidence qu'une réduction de la quantité de monocytes ainsi que de TNF-α - par injection de clodronate - réduit la charge en schistosomes et la formation de granulomes hépatiques.
Bien que l’hypothèse des auteurs soit séduisante, jusqu'à très récemment, une controverse perdurait concernant le rôle fonctionnel de la transmission des miARN par les vésicules extracellulaires[84]. En effet, les quantités de miARN véhiculées étant tellement faibles, elles pourraient ne pas avoir d'action physiologique et ce bien qu'elles soient détectées par les techniques de séquençage de nouvelle génération extrêmement sensibles.
Cardiaques
modifierCertains micro-ARN sont nombreux (miR-1 (en), miR-133a, miR-499) ou exprimés de manière spécifique dans les muscles et en particulier le cœur (miR-208a (en)). La survenue d'un infarctus du myocarde entraînerait leur libération dans la circulation sanguine lors de la mort cellulaire ; leur quantification pourrait donc être utilisée comme un marqueur plasmatique précoce de la survenue de l'infarctus[85].
Du système nerveux
modifierPlusieurs maladies neurodégénératives (maladie d'Alzheimer, de Parkinson, de Huntington) sont associées à des modifications de l'abondance de certains miARN spécifiques (miR-34 (en), miR-124 (en) et miR-132 (en))[86].
Maladie d'Alzheimer
modifierLa maladie d'Alzheimer est la cause la plus commune de démence chez les personnes âgées. C'est une maladie neurodégénérative progressive notamment caractérisée, dans sa phase précoce, par des pertes de mémoire, des déficits cognitifs et intellectuels. Au niveau cellulaire, la maladie se caractérise par une perte de neurones, une accumulation extracellulaire de peptide β-amyloïde et intracellulaire de protéine tau pouvant interférer avec le fonctionnement normal des neurones, notamment la plasticité synaptique.
L'abondance de miR-132 est fortement diminuée dans le cerveau de patients Alzheimer et plus précisément dans des structures impliquées dans la mémorisation comme l'hippocampe, le cortex préfrontal et temporal et le cervelet. MiR-132 régulerait de nombreux gènes (MeCP2 (en), SIRT1) impliqués dans les mécanismes moléculaires de l'apprentissage et de la mémorisation, sa dérégulation pourrait donc expliquer une partie des déficits associés à la maladie d'Alzheimer.
MiR-124 est un autre miARN dont l'abondance est diminuée chez les patients souffrant de cette maladie. Ce miARN maintiendrait l'identité des neurones et la plasticité synaptique support de la mémoire à long terme[57] (voir plus haut), sa dérégulation aurait des conséquences néfastes sur ces mécanismes.
L'expression de miR-181a est fortement augmentée dans l'hippocampe de souris 3xTg-AD, un modèle murin de la maladie d'Alzheimer[61]. Cette augmentation est associée à la diminution de l'expression de protéines associées à la plasticité synaptique (sous-unité GluA1 (en) et GluA2 (en) des récepteurs AMPA, PSD95 (en) et Transline (en)). Cependant, l'inhibition de miR-181a est à même de restaurer l'expression de GluA1 et GluA2 et d'améliorer les performances de mémoire spatiale dans un test de localisation d’objets.
| miARN | Régulation | Causes | Cibles | Fonctions | Références |
|---|---|---|---|---|---|
| miR-132 | ↓ | ? (CREB, REST) | MeCP2, SIRT1 | Survie neuronale, plasticité synaptique, mémoire et apprentissage | [86] |
| miR-124 | ↓ | ? (MAPK, REST) | PTBT1, Cdc42, Rac1, Zif268, Glu2A | Maintien identité neuronale, plasticité synaptique | [86] |
| miR-34 | ↑ | p53, SIRT1 | VAMP2, Notch1, mGluR7, ARC, synaptotagmine, syntaxine | Activité neuronale, mémoire et apprentissage | [86] |
| miR-181a | ↑ | Transline | GluA1 et GluA2 | Plasticité synaptique, mémoire et apprentissage | [61] |
Certains miARN circulants (miR-9 (en), miR-125b, miR-146 (en), miR-181c (en), let-7g-5p (en), et miR-191-5p (en)) pourraient être utilisés comme biomarqueurs précoces de la maladie d'Alzheimer[87]. Ces miARN se présentent sous forme libre dans les fluides ou encapsulés dans des exosomes[88].
Maladie de Parkinson
modifierDes miARN circulants pourraient également être utilisés comme biomarqueurs de la maladie de Parkinson[89].
Tumorales
modifierUne mutation ou une dérégulation de certains miARN semble être à l'origine, directement ou indirectement, d'un grand nombre de tumeurs. Ceux qui induisent directement un mécanisme d'initiation du cancer sont qualifiés d'oncomiRs (en)[90]. Un même miARN, comme miR-22, semble pouvoir être tantôt oncogène, tantôt au contraire contribuer à la suppression tumorale[91]. De nombreux miARN sont dérégulés dans les tumeurs solides de façon récurrente. Par exemple, dans les tumeurs du foie, on retrouve souvent une surexpression de miR-21 et une sous-expression de miR-122[92]. De plus, il existe des dérégulations d'expression de miARN associées à des facteurs de risques des carcinomes hépatocellulaires[93].
Certains types de miARN sont également présents dans le plasma sanguin, comme miR-92a (en), et pourraient être de bons biomarqueurs de leucémies[94].
Il semble donc exister des voies de carcinogenèse spécifiques aux miARN qui agiraient alors comme des facteurs de risques ; ceci indique tout l'intérêt des miARN comme marqueurs de diagnostic, de pronostic voir de thérapeutique.
Une étude montre que l'on peut diagnostiquer précocement des cancers du système nerveux central, notamment les glioblastomes, par l'analyse des microARN contenus dans l'urine des patients. L'équipe de chercheurs a mis au point un dispositif facile à industrialiser, composé d'une centaine de millions de nanofibres en oxyde de zinc, qui permet de collecter les microARN en quantité suffisante[95],[96].
Il semblerait que certains rétrovirus au pouvoir oncogène possèdent des miARN au sein de leur génome. Ces miARN, à la suite de leur transcription, pourraient participer à une répression d'ARN viraux et/ou de la cellule hôte et ainsi participer à la progression tumorale[97]. Un défi sera donc de pouvoir mieux identifier les gènes ciblés par ces miARN afin de mieux comprendre leur rôle et les conséquences de leur dérégulation dans le processus d'oncogenèse.
Cibles thérapeutiques
modifierUn certain nombre d'inhibiteurs des miARN sont en cours de développement, ce sont essentiellement de courtes chaînes d'ARN, des oligonucléotides antisens appelés « antagomirs », se fixant par complémentarité sur une partie du microARN cible[98]. Un vecteur qui permettrait leur administration serait un virus non pathogène qui introduirait la séquence de nucléotides dans la cellule[99].
L'administration de miARN à but thérapeutique n'est pas simple car ces derniers sont dégradés avant qu'ils atteignent leur cible. L'utilisation d'acides nucléiques bloqués - analogues conformationnels des nucléotides mais relativement plus résistants aux nucléases - pourrait servir au développement de solutions thérapeutiques basées sur les miARN[11].
Des tests sont ainsi en cours pour le traitement de l'hépatite C[100] et le syndrome d'Alport[101].
Notes et références
modifier- (en) David P Bartel, « Metazoan MicroRNAs », Cell, vol. 173, no 1, , p. 20-51 (PMID 29570994, DOI 10.1016/j.cell.2018.03.006, lire en ligne [PDF], consulté le )

- (en) D. Bartel, « MicroRNAs: Target Recognition and Regulatory Functions », Cell, vol. 136, no 2, , p. 215–233 (PMID 19167326, PMCID 3794896, DOI 10.1016/j.cell.2009.01.002, lire en ligne, consulté le )

- (en) B. Kusenda, M. Mraz, J. Mayer et S. Pospisilova, « MicroRNA biogenesis, functionality and cancer relevance », Biomedical papers, vol. 150, no 2, , p. 205–215 (PMID 17426780, DOI 10.5507/bp.2006.029, lire en ligne [PDF], consulté le )

- (en) Huntzinger E et Izaurralde E, « Gene silencing by microRNAs: contributions of translational repression and mRNA decay », Nat Rev Genet., vol. 12, no 2, , p. 99-110 (PMID 21245828, DOI 10.1038/nrg2936, lire en ligne, consulté le )
- (en) Kloosterman WP et Plasterk RH., « The diverse functions of microRNAs in animal development and disease. », Dev Cell., vol. 11, no 4, , p. 441-50 (PMID 17011485, DOI 10.1016/j.devcel.2006.09.009, lire en ligne [EPUB], consulté le )

- (en) Adams BD, Kasinski AL et Slack FJ, « Aberrant regulation and function of microRNAs in cancer. », Curr Biol., vol. 24, no 16, , p. 762-76 (PMID 25137592, DOI 10.1016/j.cub.2014.06.043, lire en ligne [PDF], consulté le )

- Homo sapiens miRNAs in the miRBase at Manchester University
- (en) Bentwich I, Avniel A, Karov Y, Aharonov R, Gilad S, Barad O, Barzilai A, Einat P, Einav U, Meiri E, Sharon E, Spector Y et Bentwich Z, « Identification of hundreds of conserved and nonconserved human microRNAs. », Nat Genet., vol. 37, no 7, , p. 766-70 (PMID 15965474, DOI 10.1038/ng1590, lire en ligne, consulté le )
- (en) Lewis BP, Burge CB et Bartel DP., « Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. », Cell, vol. 120, no 1, , p. 15-20 (PMID 15652477, DOI 10.1016/j.cell.2004.12.035, lire en ligne [PDF], consulté le )

- (en) Friedman RC, Farh KK, Burge CB et Bartel DP., « Most mammalian mRNAs are conserved targets of microRNAs. », Genome Res., vol. 19, no 1, , p. 92-105 (PMID 18955434, DOI 10.1101/gr.082701.108, lire en ligne [PDF], consulté le )

- (en) Heh-In Im et Paul J Kenny, « MicroRNAs in Neuronal Function and Dysfunction », Trends Neurosci, vol. 35, no 5, , p. 325-34 (PMID 22436491, DOI 10.1016/j.tins.2012.01.004, lire en ligne [PDF], consulté le )
- Cette publication décrit la découverte de lin-4, le premier miRNA découvert chez C.elegans.(en) Lee RC, Feinbaum RL et Ambros V, « The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. », Cell, vol. 75, no 5, , p. 843-54 (PMID 8252621, DOI 10.1016/0092-8674(93)90529-y, lire en ligne [PDF], consulté le )
- (en) Lagos-Quintana M, Rauhut R, Lendeckel W et Tuschl T, « Identification of novel genes coding for small expressed RNAs. », Science, vol. 294, no 5543, , p. 853-8 (PMID 11679670, DOI 10.1126/science.1064921, lire en ligne, consulté le )
- [/www.nobelprize.org/uploads/2024/10/press-medicineprize2024.pdf]
- (en) Axtell MJ, Westholm JO et Lai EC., « Vive la différence: biogenesis and evolution of microRNAs in plants and animals. », Genome Biol., vol. 12, no 4, , p. 221 (PMID 21554756, PMCID PMC3218855, DOI 10.1186/gb-2011-12-4-221, lire en ligne [PDF], consulté le )
- (en) Shabalina SA et Koonin EV., « Origins and evolution of eukaryotic RNA interference. », Trends Ecol Evol., vol. 23, no 10, , p. 578-87 (PMID 18715673, PMCID PMC2695246, DOI 10.1016/j.tree.2008.06.005, lire en ligne [PDF], consulté le )
- Cette publication discute des processus où sont impliqués les siRNAs et les microARN, dans le contexte de deux articles publiés dans le journal Science. (en) Baulcombe D, « DNA events. An RNA microcosm. », Science., vol. 297, no 5589, , p. 2002-3 (PMID 12242426, DOI 10.1126/science.1077906, lire en ligne, consulté le )
- (en) Wang MB et Metzlaff M., « RNA silencing and antiviral defense in plants. », Curr Opin Plant Biol., vol. 8, no 2, , p. 216-22 (PMID 15753004, DOI 10.1016/j.pbi.2005.01.006, lire en ligne, consulté le )
- (en) Denli AM, Tops BB, Plasterk RH, Ketting RF et Hannon GJ, « Processing of primary microRNAs by the Microprocessor complex. », Nature, vol. 432, no 7014, , p. 231-5 (PMID 15531879, DOI 10.1038/nature03049, lire en ligne, consulté le )
- (en) Okamura K, Hagen JW, Duan H, Tyler DM et Lai EC, « The mirtron pathway generates microRNA-class regulatory RNAs in Drosophila. », Cell, vol. 130, no 1, , p. 89-100 (PMID 17599402, DOI 10.1016/j.cell.2007.06.028, lire en ligne, consulté le )
- (en) Haussecker D, Huang Y, Lau A, Parameswaran P, Fire AZ et Kay MA., « Human tRNA-derived small RNAs in the global regulation of RNA silencing. », RNA, vol. 16, no 4, , p. 673-95 (PMID 20181738, PMCID PMC2844617, DOI 10.1261/rna.2000810, lire en ligne [PDF], consulté le )
- (en) Ender C, Krek A, Friedländer MR, Beitzinger M, Weinmann L, Chen W, Pfeffer S, Rajewsky N et Meister G., « A human snoRNA with microRNA-like functions. », Mol Cell., vol. 32, no 4, , p. 519-28 (PMID 19026782, DOI 10.1016/j.molcel.2008.10.017, lire en ligne [PDF], consulté le )
- (en) Liu Z, Wang J, Cheng H, Ke X, Sun L, Zhang QC et Wang HW., « Cryo-EM Structure of Human Dicer and Its Complexes with a Pre-miRNA Substrate. », Cell, vol. 173, no 5, , p. 1191-1203 (PMID 29706542, DOI 10.1016/j.cell.2018.03.080, lire en ligne [PDF], consulté le )

- (en) Park JE, Heo I, Tian Y, Simanshu DK, Chang H, Jee D, Patel DJ et Kim VN., « Dicer recognizes the 5' end of RNA for efficient and accurate processing. », Nature, vol. 475, no 7355, , p. 201-5 (PMID 21753850, PMCID 4693635, DOI 10.1038/nature10198, lire en ligne [PDF], consulté le )

- (en) MacRae IJ, Zhou K, Li F, Repic A, Brooks AN, Cande WZ, Adams PD et Doudna JA., « Structural basis for double-stranded RNA processing by Dicer. », Science, vol. 311, no 5758, , p. 195-8 (PMID 16410517, DOI 10.1126/science.1121638, lire en ligne, consulté le )
- (en) Cheloufi S, Dos Santos CO, Chong MM et Hannon GJ., « A dicer-independent miRNA biogenesis pathway that requires Ago catalysis. », Nature, vol. 465, no 7298, , p. 584-9 (PMID 20424607, PMCID 2995450, DOI 10.1038/nature09092, lire en ligne [PDF], consulté le )

- (en) Cifuentes D, Xue H, Taylor DW, Patnode H, Mishima Y, Cheloufi S, Ma E, Mane S, Hannon GJ, Lawson ND, Wolfe SA et Giraldez AJ., « A novel miRNA processing pathway independent of Dicer requires Argonaute2 catalytic activity. », Science, vol. 328, no 5986, , p. 1694-8 (PMID 20448148, PMCID 3093307, DOI 10.1126/science.1190809, lire en ligne [PDF], consulté le )

- (en) Yoda M, Cifuentes D, Izumi N, Sakaguchi Y, Suzuki T, Giraldez AJ et Tomari Y., « Poly(A)-specific ribonuclease mediates 3'-end trimming of Argonaute2-cleaved precursor microRNAs. », Cell Rep., vol. 5, no 3, , p. 715-26 (PMID 24209750, PMCID 3856240, DOI 10.1016/j.celrep.2013.09.029, lire en ligne [PDF], consulté le )

- (en) Okamura K, Phillips MD, Tyler DM, Duan H, Chou YT et Lai EC, « The regulatory activity of microRNA* species has substantial influence on microRNA and 3' UTR evolution. », Nat Struct Mol Biol., vol. 15, no 4, , p. 354-63 (PMID 18376413, DOI 10.1038/nsmb.1409, lire en ligne, consulté le )
- (en) Khvorova A, Reynolds A et Jayasena SD., « Functional siRNAs and miRNAs exhibit strand bias. », Cell, vol. 115, no 2, , p. 209-16 (PMID 14567918, DOI 10.1016/s0092-8674(03)00801-8, lire en ligne [PDF], consulté le )

- (en) Ghildiyal M, Xu J, Seitz H, Weng Z et Zamore PD., « Sorting of Drosophila small silencing RNAs partitions microRNA* strands into the RNA interference pathway. », RNA, vol. 16, no 1, , p. 43-56 (PMID 19917635, PMCID 2802036, DOI 10.1261/rna.1972910, lire en ligne [PDF], consulté le )

- (en) Gruber AR, Lorenz R, Bernhart SH, Neuböck R et Hofacker IL., « The Vienna RNA websuite. », Nucleic Acids Res., vol. 36, no Web Server issue, , W70-4 (PMID 18424795, PMCID PMC2447809, DOI 10.1093/nar/gkn188, lire en ligne [PDF], consulté le )
- (en) Brodersen P, Sakvarelidze-Achard L, Bruun-Rasmussen M, Dunoyer P, Yamamoto YY, Sieburth L et Voinnet O, « Widespread translational inhibition by plant miRNAs and siRNAs. », Science, vol. 320, no 5880, , p. 1185-90 (PMID 18483398, DOI 10.1126/science.1159151, lire en ligne, consulté le )
- (en) Khraiwesh B, Arif MA, Seumel GI, Ossowski S, Weigel D, Reski R et Frank W, « Transcriptional control of gene expression by microRNAs. », Cell, vol. 140, no 1, , p. 111-22 (PMID 20085706, DOI 10.1016/j.cell.2009.12.023, lire en ligne, consulté le )
- (en) Baskerville S et Bartel DP., « Microarray profiling of microRNAs reveals frequent coexpression with neighboring miRNAs and host genes. », RNA., vol. 11, no 3, , p. 241-7 (PMID 15701730, PMCID PMC1370713, DOI 10.1261/rna.7240905, lire en ligne [PDF], consulté le )
- (en) Sayed D et Abdellatif M., « MicroRNAs in development and disease. », Physiol Rev., vol. 91, no 3, , p. 827-87 (PMID 21742789, DOI 10.1152/physrev.00006.2010, lire en ligne, consulté le )
- (en) Bueno MJ et Malumbres M., « MicroRNAs and the cell cycle. », Biochim Biophys Acta., vol. 1812, no 5, , p. 592-601 (PMID 21315819, DOI 10.1016/j.bbadis.2011.02.002, lire en ligne, consulté le )
- (en) Ivey KN et Srivastava D, « MicroRNAs as regulators of differentiation and cell fate decisions. », Cell Stem Cell, vol. 7, no 1, , p. 36-41 (PMID 20621048, DOI 10.1016/j.stem.2010.06.012, lire en ligne, consulté le )
- (en) Jovanovic M et Hengartner MO., « miRNAs and apoptosis: RNAs to die for. », Oncogene., vol. 25, no 46, , p. 6176-87 (PMID 17028597, DOI 10.1038/sj.onc.1209912, lire en ligne, consulté le )
- Pour revue, voir : (en) Rottiers V et Näär AM., « MicroRNAs in metabolism and metabolic disorders. », Nat Rev Mol Cell Biol., vol. 13, no 4, , p. 239-50 (PMID 22436747, PMCID PMC4021399, DOI 10.1038/nrm3313, lire en ligne, consulté le )
- Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara et S. Mark Williams, Neurosciences, Bruxelles, De Boeck Université, coll. « Neurosciences & Cognition », , 3e éd., 811 p. (ISBN 978-2-8041-4797-6, lire en ligne), chap. 24 (« Plasticité des synapses et des circuits adultes »), p. 575-610.
- (en) Kandel ER., « The molecular biology of memory storage: a dialogue between genes and synapses. », Science., vol. 294, no 5544, , p. 1030-8 (PMID 11691980, DOI 10.1126/science.1067020, lire en ligne, consulté le )
- (en) Sutton MA et Schuman EM., « Dendritic protein synthesis, synaptic plasticity, and memory. », Cell, vol. 127, no 1, , p. 49-58 (PMID 17018276, DOI 10.1016/j.cell.2006.09.014, lire en ligne [PDF], consulté le )

- (en) Martin KC, Casadio A, Zhu H, Yaping E, Rose JC, Chen M, Bailey CH et Kandel ER., « Synapse-specific, long-term facilitation of aplysia sensory to motor synapses: a function for local protein synthesis in memory storage. », Cell, vol. 91, no 7, , p. 927-38 (PMID 9428516, DOI 10.1016/s0092-8674(00)80484-5, lire en ligne [PDF], consulté le )

- (en) Casadio A, Martin KC, Giustetto M, Zhu H, Chen M, Bartsch D, Bailey CH et Kandel ER., « A transient, neuron-wide form of CREB-mediated long-term facilitation can be stabilized at specific synapses by local protein synthesis. », Cell, vol. 99, no 2, , p. 221-37 (PMID 10535740, DOI 10.1016/s0092-8674(00)81653-0, lire en ligne [PDF], consulté le )

- (en) Biever A, Donlin-Asp PG et Schuman EM., « Local translation in neuronal processes. », Curr Opin Neurobiol., vol. 57, , p. 141-148 (PMID 30861464, DOI 10.1016/j.conb.2019.02.008, lire en ligne, consulté le )
- (en) Schratt G., « microRNAs at the synapse. », Nat Rev Neurosci., vol. 10, no 12, , p. 842-9 (PMID 19888283, DOI 10.1038/nrn2763, lire en ligne, consulté le )
- (en) Ashraf SI, McLoon AL, Sclarsic SM et Kunes S., « Synaptic protein synthesis associated with memory is regulated by the RISC pathway in Drosophila. », Cell, vol. 124, no 1, , p. 191-205 (PMID 16413491, DOI 10.1016/j.cell.2005.12.017, lire en ligne [PDF], consulté le )

- (en) Park AJ, Havekes R, Fu X, Hansen R, Tudor JC, Peixoto L, Li Z, Wu YC, Poplawski SG, Baraban JM et Abel T., « Learning induces the translin/trax RNase complex to express activin receptors for persistent memory. », Elife, vol. 6, , e27872 (PMID 28927503, PMCID PMC5606845, DOI 10.7554/eLife.27872, lire en ligne [EPUB], consulté le )

- (en) Hegde AN et Smith SG., « Recent developments in transcriptional and translational regulation underlying long-term synaptic plasticity and memory. », Learn Mem., vol. 26, no 9, , p. 307-317 (PMID 31416904, PMCID PMC6699410, DOI 10.1101/lm.048769.118, lire en ligne, consulté le )
- (en) Ashraf SI et Kunes S., « A trace of silence: memory and microRNA at the synapse. », Curr Opin Neurobiol., vol. 16, no 5, , p. 535-9 (PMID 16962314, DOI 10.1016/j.conb.2006.08.007, lire en ligne, consulté le )
- (en) White-Grindley E et Si K., « RISC-y Memories. », Cell, vol. 124, no 1, , p. 23-6 (PMID 16413478, DOI 10.1016/j.cell.2005.12.027, lire en ligne [PDF], consulté le )
- (en) Tully T et Quinn WG., « Classical conditioning and retention in normal and mutant Drosophila melanogaster. », J Comp Physiol A., vol. 157, no 2, , p. 263-77 (PMID 3939242, DOI 10.1007/bf01350033, lire en ligne, consulté le )
- (en) Job C et Eberwine J., « Localization and translation of mRNA in dendrites and axons. », Nat Rev Neurosci., vol. 2, no 12, , p. 889-98 (PMID 11733796, DOI 10.1038/35104069, lire en ligne, consulté le )
- (en) Chern Y, Chien T, Fu X, Shah AP, Abel T et Baraban JM., « Trax: A versatile signaling protein plays key roles in synaptic plasticity and DNA repair. », Neurobiol Learn Mem., vol. 159, , p. 46-51 (PMID 30017897, PMCID PMC6329659, DOI 10.1016/j.nlm.2018.07.003, lire en ligne [PDF], consulté le )
- Pour revue, voir : (en) Saab BJ et Mansuy IM, « Neuroepigenetics of memory formation and impairment: the role of microRNAs. », Neuropharmacology, vol. 80, , p. 61-9 (PMID 24486712, DOI 10.1016/j.neuropharm.2014.01.026, lire en ligne, consulté le )
- (en) Rajasethupathy P, Fiumara F, Sheridan R, Betel D, Puthanveettil SV, Russo JJ, Sander C, Tuschl T et Kandel E., « Characterization of small RNAs in Aplysia reveals a role for miR-124 in constraining synaptic plasticity through CREB. », Neuron, vol. 63, no 6, , p. 803-17 (PMID 19778509, PMCID PMC2875683, DOI 10.1016/j.neuron.2009.05.029, lire en ligne [PDF], consulté le )

- (en) Lin Q, Wei W, Coelho CM, Li X, Baker-Andresen D, Dudley K, Ratnu VS, Boskovic Z, Kobor MS, Sun YE et Bredy TW., « The brain-specific microRNA miR-128b regulates the formation of fear-extinction memory. », Nat Neurosci., vol. 14, no 9, , p. 1115-7 (PMID 21841775, DOI 10.1038/nn.2891, lire en ligne, consulté le )
- (en) Edbauer D, Neilson JR, Foster KA, Wang CF, Seeburg DP, Batterton MN, Tada T, Dolan BM, Sharp PA et Sheng M., « Regulation of synaptic structure and function by FMRP-associated microRNAs miR-125b and miR-132. », Neuron, vol. 65, no 3, , p. 373-84 (PMID 20159450, PMCID PMC5018398, DOI 0.1016/j.neuron.2010.01.005, lire en ligne [PDF], consulté le )
- (en) Gao J, Wang WY, Mao YW, Gräff J, Guan JS, Pan L, Mak G, Kim D, Su SC et Tsai LH., « A novel pathway regulates memory and plasticity via SIRT1 and miR-134. », Nature, vol. 466, no 7310, , p. 1105-9 (PMID 20622856, PMCID PMC2928875, DOI 10.1038/nature09271, lire en ligne [PDF], consulté le )
- (en) Rodriguez-Ortiz CJ, Prieto GA, Martini AC, Forner S, Trujillo-Estrada L, LaFerla FM, Baglietto-Vargas D, Cotman CW et Kitazawa M., « miR-181a negatively modulates synaptic plasticity in hippocampal cultures and its inhibition rescues memory deficits in a mouse model of Alzheimer's disease. », Aging Cell, vol. 19, no 3, , e13118 (PMID 32087004, PMCID PMC7059142, DOI 10.1111/acel.13118, lire en ligne, consulté le )
- (en) Griggs EM, Young EJ, Rumbaugh G et Miller CA., « MicroRNA-182 regulates amygdala-dependent memory formation. », J Neurosci., vol. 33, no 4, , p. 1734-40 (PMID 23345246, PMCID PMC3711533, DOI 10.1523/JNEUROSCI.2873-12.2013, lire en ligne [PDF], consulté le )
- (en) Fischbach SJ et Carew TJ., « MicroRNAs in memory processing. », Neuron, vol. 63, no 6, , p. 714-6 (PMID 19778498, DOI 10.1016/j.neuron.2009.09.007, lire en ligne [PDF], consulté le )

- (en) Sambandan S, Akbalik G, Kochen L, Rinne J, Kahlstatt J, Glock C, Tushev G, Alvarez-Castelao B, Heckel A et Schuman EM., « Activity-dependent Spatially Localized miRNA Maturation in Neuronal Dendrites. », Science, vol. 355, no 6325, , p. 634-637 (PMID 28183980, DOI 10.1126/science.aaf8995, lire en ligne [PDF], consulté le )
- Alexandre Mourot, « Une cape d’invisibilité pour le glutamate », sur insb.cnrs.fr, (consulté le ).
- (en) Anne-Marie C. Hodge, « Food We Eat Might Control Our Genes - Scientists find rice microRNA inside human cells », Scientific American, (consulté le )
- (en) Zhang L et al., « Exogenous plant MIR168a specifically targets mammalian LDLRAP1: evidence of cross-kingdom regulation by microRNA. », Cell Res., vol. 22, no 1, , p. 107-26 (PMID 21931358, DOI 10.1038/cr.2011.158, lire en ligne, consulté le )
- Elaine N. Marieb et Katja Hoehn (trad. de l'anglais), Anatomie et Physiologie Humaines, Montréal, Pearson ERPI, , 9e éd., 1291 p. (ISBN 978-2-7613-6932-9, lire en ligne), p. 1052
- (en) Brent Dickinson, Yuanji Zhang, Jay S Petrick, Gregory Heck, Sergey Ivashuta et William S Marshall, « Lack of detectable oral bioavailability of plant microRNAs after feeding in mice », Nature Biotechnology, vol. 31, no 11, , p. 965-7 (PMID 24213763, DOI 10.1038/nbt.2737, lire en ligne, consulté le )
- (en) Tosar JP, Rovira C, Naya H et Cayota A., « Mining of public sequencing databases supports a non-dietary origin for putative foreign miRNAs: underestimated effects of contamination in NGS. », RNA, vol. 20, no 6, , p. 754-7 (PMID 24729469, PMCID PMC4024629, DOI 10.1261/rna.044263.114, lire en ligne [PDF], consulté le )
- Article de synthèse sur les différences existants entre les théories de Darwin et de Lamarck ainsi que sur l'influence de l'épigénétique : Jean-Claude BREGLIANO, « Lamarck et Darwin : deux visions divergentes du monde vivant », sur Encyclopédie de environnement, (consulté le ).
- (en) Yao Q, Chen Y et Zhou X., « The roles of microRNAs in epigenetic regulation. », Curr Opin Chem Biol., vol. 51, , p. 11-17 (PMID 30825741, DOI 10.1016/j.cbpa.2019.01.024, lire en ligne, consulté le )
- (en) Chan SY, Zhang YY, Hemann C, Mahoney CE, Zweier JL et Loscalzo J., « MicroRNA-210 controls mitochondrial metabolism during hypoxia by repressing the iron-sulfur cluster assembly proteins ISCU1/2. », Cell Metab., vol. 10, no 4, , p. 273-84 (PMID 19808020, DOI 10.1016/j.cmet.2009.08.015, lire en ligne, consulté le )
- (en) Srinivasan H et Das S., « Mitochondrial miRNA (MitomiR): a new player in cardiovascular health. », Can J Physiol Pharmacol., vol. 93, no 10, , p. 855-61 (PMID 26030833, DOI 10.1139/cjpp-2014-0500, lire en ligne, consulté le )
- (en) Bandiera S, Rüberg S, Girard M, Cagnard N, Hanein S, Chrétien D, Munnich A, Lyonnet S et Henrion-Caude A., « Nuclear outsourcing of RNA interference components to human mitochondria. », PLoS One., vol. 6, no 6, , e20746 (PMID 21695135, DOI 10.1371/journal.pone.0020746, lire en ligne, consulté le )
- (en) Zhang X, Zuo X, Yang B, Li Z, Xue Y, Zhou Y, Huang J, Zhao X, Zhou J, Yan Y, Zhang H, Guo P, Sun H, Guo L, Zhang Y et Fu XD., « MicroRNA directly enhances mitochondrial translation during muscle differentiation. », Cell., vol. 158, no 3, , p. 607-19 (PMID 25083871, DOI 10.1016/j.cell.2014.05.047, lire en ligne, consulté le )
- Pour revue voir : (en) Geiger J et Dalgaard LT., « Interplay of mitochondrial metabolism and microRNAs. », Cell Mol Life Sci., vol. 74, no 4, , p. 631-646 (PMID 27563705, DOI 10.1007/s00018-016-2342-7, lire en ligne, consulté le )
- (en) Bandiera S, Matégot R, Girard M, Demongeot J et Henrion-Caude A., « MitomiRs delineating the intracellular localization of microRNAs at mitochondria. », Free Radic Biol Med., vol. 64, , p. 12-9 (PMID 23792138, DOI 10.1016/j.freeradbiomed.2013.06.013, lire en ligne, consulté le )
- Alexandra Henrion-Caude, Simonetta Bandiera et Stanislas Lyonnet, Methods for Adjusting Expression of Mitochondrial Genome by Microrna, (lire en ligne)
- (en) Pfeffer S et Voinnet O., « Viruses, microRNAs and cancer. », Oncogene., vol. 25, no 46, , p. 6211-9 (PMID 17028601, DOI 10.1038/sj.onc.1209915, lire en ligne, consulté le )
- (en) Girard M, Jacquemin E, Munnich A, Lyonnet S et Henrion-Caude A., « miR-122, a paradigm for the role of microRNAs in the liver. », J Hepatol., vol. 48, no 4, , p. 648-56 (PMID 18291553, DOI 10.1016/j.jhep.2008.01.019, lire en ligne, consulté le )
- (en) Colley DG, Bustinduy AL, Secor WE et King CH., « Human schistosomiasis. », Lancet, vol. 383, no 9936, , p. 2253-64 (PMID 24698483, PMCID PMC4672382, DOI 10.1016/S0140-6736(13)61949-2, lire en ligne [PDF], consulté le )

- (en) Liu J, Zhu L, Wang J, Qiu L, Chen Y, Davis RE et Cheng G., « Schistosoma japonicum extracellular vesicle miRNA cargo regulates host macrophage functions facilitating parasitism. », PLoS Pathog., vol. 15, no 6, , e1007817 (PMID 31163079, PMCID PMC6548406, DOI 10.1371/journal.ppat.1007817, lire en ligne [PDF], consulté le )

- (en) Tkach M et Théry C., « Communication by Extracellular Vesicles: Where We Are and Where We Need to Go. », Cell, vol. 164, no 6, , p. 1226-1232 (PMID 26967288, DOI 10.1016/j.cell.2016.01.043, lire en ligne [PDF], consulté le )

- (en) Wang GK, Zhu JQ, Zhang JT, Li Q, Li Y, He J, Qin YW et Jing Q, « Circulating microRNA: a novel potential biomarker for early diagnosis of acute myocardial infarction in humans. », Eur Heart J., vol. 31, no 6, , p. 659-66 (PMID 20159880, DOI 10.1093/eurheartj/ehq013, lire en ligne, consulté le )
- (en) Hernandez-Rapp J, Rainone S et Hébert SS., « MicroRNAs underlying memory deficits in neurodegenerative disorders. », Prog Neuropsychopharmacol Biol Psychiatry., vol. 73, , p. 79-86 (PMID 27117821, DOI 10.1016/j.pnpbp.2016.04.011, lire en ligne, consulté le )
- (en) Subodh Kumar et P Hemachandra Reddy, « Are Circulating microRNAs Peripheral Biomarkers for Alzheimer's Disease? », Biochim Biophys Acta, vol. 1862, no 9, , p. 1617-27 (PMID 27264337, DOI 10.1016/j.bbadis.2016.06.001, lire en ligne, consulté le )
- (en) Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ et Lötvall JO., « Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. », Nat Cell Biol., vol. 9, no 6, , p. 654-9 (PMID 17486113, DOI 10.1038/ncb1596, lire en ligne, consulté le )
- (en) Ahmad R Arshad, Siti A Sulaiman, Amalia A Saperi, Rahman Jamal, Norlinah Mohamed Ibrahim et Nor Azian Abdul Murad, « MicroRNAs and Target Genes As Biomarkers for the Diagnosis of Early Onset of Parkinson Disease », Front Mol Neurosci, vol. 10, , p. 352 (PMID 29163029, DOI 10.3389/fnmol.2017.00352, lire en ligne, consulté le )
- (en) Esquela-Kerscher A et Slack FJ., « Oncomirs - microRNAs with a role in cancer. », Nat Rev Cancer., vol. 6, no 4, , p. 259-69 (PMID 16557279, DOI 10.1038/nrc1840, lire en ligne, consulté le )
- (en) Xiong J., « Emerging roles of microRNA-22 in human disease and normal physiology. », Curr Mol Med., vol. 12, no 3, , p. 247-58 (PMID 22300138, DOI 10.2174/156652412799218886, lire en ligne, consulté le )
- Ladeiro Y et Zucman-Rossi J., « [miRNAs in cancer: the case of liver tumors]. », Med Sci (Paris)., vol. 25, no 5, , p. 467-72 (PMID 19480827, DOI 10.1051/medsci/2009255467, lire en ligne [PDF], consulté le )
- (en) Ladeiro Y, Couchy G, Balabaud C, Bioulac-Sage P, Pelletier L, Rebouissou S et Zucman-Rossi J., « MicroRNA profiling in hepatocellular tumors is associated with clinical features and oncogene/tumor suppressor gene mutations. », Hepatology., vol. 47, no 6, , p. 1955-63 (PMID 18433021, DOI 10.1002/hep.22256, lire en ligne, consulté le )
- (en) Tanaka M, Oikawa K, Takanashi M, Kudo M, Ohyashiki J, Ohyashiki K et Kuroda M., « Down-regulation of miR-92 in human plasma is a novel marker for acute leukemia patients. », PLoS One., vol. 4, no 5, , e5532 (PMID 19440243, DOI 10.1371/journal.pone.0005532, lire en ligne, consulté le )
- https://www.futura-sciences.com/sante/actualites/cancer-cerveau-simple-test-urine-permettra-detection-tumeurs-cerebrales-88186/
- Yotaro Kitano et al., Urinary MicroRNA-Based Diagnostic Model for Central Nervous System Tumors Using Nanowire Scaffolds, 2021. DOI 10.1021/acsami.1c01754
- (en) Rosewick N, Momont M, Durkin K, Takeda H, Caiment F, Cleuter Y, Vernin C, Mortreux F, Wattel E, Burny A, Georges M et Van den Broeke A., « Deep sequencing reveals abundant noncanonical retroviral microRNAs in B-cell leukemia/lymphoma. », Proc Natl Acad Sci U S A., vol. 110, no 6, , p. 2306-11 (PMID 23345446, DOI 10.1073/pnas.1213842110, lire en ligne, consulté le )
- (en) Krützfeldt J, Rajewsky N, Braich R, Rajeev KG, Tuschl T, Manoharan M et Stoffel M., « Silencing of microRNAs in vivo with 'antagomirs'. », Nature., vol. 438, no 7068, , p. 685-9 (PMID 16258535, DOI 10.1038/nature04303, lire en ligne, consulté le )
- (en) Borel F, Kay MA et Mueller C., « Recombinant AAV as a platform for translating the therapeutic potential of RNA interference. », Mol Ther., vol. 22, no 4, , p. 692-701 (PMID 24352214, DOI 10.1038/mt.2013.285, lire en ligne, consulté le )
- (en) Janssen HL, Reesink HW, Lawitz EJ, Zeuzem S, Rodriguez-Torres M, Patel K, van der Meer AJ, Patick AK, Chen A, Zhou Y, Persson R, King BD, Kauppinen S, Levin AA et Hodges MR., « Treatment of HCV infection by targeting microRNA. », N Engl J Med., vol. 368, no 18, , p. 1685-94 (PMID 23534542, DOI 10.1056/NEJMoa1209026, lire en ligne, consulté le )
- (en) Gomez IG et al., « Anti-microRNA-21 oligonucleotides prevent Alport nephropathy progression by stimulating metabolic pathways. », J Clin Invest., vol. 125, no 1, , p. 141-56 (PMID 25415439, PMCID PMC4382246, DOI 10.1172/JCI75852, lire en ligne, consulté le )
Voir aussi
modifierBibliographie
modifier- Caroline Hartmann, Fabienne Corre-Menguy, Adnane Boualem, Mariana Jovanovic, et Christine Lelandais-Brière, Les microARN - Une nouvelle classe de régulateurs de l’expression génique, Med Sci (Paris), 2004, 20, 894–898 (lire en ligne, consulté le 16 mars 2020).
- (en) Alberts B., Johnson A., Lewis J., Raff M., Roberts K. and Walter P., Molecular Biology of the Cell, 5th edition, Garland Science, New York, 2007, pp. 493-495 (ISBN 978-0815341055).
Articles connexes
modifierLiens externes
modifier- Site internet de l'équipe de recherche "Impact systémique des petits ARN régulateurs" du CNRS à l'IGH - UMR9002
- (en) Animation expliquant le fonctionnement de l'interférence par ARN
- (en) Site du laboratoire de Victor Ambros à UMASS Medical School
- (en) Site du laboratoire de David Bartel au MIT
- (en) Site du laboratoire de Thomas Tuschl au Rockefeller University
- (en) La base de données miRBase
