Utilisateur:Bebelher/Brouillon
Voir Utilisateur:Bebelher/Projets#Benzène (brouillon)
Article d'origine : Benzène#Réactivité chimique
Réactivité chimique modifier
La réactivité chimique du benzène est fortement dépendante de son caractère aromatique. Par exemple, la plupart des alcènes peuvent être hydrogénés sous une pression de1 atm à température ambiante dans une réaction catalysée par le nickel. Dans le cas du benzène, cette même réaction doit être réalisée à 180 °C sous une pression de 2 000 atm.[réf. souhaitée] Cela s'explique par la perte de l'aromaticité lors de la réduction d'une des doubles liaisons du cycle : les électrons n'étant plus délocalisés, le système n'est plus stabilisé. Le benzène aura donc plutôt tendance à réagir par substitution d'un des atomes d'hydrogène de façon à conserver son caractère aromatique.
Substitution électrophile aromatique modifier

La substitution électrophile aromatique est une réaction au cours de laquelle un des atomes d'hydrogène du cycle est substitué par un groupement électrophile.[1] L'intermédiaire réactionnel, nommé « intermédiaire de Wheland »[2], porte une charge positive qui est délocalisée sur l'ensemble du cycle benzénique par mésomérie. Le carbocation se retrouve ainsi stabilisé. Cet intermédiaire réactionnel va finalement perdre un proton de façon à restaurer l'aromaticité.
Cette réaction permet la préparation de composés aromatiques substitués par une grande variété de groupes fonctionnels, mais nécessite généralement un catalyseur tel qu'un acide de Lewis.
Réaction de nitration modifier

L'introduction d'un groupement nitro sur le cycle aromatique, ou nitration, est possible en présence d'ions nitroniums (NO2+). Cet électrophile très puissant est généré à partir d'acide nitrique et d'un autre acide minéral fort, généralement l'acide sulfurique[1],[3].
L'électrophile NO2+ est tout d'abord généré par protonation de l'acide nitrique, suivie de la perte d'une molécule d'eau. Cet ion nitronium, très réactif, réagit sur le benzène pour former l'intermédiaire de Wheland, qui perd un proton afin de restaurer l'aromaticité. Le nitrobenzène préparé selon ce procédé peut ensuite être utilisé pour la synthèse de l'aniline.
Sulfonation modifier
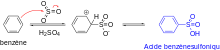
Le benzène réagit avec l'acide sulfurique concentré ou l'oléum (SO3 dissout dans l'acide sulfurique) pour donner l'acide benzènesulfonique selon une réaction de sulfonation[1],[4]. L'espèce électrophile est dans les deux cas le trioxyde de soufre (SO3), qui est formé par déshydratation de l'acide sulfurique. Cet électrophile réagit avec le benzène selon le même mécanisme que celui observé lors de la nitration, puis l'intermédiaire cationique perd un proton pour restaurer l'aromaticité. Cette réaction reste toutefois réversible, et le groupement acide sulfonique peut être éliminé par simple chauffage de l'acide benzènesulfonique dans l'eau en présence d'une trace d'acide sulfurique[4].
Halogénation modifier

Les halogènes (Cl2, Br2…) ne sont pas suffisamment électrophiles pour réagir directement avec le benzène. La réaction d'halogénation doit être catalysée par un acide de Lewis, comme par exemple le chlorure de fer(III) ou le bromure de fer(III). L'activité de ces catalyseurs est due à leur capacité de polarisation de la liaison halogène—halogène[4], par coordination du catalyseur à l'un des doublets non-liants de l'halogène. Si l'on prend l'exemple de la réaction de bromation du benzène, cela permet de générer l'espèce électrophile Br⁺[FeBr4]⁻ qui peut ensuite réagir sur le benzène selon un mécanisme de substitution électrophile aromatique vu précédemment.
Réaction de Friedel-Crafts modifier
Les réactions d'alkylation et d'acylation de Friedel-Crafts sont très importantes en chimie organique, car elles permettent l'introduction rapide de substituants carbonés sur le cycle benzénique. L'espèce électrophile active (un carbocation ou un ion acylium) est généralement obtenue par réaction d'un réactif halogéné en présence d'un acide de Lewis[5],[6].
Alkylation modifier

La réaction du chlorométhane sur le benzène en présence de chlorure d'aluminium permet la synthèse du toluène. En réalité, le toluène peut à son tour réagir avec le chlorométhane, ce qui conduit souvent à un mélange d'isomères dans différentes proportions[7]. La polarisation de la liaison Cl–CH3 par le catalyseur (par mobilisation d'un des groupements non-liants de l'halogène) permet la génération de l'espèce active, qui réagit ensuite selon le mécanisme général de substitution électrophile aromatique.
L'alkylation de Friedel-Crafts n'est cependant pas limitée à l'emploi d'halogénoalcanes. L'acide fluorhydrique permet par exemple de générer un carbocation à partir d'un alcène, suivant la règle de Markovnikov. L'anion fluorure n'attaquant pas immédiatement le carbocation, la réaction de substitution électrophile aromatique du benzène peut avoir lieu[8],[4]. Les alcools peuvent également être utilisés comme source de carbocations, notamment par traitement avec du trifluorure de bore (BF3). Ce dernier est cependant entièrement consommé au cours de la réaction, et doit donc être introduit en quantité stœchiométrique[8].
Bien qu'efficace, cette réaction présente quelques problèmes :
- Le produit de réaction est plus nucléophile que le réactif (à cause de l'effet inductif donneur de la chaîne alkyle introduite). Il est donc difficile de limiter la réaction à la mono-alkylation du benzène.
- Lorsque l'halogénoalcane utilisé conduit à la formation d'un carbocation primaire, ce dernier se réarrange pour former un carbocation secondaire, plus stable. Ainsi, le produit majoritaire formé lors de la réaction du benzène avec 1-chlorobutane est le 2-phénylbutane et non le 1-phénylbutane[7].
Acylation modifier

L'acylation de Friedel-Crafts est utilisée pour introduire un groupement acyle sur le benzène. Le produit d'acylation est généralement obtenu par traitement du benzène (ou tout autre composé aromatique) avec un chlorure d'acide en présence d'un acide de Lewis fort tel le chlorure d'aluminium. L'ion acylium intermédiaire réagit sur le benzène, puis l'intermédiaire cationique (stabilisé par mésomérie) est déprotoné pour restaurer l'aromaticité du cycle. La cétone aromatique est obtenue après hydrolyse du milieu réactionnel[8].
Cette réaction présente plusieurs avantages face à la réaction d'alkylation de Friedel-Crafts :
- L'ion acylium ne se réarrange pas, un seul régioisomère est donc formé.
- La groupement carbonyle étant désactivant, la réaction s'arrête à la mono-acylation.
En revanche, il est nécessaire d'employer le catalyseur en quantité stœchiométrique car ce dernier reste chélaté à l'atome d'oxygène du produit de réaction.
L'acylation du benzène suivie de la réduction de la fonction cétone permet de palier les problèmes rencontrés lors de l'alkylation de Friedel-Crafts (réarrangement du carbocation, produit plus nucléophile que le réactif). Cette approche peut ainsi permettre la synthèse de l'éthylbenzène par réaction du benzène avec le chlorure d'acétyle, ou bien du 1-propylbenzène par réaction avec le chlorure de propyle[7]. Les réductions de Wolff-Kishner et de Clemmensen peuvent être utilisées pour réduire les cétones intermédiaires en chaînes hydrocarbure.
Ligand modifier
- Jonathan Clayden, Stuart Warren et Nick Greeves (trad. André Pousse), Chimie organique, De Boeck Supérieur, , 1534 p. (ISBN 978-2-7445-0149-4, lire en ligne), p. 549-555
- (en) G. W. Wheland, « A Quantum Mechanical Investigation of the Orientation of Substituents in Aromatic Molecules », Journal of the American Chemical Society, vol. 64, no 4, , p. 900-908 (DOI 10.1021/ja01256a047)
- (en) Lyle F. Albright, Nitration, Wiley-VCH Verlag GmbH & Co, coll. « Kirk‑Othmer Encyclopedia of Chemical Technology »,
- P S Kalsi, Organic Reactions And Their Mechanisms, New Age International, (ISBN 978-81-224-1268-0, lire en ligne), p. 288-290
- Jonathan Clayden, Stuart Warren et Nick Greeves (trad. André Pousse), Chimie organique, De Boeck Supérieur, , 1534 p. (ISBN 978-2-7445-0149-4, lire en ligne), p. 569
- Jonathan Clayden, Stuart Warren et Nick Greeves (trad. André Pousse), Chimie organique, De Boeck Supérieur, , 1534 p. (ISBN 978-2-7445-0149-4, lire en ligne), p. 573-574
- (en) Singh, Advanced Organic Chemistry: Reactions And Mechanisms, Pearson Education India, (ISBN 978-81-317-1107-1, lire en ligne), p. 311-312
- P S Kalsi, Organic Reactions And Their Mechanisms, New Age International, (ISBN 978-81-224-1268-0, lire en ligne), p. 290-297