Utilisateur:Manuguedin/Brouillon
- → N'hésitez pas à publier sur le brouillon un texte inachevé et à le modifier autant que vous le souhaitez.
- → Pour enregistrer vos modifications au brouillon, il est nécessaire de cliquer sur le bouton bleu : « Publier les modifications ». Il n'y a pas d'enregistrement automatique.
Si votre but est de publier un nouvel article, votre brouillon doit respecter les points suivants :
- Respectez le droit d'auteur en créant un texte spécialement pour Wikipédia en français (pas de copier-coller venu d'ailleurs).
- Indiquez les éléments démontrant la notoriété du sujet (aide).
- Liez chaque fait présenté à une source de qualité (quelles sources – comment les insérer).
- Utilisez un ton neutre, qui ne soit ni orienté ni publicitaire (aide).
- Veillez également à structurer votre article, de manière à ce qu'il soit conforme aux autres pages de l'encyclopédie (structurer – mettre en page).
- → Si ces points sont respectés, pour transformer votre brouillon en article, utilisez le bouton « publier le brouillon » en haut à droite. Votre brouillon sera alors transféré dans l'espace encyclopédique.
Les gaz nobles, ou plus couramment les gaz rares, sont un groupe d’éléments chimiques avec des propriétés similaires : dans les conditions normales, ce sont des gaz monoatomiques incolores et inodores avec une réactivité chimique très faible. Les six gaz nobles naturels sont l’hélium (He), le néon (Ne), l’argon (Ar), le krypton (Kr), le xénon (Xe) et le radon (Rn), ce dernier étant radioactif.
Pour les six premières périodes de la classification des éléments, les gaz nobles sont exactement les éléments chimiques du groupe 18 (anciennement « groupe VIIIA » voire « groupe 0 »). Un septième élément est venu s'ajouter au groupe 18 au début des années 2000 : l'élément 118 (ununoctium, Uuo), élément synthétique relevant de la dénomination systématique de l'UICPA. Cependant, il est possible qu’en raison d’effets relativistes, c’est plutôt le flérovium l’élément du groupe 14 qui présente des propriétés de gaz nobles, plutôt que l’ununoctium.
Les propriétés des gaz nobles peuvent être facilement expliquées par les théories modernes de la structure atomique : la couche de valence de ces éléments est remplie, ce qui leur confère une faible réactivité avec d’autres composés chimiques. Ainsi seul un petit nombre de composés avec des gaz nobles a été synthétisé à ce jour.
L’argon est le gaz noble le plus abondant sur terre, les autres gaz nobles étant présents en quantité négligeable. Tous les gaz nobles sont présents dans en faible proportion dans l’atmosphère terrestre et ainsi se retrouvent dans la croute terrestre, à l’exception de l’hélium qui est lui aussi présent en petites quantités dans le gaz naturel.
La découverte de ces éléments s’est faite en un temps très court entre 1868 (Hélium) et 1900 (Radon), principalement par le chimiste britannique William Ramsay. Les gaz nobles ont d’importantes applications industrielles telles que dans l’éclairage, la soudure,et l’exploration spatiale.
Terminologie modifier
L’appellation gaz rares vient de leur faible prévalence historique comme substance chimique, bien que cela soit plutôt impropre car l'hélium constitue 24 % de la matière baryonique de l'univers, et l'argon 0,94 % de l'atmosphère terrestre au niveau de la mer.
Autrefois également appelés gaz inertes, cette appellation est tombée en désuétude depuis qu'on a synthétisé des centaines de composés du xénon.
Préconisée par l'IUPAC et le Bulletin officiel du ministère français de l'Éducation nationale[1], l'appellation gaz nobles, issue de l'allemand Edelgas par analogie avec les métaux nobles (tels que l'or, également peu réactif), apparaît donc de plus en plus comme devant légitimement remplacer à terme celle de gaz rares ; c'est celle retenue dans cet article.
Histoire modifier

La première mention que l’air contient un gaz inerte date de 1783. Elle est faite par Henry Cavendish ; il fait réagir de l’air et de l’oxygène avec l’aide de triboélectricité et forme ainsi des oxydes d’azote en obtenant un reste de gaz non réactif après réaction complète. Son expérience s’arrête là, sans reconnaitre que le reste gazeux est un mélange constitué d’argon et d’autres gaz nobles[2].

La première découverte d’un gaz noble, l’hélium, est faite le 18 aout 1868 par Jules Janssen et Norman Lockyer. Les deux astronomes observent alors le spectre du soleil, Jansen en Inde, Lockyer en Angleterre, et découvrent une raie spectrale inconnue à une longueur d’onde de 587,49 nm.[3]. Le nouvel élément est nommé « Hélium » par Edward Frankland d’après le grec {ἥλιος hélios qui signifie Soleil. Par la suite, la première découverte de l’hélium sur terre date de 1892. Elle est faite par Luigi Palmieri en analysant le spectre de la lave du Vésuve..[4] Les experiences de décomposition de l’air de Cavendish sont poursuivies par Lord Rayleigh à partir de 1888. Il remarque que l’azote extrait de l’air possède une densité différente de celle issue de la décomposition de l’ammoniac et soupçonne donc qu’il doit y avoir un composé inerte inconnu dans l’air. Avec la collaboration de William Ramsay, Il isole ce compose inerte en utilisant une réaction du magnésium avec l’azote d’un échantillon d’air. En 1894, Ils parviennent enfin par analyse spectroscopique à prouver l’existence d’un nouvel élément qu’ils nomment, argon, d’après le mot grec αργός (argós, "inactif")[5]. Dans son effort pour découvrir l’argon, Ramsay réussit aussi à isoler l’hélium pour la première fois en chauffant de la cleveite. Ref à rajouter.
La détermination des principales propriétés de l’hélium et de l’argon permit de se rendre compte que, contrairement aux autres gaz atmosphériques, ils étaient monoatomiques. Ces gaz différent aussi des autres gaz gaz polyatomiques car leurs rapports des capacités thermiques- rapport entre la capacité thermique molaire à pression constante, Cp et la capacité thermique molaire à volume constant, CV - ont une valeur très élevée de 1,67 .[6]. William Ramsay réalise alors qu’une classe entière de gaz est manquante dans la table périodique. Et c’est ainsi qu’en 1902, Dmitri Mendeleev inclura un groupe pour les gaz nobles, le groupe 0, dans son arrangement d’éléments, qui deviendra plus tard le tableau périodique des éléments [7]. William Ramsay continue avec Morris William Travers, par la méthode de la distillation fractionnée de séparer l’air liquéfié en plusieurs constituants. En 1898, ils découvrent les éléments krypton, neon, and xenon, et les nomment d’après les mots grecs κρυπτός (kryptós, "caché"), νέος (néos, "nouveau"), and ξένος (xénos, "etranger"), respectivement. Le dernier des gaz nobles naturels, le radon, est décourvert en 1900 par Friedrich Ernst Dorn,[8]. Il est nommé initialement Radium emanation « émanation du radium », et noté Em. C’est alors l’isotope 222Rn. Plus tard, Ernest Rutherford et André-Louis Debierne découvrent d’autres isotopes du radon, en les considérant comme des éléments séparés. William Ramsay étudie leurs spectres et leurs propriétés et y reconnait un nouvel élément unique qu’il nomme Niton (Nt ) [9]. Le nom Radon est donné a cet élément en 1934[10].
Après des tentatives infructueuses en 2002-2005, la découverte du dernier élément du groupe 18, l’ ununoctium est annoncée en 2006 à l’ institut unifié de recherches nucléaires de Dubna , Russie en collaboration avec le laboratoire national de Lawrence Livermore (Etats-Unis). [11] Il est à noter que des experiences préliminaires suite à la découverte de l’élement 114, le flérovium en 1998, indique qu’il pourrait être le premier transactinide à posséder des propriétés anormales de gaz nobles [12] [13] plutôt que l'élément du groupe 18, l' ununoctium.[14] Peu de temps après la décourverte des premiers gaz rares, le chimiste français Henri Moissan tente sans succès de faire réagir l’argon avec du fluor, l’élement le plus électronegatif . En 1924, Andreas von Antropoff revendique avoir formé le premier composé de krypton et de chlore, sous la forme d’un solide rouge. Plus tard, Il s’avére que le composé contient non pas du krypton mais du monoxyde d'azote et du chlorure d'hydrogène. [15] Avec l’hexafluoroplatinate de xénon, Neil Bartlett synthétise le premier composé chimique d’un gaz noble en 1962 [16]. Dans la même année, le tétrafluorure de xénon et le difluorure de xénon sont obtenus par Howard Claassen [17] Et Rudolf Hoppe [18] respectivement. Toujours en 1962, c’est un premier composé de radon le fluorure de radon, qui est découvert, [19] et en 1963, un premier composé du krypton, le difluorure de krypton.[20]. Il faut attendre l’an 2000 pour la mention d’un premier composé de l’argon, le fluorohydrure d'argon.[21].
Abondance modifier
L’abondance des gaz nobles dans l’univers décroit avec leurs nombres atomiques, et cela s’explique en grande partie par le mécanisme de nucléosynthèse primordiale. L’hélium est ainsi l’élement le plus abondant de l’univers après l’hydrogène. Il s’est formé en grande partie lors de la nucléosythese primordiale mais est aussi produit par la réaction de fusion de l’hydrogène qui a lieu dans les étoiles et dans une moindre mesure par le mécanisme de désintegration radioactive alpha.).[22][23] Le neon et l’argon font aussi partie des éléments les plus fréquents dans l’univers alors que le krypton, le xeon et le radon sont beaucoup plus rares. Ces trois derniers éléments ne sont en effet pas produits lors de la nucléosynthèse stellaire mais uniquement lors d’événements plus rares, les supernovas. De plus, le nombre pair de protons dans la structure des gaz nobles conduit à une abondance plus grande des gaz nobles par rapport à beaucoup d’autres éléments en vertu de l’ effet d'Oddo-Harkins.
| Elément | Système solaire[24] (Atome rel. à Si (Si = 1 • 106)) |
Atmosphère terrestre[25] (Volume, ppm) |
Croûte terrestre[26] (Masse, ppm) |
|---|---|---|---|
| He | 2,21 • 109 | 5,24 | 0,008 |
| Ne | 3,44 • 106 | 18,18 | 0,005 |
| Ar | 1,172 • 105 | 9340 | 3,5 |
| Kr | 46,8 | 1,14 | 0,0001 |
| Xe | 5,38 | 0,09 [27] | 3 • 10−5 |
| Rn | 0,06…18 • 10−19[27] | 4 • 10−13 |
Sur terre, les gaz nobles sont principalement présents dans l’atmosphère et en quantités plus faibles dans la croûte terrestre. La répartition des gaz nobles sur terre suit une tendance très différente de la répartition dans l’univers. L’argon est par exemple le gaz noble le plus commun dans atmosphère avec une proportion volumique de 0,934 % (9340 ppm), constituant le 3ème élément le plus abondant dans atmosphère. C’est par un mécanisme de désintégration radioactive, que l’abondance de l’argon terrestre est augmentée ; son isotope majoritaire 40Ar, est ainsi produit par la désintégration de l’isotope 40K du potassium. Tous les autres gaz nobles sont des gaz mineurs dans la composition de l’atmosphère. Le krypton, le xenon et le le radon étant même dans la listes des éléments les plus rares sur terre. [25]. L’hélium s’échappe régulièrement de atmosphère terrestre en raison de sa faible densité et n’est que le troisième gaz noble en proportion sur terre, même s’il se concentre dans le gaz naturel où il peut atteindre une proportion de 16 %. [28]. La majeure partie de l’hélium terrestre ne provient pas de la nucléosynthèse primordiale mais presque exclusivement de la désintégration alpha d’élément lourd comme l’uranium et le thorium. Il existe un déficit inexpliqué de xénon dans l’atmosphère qui pourrait être dû à un emprisonnement du xénon dans les minéraux [29],en particulier le quartz dans lequel le xénon pourrait se subsituer au silicium.[30] Le radon, avec son isotope majoritaire 222Rn, fait partie de la chaine de désingégration radioactive de l’uranium 238 et est produit par ce biais dans la lithosphère. D’autres isoptopes du radon sont aussi formés par des désintégrations de différents isotopes d’uranium, de thorium ou de neptunium. En raison des nombreux processus de désintégration décrits ci-dessus, les gaz nobles se retrouvent emprisonnés dans les roches, par exemple l’hélium dans la pechblende ou l’argon dans le basalte[31].
Production modifier
A l’exception d’une très grande partie de l’hélium qui est extrait du gaz naturel et du radon, le reste des gaz nobles est issue de la liquéfaction de l’air puis de la séparation des consituants par distillation fractionnée. Celle-ci nécessite plusieurs étapes pour séparer d’abord l’argon d’une part, l’hélium et le néon dans une autre part, le krypton et le xénon en dernier. Puis de séparer dans un deuxième procédé l’hélium du néon, et le krypton du xénon [27]. Le radon est produit par désintégration radioactive du radium. En raison de sa courte période radioactive, il est impossible de produire de grande quantité de radon en même temps.
Propriétés modifier
Propriétés physiques et atomiques modifier
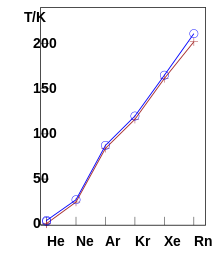
Tous les gaz nobles sont aux conditions normales des gaz monoatomiques incolores et inodores. Ils se condensent et se solidifient à des températures très basses et leurs points d’ébullition et de fusion augmentent avec leurs masses atomiques : la température d’ébullition de l’hélium est de 4,224 K (−268,926 °C), très proche du zéro absolu, alors que celle du radon est de 211,9 K (−61,25 °C).
L’hélium possède de nombreuses propriétés uniques : son point d’évaporation et le plus bas de tous les éléments et c’est le seul élément qui ne peut pas se solidifier à la pression atmosphérique. Au lieu de cela il passe dans un état spécial de la matière en dessous de 2,17 K, l’état superfluide. Il faut appliquer une pression de 25,316 bar pour réussir à obtenir de l’hélium solide à une température de 0,775 K.
Propriétés chimiques modifier
Composés modifier
Utilisations modifier
Notes et références modifier
- BO physique-chimie.pdf, p 17.
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, (ISBN 3-540-67033-5), S. 211–216.
- R. K. Kochhar: French astronomers in India during the 17th–19th centuries. In: Journal of the British Astronomical Association. 1991, 101, S. 95–100 (Artikel)
- Helmut Sitzmann: Helium. In: Römpp Lexikon Chemie. Thieme Verlag, Stand Dezember 2006.
- Ojima 2002, p. 1
- Günther Bugge: Das Buch der großen Chemiker, Verlag Chemie, Weinheim 1974, (ISBN 3-527-25021-2), S. 255.
- Mendeleev 1903, p. 497
- J. R. Partington, « Discovery of Radon », Nature, vol. 179, no 4566, , p. 912 (DOI 10.1038/179912a0, Bibcode 1957Natur.179..912P)
- W. Ramsay and R. W. Gray, « La densité de l’emanation du radium », C.R. Hebd. Séances Acad. Sci., vol. 151, , p. 126–128 (lire en ligne)
- Ulrich Abram, Felix Geldsetzer, Helmut Sitzmann: Radon. In: Römpp Lexikon Chemie. Thieme Verlag, Stand Dezember 2007.
- Yu. Ts. Oganessian, V. K. Utyonkov, Yu. V. Lobanov, F. Sh. Abdullin, A. N. Polyakov, R. N. Sagaidak, I. V. Shirokovsky, Yu. S. Tsyganov, A. A. Voinov, G. G. Gulbekian, S. L. Bogomolov, B. N. Gikal, A. N. Mezentsev, S. Iliev, V. G. Subbotin, A. M. Sukhov, K. Subotic, V. I. Zagrebaev, G. K. Vostokin, M. G. Itkis: Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions. In: Phys. Rev. C. 2006, 74, 4, S. 044602-1–044602-1, DOI 10.1103/PhysRevC.74.044602.
- « Gas Phase Chemistry of Superheavy Elements » [PDF], Texas A&M University (consulté le )
- « Flerov laboratory of nuclear reactions », JINR (consulté le )
- Nash, Clinton S., « Atomic and Molecular Properties of Elements 112, 114, and 118 », J. Phys. Chem. A, vol. 109, no 15, , p. 3493–3500 (PMID 16833687, DOI 10.1021/jp050736o)
- John F. Lehmann, Hélène P. A. Mercier, Gary J. Schrobilgen: The chemistry of krypton. In: Coordination Chemistry Reviews. 2002, 233/234, S. 1–39, DOI 10.1016/S0010-8545(02)00202-3.
- N. Bartlett, « Xenon hexafluoroplatinate Xe+[PtF6]– », Proceedings of the Chemical Society, no 6, , p. 218 (DOI 10.1039/PS9620000197)
- (en) H. H. Claassen, H. Selig et J. G. Malm, « Xenon Tetrafluoride », J. Am. Chem. Soc., vol. 84, no 18, , p. 3593 (DOI 10.1021/ja00877a042).
- (en) R. Hoppe, W. Daehne, H. Mattauch et K. Roedder, « Fluorination of Xenon », Angew. Chem. Intern. Ed. Engl., vol. 1, , p. 599 (DOI 10.1002/anie.196205992).
- Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H., « Radon Fluoride », Journal of the American Chemical Society, vol. 84, no 21, , p. 4164–4165 (DOI 10.1021/ja00880a048)
- Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V., « Krypton Tetrafluoride: Preparation and Some Properties », Science, vol. 139, no 3559, , p. 1047–1048 (PMID 17812982, DOI 10.1126/science.139.3559.1047, Bibcode 1963Sci...139.1047G)
- Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku, « A stable argon compound », Nature, vol. 406, no 6798, , p. 874–876 (PMID 10972285, DOI 10.1038/35022551)
- Achim Weiss, « Elements of the past: Big Bang Nucleosynthesis and observation », Max Planck Institute for Gravitational Physics (consulté le )
- Coc, A.; et al., « Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements », Astrophysical Journal, vol. 600, no 2, , p. 544 (DOI 10.1086/380121, Bibcode 2004ApJ...600..544C, arXiv astro-ph/0309480)
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews, 1970, 15, S. 121–146 (PDF).
- David R. Williams: Earth Fact Sheet. NASA, Greenbelt, Stand 20. Mai 2009.
- David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, (ISBN 978-1-4200-9084-0), Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, p. 14-18.
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (DOI 10.1002/14356007.a17_485).
- Helmut Sitzmann: Helium. In: Römpp Lexikon Chemie. Thieme Verlag, Stand Dezember 2006.
- Chrystèle Sanloup, « Retention of Xenon in Quartz and Earth's Missing Xenon », Science, vol. 310, no 5751, , p. 1174–1177 (PMID 16293758, DOI 10.1126/science.1119070, Bibcode 2005Sci...310.1174S)
- Tyler Irving, « Xenon Dioxide May Solve One of Earth's Mysteries », L’Actualité chimique canadienne (Canadian Chemical News), (consulté le )
- Chris J. Ballentine: Geochemistry: Earth holds its breath. In: Nature. 2007, 449, S. 294–296, DOI 10.1038/449294a.
