Acide aminé
Un acide aminé est un acide carboxylique qui possède également un groupe fonctionnel amine. De tels composés organiques ont donc à la fois un groupe carboxyle –COOH et un groupe amine, par exemple une amine primaire –NH2 ou une amine secondaire –NH–. Dans le monde vivant, on connaît environ 500 acides aminés, dont environ 149 sont présents dans les protéines[1]. Ces acides aminés peuvent être classés de nombreuses manières différentes[2] : on les classe ainsi souvent en fonction de la position du groupe amine par rapport au groupe carboxyle en distinguant par exemple les acides α-aminés, β-aminés, γ-aminés ou δ-aminés ; on peut également les classer en fonction de leur polarité, de leur point isoélectrique ou de leur nature aliphatique, aromatique, cyclique ou à chaîne ouverte, voire de la présence de groupes fonctionnels autres que le carboxyle et l'amine qui définissent cette classe de composés.

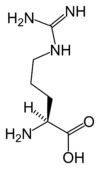
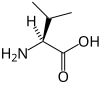
La chaîne latérale est ici représentée par le symbole R en magenta, tandis que le carbone α est orangé.

En biochimie, les acides α-aminés jouent un rôle crucial dans la structure, le métabolisme et la physiologie des cellules de tous les êtres vivants connus, en tant que constituants des peptides et des protéines. Ils constituent à ce titre l'essentiel de la masse du corps humain après l'eau. Ils présentent, à de rares exceptions près[3], une structure générique du type H2N–HCR–COOH, où R est la chaîne latérale identifiant l'acide α-aminé. Toutes les protéines de tous les êtres vivants connus ne sont constituées — à quelques exceptions près — que de vingt-deux acides aminés différents, parfois légèrement modifiés, dits acides aminés protéinogènes. Parmi ceux-ci, dix-neuf acides aminés ne contiennent que quatre éléments chimiques : le carbone, l'hydrogène, l'oxygène et l'azote ; deux acides aminés contiennent en plus un atome de soufre, et un acide aminé assez rare contient un atome de sélénium. Ces acides aminés forment de longs biopolymères linéaires, appelés polypeptides, dans lesquels les monomères sont unis entre eux par des liaisons peptidiques. Un acide aminé engagé dans une ou deux liaisons peptidiques au sein d'un polypeptide est un résidu d'acide aminé. L'ordre dans lequel ces résidus se succèdent dans les polypeptides est la séquence peptidique et est déterminé par les gènes à travers le code génétique, qui établit une relation entre les codons de trois bases nucléiques et chacun de ces résidus.
Les acides aminés sont quasiment tous des molécules chirales, dont les représentants naturels sont essentiellement les énantiomères L ; il existe également des acides aminés D dans les parois bactériennes et certains antibiotiques, comme la gramicidine, qui est un peptide non ribosomique. Outre leur rôle dans les protéines, les acides aminés protéinogènes peuvent également être précurseurs de biosynthèses importantes. C'est par exemple le cas de la glycine, précurseur de la porphyrine, laquelle donne l'hème des globules rouges, ainsi que de l'acide inosinique, qui donne les bases puriques des acides nucléiques. En outre, plusieurs acides aminés, protéinogènes ou non, jouent également un rôle central dans la physiologie de l'organisme, indépendamment de leur contribution aux protéines. Ainsi, la carnitine, un acide aminé non protéinogène, intervient dans le transport des lipides. Le glutamate (protéinogène) et l'acide γ-aminobutyrique (GABA, non protéinogène) sont, dans le cerveau, respectivement le principal neurotransmetteur excitateur et le principal inhibiteur du système nerveux central[4]. Il existe par ailleurs de très nombreux autres acides α-aminés biologiques non protéinogènes, dont certains dérivent des acides aminés protéinogènes par modification post-traductionnelle sur les protéines — par exemple la citrulline, qui dérive de l'arginine, et l'acide pyroglutamique, par lactamisation de l'acide glutamique — ou n'entrent pas dans la constitution des protéines — par exemple la DOPA et l'ornithine. Certains acides α-aminés naturels peuvent également être toxiques, comme l'acide domoïque, qui est une phycotoxine.
Neuf des vingt-deux acides aminés protéinogènes sont dits essentiels pour l'humain car ils ne peuvent pas être produits par le métabolisme humain et doivent par conséquent être apportés directement par l'alimentation. D'autres acides aminés peuvent également être essentiels selon l'âge ou l'état de santé. La liste des acides aminés essentiels diffère selon les espèces : les ruminants, par exemple, obtiennent plusieurs acides aminés, qu'ils ne synthétisent pas eux-mêmes, à partir des produits de digestion par les microorganismes dans leur réticulorumen. En raison de leur importance biologique, les acides aminés sont des éléments importants en nutrition et sont couramment utilisés dans les compléments alimentaires. Diverses technologies font également appel aux acides aminés, par exemple comme engrais, en technologie alimentaire dans l'industrie agroalimentaire, en pharmacie, en chimie fine et en synthèse organique (synthèse asymétrique par exemple).
Propriétés générales
modifierStéréoisomérie
modifier

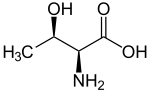
Les acides aminés naturels les plus abondants sont les acides α-aminés, dont font partie tous les acides aminés protéinogènes. Hormis la glycine, dont la chaîne latérale se réduit à un simple atome d'hydrogène et dont le carbone α n'est donc pas un centre stéréogène, tous ces acides aminés sont des composés chiraux présentant une stéréoisomérie D/L. Les acides aminés protéinogènes incorporés dans les protéines par les ribosomes sont tous des énantiomères L, mais des acides aminés D peuvent être présents dans des protéines à la suite de modifications post-traductionnelles, notamment dans le réticulum endoplasmique, comme c'est le cas chez certains organismes marins tels que les gastéropodes du genre Conus[5]. Des acides aminés D sont également des constituants importants du peptidoglycane de la paroi bactérienne[6], et la D-sérine jouerait le rôle de neurotransmetteur dans le cerveau[7].
La désignation D/L provient de la position respectivement à droite ou à gauche du groupe –NH2 dans la projection de Fischer, le carboxyle se trouvant en haut dans cette représentation, avec comme ordre de priorité des groupes (selon les règles de Cahn, Ingold et Prelog) :
- L'atome d'azote de l'amine primaire –NH2 ;
- L'atome de carbone du carboxyle –COOH ;
- L'atome de carbone α de la chaîne latérale R s'il ne porte pas d'atome de numéro atomique supérieur à celui de l'oxygène, sinon il passe en deuxième position (c'est le cas pour la cystéine et la sélénocystéine) ;
- L'atome d'hydrogène.
Les acides aminés L naturels ont le plus souvent une configuration absolue S tandis que les acides aminés D ont une configuration R ; la L-cystéine et la L-sélénocystéine, acides α-aminés protéinogènes, présentent cependant une configuration absolue R en raison respectivement de l'atome de soufre et de sélénium liés au carbone β de leur chaîne latérale : les groupes –CH2SH et –CH2SeH prennent la deuxième place devant le groupe –COOH, ce qui inverse la configuration absolue par rapport aux autres acides aminés L.
Ces énantiomères sont optiquement actifs : chaque isomère dévie la lumière plane polarisée et est dextrogyre (+) ou lévogyre (-) suivant que la rotation du plan de polarisation de la lumière suit un sens horaire ou antihoraire. Il n'y a pas de corrélation entre le sens de rotation du plan de polarisation (ou pouvoir rotatoire) et la configuration de l'acide aminé : ainsi, la L-alanine est lévogyre et se note L(-)-alanine. Par convention, il y a correspondance entre la représentation des oses et celle des acides aminés.
Certains de ces acides aminés, comme la thréonine et l'isoleucine, possèdent un 2e carbone asymétrique. Dans ce cas, le composé naturel (2S, 3R) est appelé L, son énantiomère (2R, 3S) est appelé D, les deux autres stéréoisomères (2S, 3S et 2R, 3R) dont les positions relatives des substituants sont différentes sont appelés allo.
Chaîne latérale
modifier
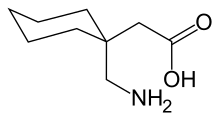
Les atomes de carbone des acides aminés qui ont une chaîne latérale liée au carbone α, par exemple la lysine représentée ci-contre, sont désignés successivement par les lettres grecques β, γ, δ, etc. On parle ainsi d'acide α-aminé, β-aminé, γ-aminé, δ-aminé selon l'atome de carbone sur lequel se trouve le groupe amine.
On a l'habitude de classer les acides aminés en quatre groupes en fonction des propriétés de leur chaîne latérale :
- acide ;
- basique ;
- polaire (hydrophile) ;
- apolaire (hydrophobe).
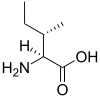
On parle d'acides aminés ramifiés en référence aux acides aminés dont la chaîne latérale est aliphatique et n'est pas linéaire. Il s'agit de la leucine, de l'isoleucine et de la valine.
La proline est le seul acide aminé protéinogène ayant une amine secondaire. Elle a longtemps été qualifiée d'acide iminé pour cette raison, bien que cette qualification soit désormais obsolète dans la mesure où, en chimie, la fonction imine est distincte d'une amine secondaire.
Forme zwitterionique
modifier

Le groupe carboxyle –COOH est un acide faible, ce qui signifie qu'il tend à libérer un proton pour donner un carboxylate –COO− chargé négativement. La forme carboxylate est prédominante à pH supérieur au pKa de l'acide carboxylique, c'est-à-dire environ 2,2 pour les acides aminés protéinogènes. De façon symétrique, le groupe amine –NH2 est une base faible, ce qui signifie qu'il tend à recevoir un proton pour donner un ammonium –NH3+. La forme ammonium prédomine à pH inférieur au pKa de l'amine, c'est-à-dire environ 9,4 pour les acides aminés protéinogènes.
Dans la mesure où, par définition, les acides aminés ont à la fois un groupe carboxyle et un groupe amine, ce sont des molécules amphotères :
- à pH < 2,2 : les acides α-aminés présentent un groupe carboxyle –COOH neutre et un groupe ammonium –NH3+ chargé positivement, l'ensemble ayant une charge électrique globale +1 ;
- à 2,2 < pH < 9,4 : les acides α-aminés présentent un groupe carboxylate –COO− chargé négativement et un groupe ammonium –NH3+ chargé positivement, l'ensemble étant globalement neutre ;
- à pH > 9,4 : les acides α-aminés présentent un groupe carboxylate –COO− chargé négativement et un groupe amine –NH2 neutre, l'ensemble ayant une charge électrique globale –1.
La présence de deux groupes fonctionnels portant des charges électriques opposées +1 et –1 sur des atomes non adjacents définit un zwitterion. La forme non ionisée des acides aminés est une espèce chimique extrêmement minoritaire en solution aqueuse — moins de 0,1 ppm — puisque généralement au moins l'un des deux groupes est ionisé. Les acides aminés sont également présents sous forme de zwitterions en phase solide et ils cristallisent en présentant des propriétés semblables aux cristaux de sel, contrairement à la plupart des acides et amines organiques.
Point isoélectrique
modifier
Les différents types de courbes de titrage correspondant aux groupes d'acides aminés sont représentés ci-contre. La forme zwitterionique prédomine aux pH compris entre les deux pKa mais coexiste cependant avec de petites quantités de formes porteuses d'une charge électrique nette positive et de formes portant une charge nette négative. Au milieu exact entre les deux valeurs de pKa, les quantités de formes chargées positivement et de formes chargées négativement se compensent exactement, de sorte que la charge électrique résultant de toutes les espèces en solution est exactement nulle. C'est le point isoélectrique, défini par pI = ½ (pKa1 + pKa2), auquel les acides aminés ont une mobilité nulle par électrophorèse.
La solubilité des zwitterions est la plus faible à leur point isoélectrique et certains acides aminés, notamment ceux qui ont une chaîne latérale non polaire, peuvent être isolés d'une solution aqueuse par précipitation en ajustant le pH de la solution à la valeur de leur point isoélectrique.
Chaque acide aminé ayant des valeurs de pKa légèrement différentes les unes des autres, leurs points isoélectriques diffèrent également légèrement les uns des autres. Les acides aminés qui ont une chaîne latérale électriquement chargée font en plus intervenir le pKa de cette chaîne, noté pKR. Ainsi, l'aspartate, le glutamate mais aussi la cystéine ont une chaîne latérale chargée négativement — celle de la cystéine reste cependant faiblement chargée à pH neutre — de sorte que leur point isoélectrique vaut pI = ½ (pKa1 + pKR). Symétriquement, l'histidine, la lysine et l'arginine ont une chaîne latérale chargée positivement, de sorte que leur point isoélectrique s'exprime par pI = ½ (pKR + pKa2).
Solubilité
modifier
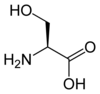
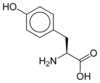
La plupart des acides aminés subissent facilement la solvatation par les solvants polaires tels que l'eau ou l'alcool éthylique (particulièrement la proline et l'hydroxyproline) dans lesquels ils sont solubles. D'autre part, les acides α-aminés sont solubles, mais à un degré moindre, dans les solvants apolaires. Cette solubilité est largement dépendante des propriétés de la chaîne latérale : la solubilité diminue avec le nombre d'atomes de carbone du radical, mais augmente si ce radical est porteur de fonctions polaires (NH2, COOH) ou hydrophiles (OH). La tyrosine, en raison de son noyau aromatique, est ainsi peu soluble dans l'eau, à raison de 0,38 g L−1 à 20 °C, tandis que la valine, aliphatique mais plus petite, l'est davantage, à raison de 24 g L−1 ; l'arginine, très basique et donc très polaire, est soluble à raison de 150 g L−1, tandis que la cystéine, avec une chaîne latérale courte terminée par une fonction thiol, est très soluble, à raison de 280 g L−1, et la sérine, analogue de la cystéine avec un hydroxyle à la place du sulfhydryle, est particulièrement soluble, à raison de 360 g L−1.
Absorption de la lumière
modifierLes solutions d'acides aminés sont incolores. Les acides aminés aromatiques absorbent les rayonnements ultraviolets entre 260 et 280 nm. Au-dessus de 260 nm, la plus grande partie de l'absorption ultraviolette des protéines provient de leur teneur en tryptophane et parfois en tyrosine et en phénylalanine. Ces acides aminés ont une telle absorption à cause de leur nature aromatique due à la présence d'un cycle benzénique.
Occurrence naturelle et rôle biochimique
modifierAcides aminés protéinogènes
modifierLes acides aminés protéinogènes sont les unités de base de construction des protéines. Ils polymérisent en formant des polypeptides linéaires dans lesquels les résidus d'acides aminés sont unis par des liaisons peptidiques. La biosynthèse des protéines se déroule sur les ribosomes[8], qui réalisent la traduction de l'ARN messager en protéines. L'ordre dans lequel les acides aminés sont liés à la chaîne polypeptidique est spécifié par la succession des codons portés par la séquence de l'ARN messager, lequel est une copie de l'ADN du noyau cellulaire ; ces codons, qui sont des triplets de nucléotides, sont traduits en acides aminés par des ARN de transfert selon le code génétique. Celui-ci spécifie directement 20 acides aminés, auxquels s'ajoutent deux autres acides aminés à travers un mécanisme plus complexe faisant intervenir, pour la sélénocystéine, un élément SECIS qui recode le codon-stop UGA[9] et, pour la pyrrolysine, un élément PYLIS[10] qui recode le codon-stop UAG[11]. La planche ci-dessous présente la structure chimique des 22 acides aminés protéinogènes :
| Structure des 22 acides aminés protéinogènes. La pyrrolysine et la sélénocystéine (ci-dessus grisées) sont spécifiques à certaines protéines : - la pyrrolysine ne se rencontre que chez certaines archées méthanogènes, - la sélénocystéine est présente également chez les eucaryotes mais a priori dans quelques dizaines d'enzymes de la famille des oxydoréductases. Les 20 autres acides aminés, dits standards, sont en revanche universellement distribués chez tous les êtres vivants connus. |
La page Acide aminé protéinogène donne davantage d'informations sur ces composés.
Acides aminés non protéinogènes
modifier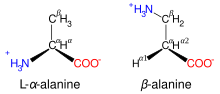
Outre les 22 acides aminés protéinogènes, il existe un grand nombre d'acides aminés dits non protéinogènes. Certains ne se rencontrent pas dans les protéines, comme la carnitine ou l'acide γ-aminobutyrique, d'autres peuvent être présents dans les protéines à la suite de modifications post-traductionnelles, comme le γ-carboxyglutamate et l'hydroxyproline, ou par substitution à la place d'un acide aminé analogue, comme la sélénométhionine. Les modifications post-traductionnelles sont souvent essentielles pour assurer la fonctionnalité ou la régulation de la protéine. Ainsi, la carboxylation du glutamate permet d'accroître la fixation des cations de calcium[12], et l'hydroxylation de la proline est essentielle à la cohésion des tissus conjonctifs[13]. Un autre exemple est la formation d'hypusine dans le facteur d'initiation eucaryote (en) EIF5A (en) à la suite de la modification d'un résidu de lysine[14]. De telles modifications déterminent également la localisation des protéines dans la cellule, dans la mesure où l'addition de groupes hydrophobes est susceptible de permettre à la protéine de se lier à une membrane phospholipidique[15].
La plupart des acides aminés non protéinogènes ne sont jamais naturellement présents dans les protéines. Ce sont par exemple la lanthionine, le 2-aminoisobutyrate, la déshydroalanine ou encore l'acide γ-aminobutyrique. Ce sont souvent des intermédiaires sur la voie métabolique de biosynthèse des acides aminés, comme l'ornithine et la citrulline, qui font partie du cycle de l'urée comme intermédiaires de dégradation des acides aminés[16]. Si les acides α-aminés sont de très loin les principaux acides aminés biologiques en tant que constituants des protéines, la β-alanine offre un exemple d'acide β-aminé biologiquement important, étant utilisée par les plantes et certains microorganismes pour la synthèse de l'acide pantothénique (vitamine B5), un constituant de la coenzyme A[17], laquelle est un groupe prosthétique très important dans le métabolisme.
Acides aminés non standard
modifier
Les vingt acides aminés protéinogènes encodés directement par le code génétique sont dits standard ; tous les autres acides aminés sont dits non standard. Deux acides aminés non standard, la pyrrolysine et la sélénocystéine, sont cependant des acides aminés protéinogènes : ils sont en effet encodés de façon indirecte par l'intermédiaire de séquences d'insertion qui recodent des codons-stop en codons de pyrrolysine ou de sélénocystéine. Ainsi, un élément PYLIS en aval d'un codon UAG recode ce dernier en pyrrolysine, tandis qu'un élément SECIS avec un codon UGA recode ce dernier en sélénocystéine. En 2003, vingt-cinq sélénoprotéines humaines étaient dénombrées[18], c'est-à-dire de protéines contenant au moins un résidu de sélénocystéine.
Les autres acides aminés non standard sont non protéinogènes.
Acides aminés aromatiques
modifier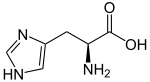

Les acides aminés qui possèdent un cycle aromatique présentent un certain nombre de propriétés particulières. On compte quatre acides aminés protéinogènes aromatiques : l'histidine, la phénylalanine, le tryptophane et la tyrosine.
- L'histidine présente un cycle imidazole à l'extrémité de sa chaîne latérale et diffère sensiblement des trois autres : elle dérive métaboliquement d'un cycle pyrimidine de l'ATP et d'une molécule de ribose, et elle présente une faible fluorescence à 280 nm.
- Les trois autres acides aminés ont en commun de posséder un cycle benzénique. Ils dérivent métaboliquement du chorismate et sont nitrés par la réaction xanthoprotéique, utilisée précisément pour révéler les groupes benzéniques. Ils sont bien plus fluorescents que l'histidine, absorbant les rayonnements ultraviolets jusqu'à 257 nm, 275 nm et 280 nm pour la phénylalanine, la tyrosine et le tryptophane respectivement. Le tryptophane réémet entre 308 et 350 nm selon la polarité de son environnement (fluorescence solvatochrome). Cette fluorescence, qui recouvre celle des autres acides aminés, peut néanmoins être facilement désactivée par la proximité de groupes protonés, par exemple des résidus d'aspartate ou de glutamate voisins dans une protéine.
Il existe par ailleurs un grand nombre d'acides aminés non protéinogènes aromatiques, par exemple la thyroxine, la DOPA ou encore le 5-HTP.
Acides aminés ramifiés
modifier
Il existe trois acides aminés protéinogènes ramifiés : l'isoleucine, la leucine et la valine. Ce sont tous les trois des acides aminés essentiels pour l'humain. Ils représentent 35 % des acides aminés essentiels des protéines musculaires et 40 % des acides aminés essentiels pour les mammifères[19].
Il existe par ailleurs de nombreux acides aminés non protéinogènes ramifiés, par exemple la norvaline et l'acide 2-aminoisobutyrique.
Dans l'alimentation humaine
modifierAcides aminés essentiels chez l'humain :
- histidine ;
- isoleucine ;
- leucine ;
- lysine ;
- méthionine ;
- phénylalanine ;
- thréonine ;
- tryptophane ;
- valine.
La digestion des protéines au niveau intestinal a pour effet de cliver, en les hydrolysant, les liaisons peptidiques qui unissent les résidus d'acides aminés dans les chaînes polypeptidiques. Cela se produit dans l'estomac et le duodénum sous l'effet d'enzymes digestives, notamment des peptidases, dont la pepsine du suc gastrique et la trypsine et la chymotrypsine du pancréas sont les principales. Les acides aminés libérés par la digestion des protéines peuvent traverser la paroi intestinale et atteindre la circulation sanguine. D'autres protéines sont dégradées à l'intérieur même des cellules, libérant également les acides aminés qui les constituent.
Les acides aminés eux-mêmes sont dégradés au sein des cellules pour produire de l'énergie métabolique et divers métabolites susceptibles d'être utilisés à leur tour dans le foie pour biosynthétiser d'autres biomolécules, telles que des glucides pour les acides aminés glucoformateurs et des lipides pour les acides aminés lipoformateurs ; les acides aminés cétoformateurs, quant à eux, tendent à produire des corps cétoniques par cétogenèse[20]. La production de glucose à partir de métabolites cellulaires est la néoglucogenèse[21], celle d'acides gras est la lipogenèse. L'élimination du groupe amine –NH2 par une transaminase libère de l'ammoniac NH3, qui est détoxiqué en urée par le foie, tandis que la cétone résultante est oxydée à travers le cycle de Krebs[22] puis à travers la chaîne respiratoire jusqu'à formation de dioxyde de carbone CO2.
Les acides aminés qui ne peuvent être synthétisés par l'organisme et doivent être apportés par l'alimentation sont dits « essentiels ». Chez l'humain, ils sont au nombre de neuf (voir encadré). Les douze autres sont produits in vivo par le métabolisme des cellules, l'un d'entre eux, contenant un atome de sélénium, étant finalisé alors qu'il est déjà sur son ARN de transfert. Certains régimes alimentaires ne permettent pas de synthétiser en quantité suffisante tous les acides aminés non essentiels, et certains d'entre eux doivent alors également être apportés par l'alimentation[23] : l'arginine[24], la cystéine, le glutamate et la tyrosine.
Métabolisme et fonctions non protéinogènes
modifier

Outre leur rôle de constituants des protéines, les acides aminés protéinogènes peuvent être des métabolites précurseurs de composés biochimiques variés. Par exemple :
- le glutamate est un précurseur du γ-aminobutyrate, un neurotransmetteur[4],[25] ;
- le tryptophane est un précurseur de la sérotonine[26], un autre neurotransmetteur ;
- la phénylalanine est un précurseur de divers phénylpropanoïdes, qui jouent un rôle biochimique important chez les plantes ; elle est également un précurseur direct de la tyrosine, elle-même précurseur des catécholamines telles que la dopamine, l'adrénaline et la noradrénaline ;
- la glycine est un précurseur de l'hème, et plus généralement des porphyrines[27] ;
- l'arginine est un précurseur du monoxyde d'azote[28], un neurotransmetteur ;
- la méthionine donne la S-adénosylméthionine qui, avec l'ornithine (non protéinogène), est un précurseur de polyamines[29] ;
- l'aspartate, la glycine et la glutamine sont des précurseurs des nucléotides.
Certains acides aminés non standard peuvent être utilisés par les plantes contre les herbivores[30]. Ainsi la canavanine est un analogue structurel de l'arginine présent chez de nombreux légumes[31], et notamment chez Canavalia gladiata ou haricot sabre[32]. Cet acide aminé protège la plante de prédateurs tels que les insectes et peut rendre malade le consommateur humain s'il absorbe des légumes qui en contiennent sans les cuire[33]. La mimosine est un autre acide aminé présent chez d'autres légumes, notamment Leucaena leucocephala[34]. Cette molécule est analogue à la tyrosine et peut empoisonner les animaux qui broutent ses plantes.
La fonction de tous les acides aminés non protéinogènes, qui peuvent être abondants dans les tissus biologiques, est encore loin d'être comprise pour chacun d'eux.
Propriétés chimiques
modifierDans la mesure où les acides aminés sont des composés organiques qui possèdent à la fois une fonction acide carboxylique et une fonction amine, ils peuvent subir la plupart des réactions associées à ces groupes fonctionnels, comme l'addition nucléophile, la formation de liaisons amide et la formation d'imines pour le groupe amine, l'estérification et la décarboxylation pour le groupe carboxyle. La combinaison de ces groupes fonctionnels permet aux acides aminés d'être des ligands polydentates efficaces pour des chélates métal-acide aminé[35]. Par ailleurs, les différentes chaînes latérales des acides aminés peuvent elles aussi donner lieu à des réactions chimiques[36]. La nature de ces réactions dépend de la nature des groupes fonctionnels portés par ces chaînes latérales et varient donc significativement d'un acide aminé à l'autre.
Propriétés du groupe carboxyle
modifierAmidation
modifierLe carboxyle peut former des amides avec les amines : Ra–COOH + RbNH2 → Ra–CO–NHRb + H2O
Asparagine et glutamine sont deux exemples de dérivés physiologiques formés suivant cette réaction. L'amidation peut être obtenue in vitro en utilisant des carbodiimides (Ra–N=C=N–Rb). Le groupe carboxyle est dans une première étape activé par la carbodiimide, puis le dérivé activé ainsi formé réagit avec l'amine.
Décarboxylation
modifierIl existe plusieurs sortes de décarboxylation. Chimique ou enzymatique par une décarboxylase. Décarboxylation sous forme de CO2. Les décarboxylases sont spécifiques de chaque acide aminé. La décarboxylation est importante en biochimie car elle aboutit aux « amines biologiques » correspondantes très actives :
- Histidine décarboxylée en histamine (impliquée dans les allergies) ;
- 5-OH tryptophane décarboxylée en sérotonine (un des régulateurs de la tension artérielle).
Propriétés du groupement amino
modifierCe sont des propriétés générales d'amines primaires. Deux types de groupes aminos peuvent être distingués: les amines en alpha et l'amine en epsilon de la chaîne latérale de la lysine dont le pK est légèrement plus basique (>8). La différence des valeurs de pK peut être utilisée pour des modifications sélectives, en contrôlant le pH du milieu réactionnel.
Acétylation
modifierL'acétylation des groupements aminos des acides aminés par l'anhydride acétique réduit leurs charges positives et change leurs interactions avec les composants de l'environnement.
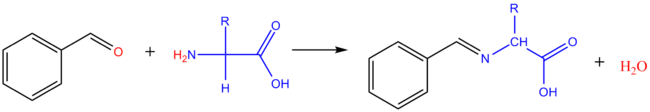
Réaction avec les aldéhydes
modifierAvec le méthanal : il se forme le dérivé hydroxyméthylé de l'acide aminé. Avec les aldéhydes aromatiques, on obtient des bases de Schiff (imine).
Une réaction du même type peut se produire in vivo entre acides aminés et oligosaccharides (réaction de glycation des protéines avec les résidus d'acides aminés ayant une fonction amine libre). Dans les enchainements saccharidiques, le sucre réducteur terminal existe de façon prédominante sous forme cyclique, avec seulement des traces sous forme ouverte. Une base de Schiff (imine) peut se former avec cette forme minoritaire, consommant ainsi la forme cyclique.
In vitro, cette réaction avec les saccharides est généralement réalisée en présence de cyanoborohydrure de sodium (NaCNBH3). La base de Schiff (imine) formée est ainsi rapidement réduite par les anions cyanoborohydrure en amine secondaire plus stable.
Arylation
modifierLa substitution d'un atome d'hydrogène de la fonction amine primaire –NH2 par un groupe aryle (aromatique) conduit à une fonction amine secondaire –NH–. Par exemple, avec le dinitrofluorobenzène (réactif de Sanger, ou DNFB) il se forme un dinitrophényl-acide aminé coloré, donc dosable. Il s'agit d'une substitution nucléophile aromatique d'ordre 2, le groupe partant étant l'ion fluorure F−.
Cette réaction peut également se produire avec un acide aminé incorporé dans une protéine. Les dinitrophényl-acides aminés formés correspondent aux acides aminés dont les groupes NH2 sont libres dans la protéine (extrémité N-terminale de la chaîne polypeptidique).
Cette réaction a permis en 1953 à Frederick Sanger d'établir la première structure primaire d'une hormone peptidique, l'insuline, ce pour quoi il a obtenu le prix Nobel de chimie en 1958.
Formation d'urées ou de thiourées
modifier
Elle a lieu avec les isocyanates, en particulier le phénylisothiocyanate (PITC).
Le PITC est particulièrement utilisé pour déterminer l'enchaînement des acides aminés dans les chaînes peptidiques. Le phénylthiocarbamyl-aminoacide (PTC-AA) (thiourée) résultant est un composé caractéristique de chaque acide aminé (nature du groupement R). Il est très stable et détectable dans l'ultraviolet (245 nm).
Exemple : C6H5–N=C=S + H2N-CH2–COOH → C6H5–NH–CS–NH–CH2–COOH.
Ces réactions permettent de transformer l'amine de l'acide aminé en amide, protégeant l'amine ou y fixant un groupement acyle ayant des propriétés intéressantes (fluorescence...), avec élimination du groupement réactif: Il s'agit d'une transamidification
Ces réactions sont utilisées pour la synthèse de dérivés d'acides aminés ou de protéines "marquées" sur leurs fonctions amines libres (dérivés fluorescents, biotinylation par la biotine-N-hydroxysuccinimide...); pour la synthèse de supports chromatographiques par greffage d'acides aminés ou de protéines...
Propriétés dues à la présence simultanée du -COOH et du -NH2
modifierCes chélates stables sont utilisés pour effectuer des réactions chimiques au niveau de R, en synthèse.
Décarboxylation et désamination oxydatives. Réaction avec la ninhydrine
modifierCertains oxydants attaquent l'acide aminé et réalisent une désamination associée à une décarboxylation. Au cours de la réaction il y a production de CO2, de NH3 et d'un aldéhyde ayant un atome de carbone de moins que l'acide aminé dont il provient : R–CH(NH2)–COOH → R–CHO + NH3 + CO2.
Les oxydants sont variés : eau oxygénée, hypochlorite etc. Pour rendre cette réaction quantitative, on peut doser CO2 par alcalimétrie ou NH3 par colorimétrie. L'oxydant le plus utilisé est la ninhydrine (voir la page correspondante).
Lorsqu'un acide aminé en solution est chauffé en présence de ninhydrine en excès, il conduit à un chromophore avec un maximum d'absorption à 570 nm (bleu-violet). L'intensité de la coloration est à la base d'une méthode quantitative pour doser les acides aminés. La réaction s'effectue en trois étapes. La première correspond à l'action d'une première molécule de ninhydrine sur l'acide aminé conduisant à un iminoacide et à une molécule de ninhydrine réduite. La deuxième correspond à l'action d'une deuxième molécule de ninhydrine sur l'iminoacide pour donner un aldéhyde. Cette deuxième molécule se condense finalement avec la molécule de ninhydrine réduite pour former le chromophore.
La coloration n'est pas spécifique des acides aminés. Elle se produit avec d'autres composés ayant des groupements aminos libres : glucosamine, peptides et protéines. Cette méthode colorimétrique est une bonne technique pour le dosage d'un acide aminé pur, mais elle est moins valable pour un dosage global car les acides aminés réagissent en donnant des colorations d'intensité variable. Les iminoacides donnent avec la ninhydrine, une coloration jaune.
Histoire
modifierLes premiers acides aminés protéinogènes ont été découverts au début du XIXe siècle. Au cours des années comprises entre 1805 et 1935, de nombreux chimistes de renom participent à l'isolement et à l'élucidation de la structure des acides aminés. Les chimistes français Louis-Nicolas Vauquelin et Pierre Jean Robiquet isolent l'asparagine en 1806 à partir d'asperges[37], ou Asparagus sativus, synonyme d'Asparagus officinalis, d'où son nom. Le chimiste britannique William Hyde Wollaston découvre la cystine en 1810 dans un calcul rénal[38], mais il faut attendre 1884 pour que le chimiste allemand Eugen Baumann isole la cystéine, qui en est le monomère. En 1819, les chimistes français Henri Braconnot et Joseph Louis Proust isolèrent respectivement la glycine[39] et la leucine. Justus von Liebig isole la tyrosine en 1846, tandis que la structure de cet acide aminé est élucidée en 1869 par son élève Ludwig Barth zu Barthenau. Le chimiste germano-autrichien Eugen Freiherr von Gorup-Besanez (en) isole la valine en 1856. Le biochimiste allemand Karl Heinrich Ritthausen (en) isole l'acide glutamique à partir du gluten en 1866. La structure de la glutamine et de l'acide glutamique est déterminée en 1872 par William Dittmar. Le chimiste allemand Ernst Schulze (en) isole la glutamine en 1877, la phénylalanine en 1881 et l'arginine en 1886, et participe à la découverte de quelques autres acides aminés. La lysine est découverte en 1889 par le chimiste allemand Edmund Drechsel (de). Le médecin allemand Albrecht Kossel établit la structure de l'histidine en 1896, le chimiste allemand Richard Willstätter celle de la proline en 1900, et le chimiste britannique Frederick Gowland Hopkins celle du tryptophane en 1901 ; ils obtiennent tous trois un prix Nobel par la suite. Le chimiste allemand Emil Fischer établit la structure de la sérine en 1901, de la lysine en 1902, de la valine en 1906 et de la cystéine en 1908. La méthionine est découverte en 1922 par John Howard Mueller et sa structure décrite en 1928 par les chimistes britanniques George Barger et Philip Coine. Le dernier acide aminé standard à avoir été découvert est la thréonine en 1935 par William Cumming Rose (en)[40], qui identifie également les acides aminés essentiels pour l'humain ainsi que l'apport journalier minimum de chaque acide aminé pour assurer un développement optimal[41].
Notes et références
modifier- (en) Alexandre Ambrogelly, Sotiria Palioura et Dieter Söll, « Natural expansion of the genetic code », Nature Chemical Biology, vol. 3, no 1, , p. 29-35 (PMID 17173027, DOI 10.1038/nchembio847, lire en ligne).
- (en) Ingrid Wagner et Hans Musso, « New Naturally Occurring Amino Acids », Angewandte Chemie International Edition in English, vol. 22, no 11, , p. 816-828 (DOI 10.1002/anie.198308161, lire en ligne).
- La proline est un acide α-aminé dont l'amine est secondaire et dont la structure générale est par conséquent différente :

- (en) Ognen A. C. Petroff, « Book Review: GABA and Glutamate in the Human Brain », The Neuroscientist, vol. 8, no 6, , p. 562-573 (PMID 12467378, DOI 10.1177/1073858402238515, lire en ligne).
- (en) Katarzyna Pisarewicz, David Mora, Fred C. Pflueger, Gregg B. Fields et Frank Marí, « Polypeptide Chains Containing d-γ-Hydroxyvaline », Journal of the American Chemical Society, vol. 127, no 17, , p. 6207-6215 (PMID 15853325, DOI 10.1021/ja050088m, lire en ligne).
- (en) Jean van Heijenoort, « Formation of the glycan chains in the synthesis of bacterial peptidoglycan », Glycobiology, vol. 11, no 3, , p. 25R-36R (PMID 11320055, DOI 10.1093/glycob/11.3.25R, lire en ligne).
- (en) Herman Wolosker, Elena Dumin, Livia Balan et Veronika N. Foltyn, « D-Amino acids in the brain: D-serine in neurotransmission and neurodegeneration », FEBS Journal, vol. 275, no 14, , p. 3514-3526 (PMID 18564180, DOI 10.1111/j.1742-4658.2008.06515.x, lire en ligne).
- (en) M. V. Rodnina, M. Beringer et W. Wintermeyer, « How ribosomes make peptide bonds », Trends in Biochemical Sciences, vol. 32, no 1, , p. 20-26 (ISSN 0968-0004, PMID 17157507, DOI 10.1016/j.tibs.2006.11.007).
- (en) Donna M. Driscoll et Paul R. Copeland, « Mechanism and regulation of selenoprotein synthesis », Annual Review of Nutrition, vol. 23, , p. 17-40 (PMID 12524431, DOI 10.1146/annurev.nutr.23.011702.073318, lire en ligne).
- (en) Anne Théobald-Dietrich, Richard Giegé et Joëlle Rudinger-Thirion, « Evidence for the existence in mRNAs of a hairpin element responsible for ribosome dependent pyrrolysine insertion into proteins », Biochimie, vol. 87, nos 9-10, , p. 813-817 (PMID 16164991, DOI 10.1016/j.biochi.2005.03.006, lire en ligne).
- (en) Joseph A. Krzycki, « The direct genetic encoding of pyrrolysine », Current Opinion in Microbiology, vol. 8, no 6, , p. 706-712 (PMID 16256420, DOI 10.1016/j.mib.2005.10.009, lire en ligne).
- (en) C. Vemeer, « Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase », Biochemical Journal, vol. 266, no 3, , p. 625-636 (PMID 2183788, PMCID 1131186).
- (en) Arnab Bhattacharjee et Manju Bansal, « Collagen Structure: The Madras Triple Helix and the Current Scenario », IUBMB Life, vol. 57, no 3, , p. 161-172 (PMID 16036578, DOI 10.1080/15216540500090710, lire en ligne).
- (en) Myung Hee Park, « The Post-Translational Synthesis of a Polyamine-Derived Amino Acid, Hypusine, in the Eukaryotic Translation Initiation Factor 5A (eIF5A) », Journal of Biochemistry, vol. 139, no 2, , p. 161-169 (PMID 16452303, PMCID 2494880, DOI 10.1093/jb/mvj034, lire en ligne).
- (en) John Blenis et Marilyn D. Resh, « Subcellular localization specified by protein acylation and phosphorylation », Current Opinion in Cell Biology, vol. 5, no 6, , p. 984-989 (PMID 8129952, DOI 10.1016/0955-0674(93)90081-Z, lire en ligne).
- (en) E. Curis, I. Nicolis, C. Moinard, S. Osowska, N. Zerrouk, S. Bénazeth et L. Cynober, « Almost all about citrulline in mammals », Amino Acids, vol. 29, no 3, , p. 177-205 (PMID 16082501, DOI 10.1007/s00726-005-0235-4, lire en ligne).
- (en) K. M. Coxon, E. Chakauya, H. H. Ottenhof, H. M. Whitney, T. L. Blundell, C. Abell et A. G. Smith, « Pantothenate biosynthesis in higher plants », Biochemical Society Transactions, vol. 33, no Pt 4, , p. 743-746 (PMID 16042590).
- (en) Gregory V. Kryukov, Sergi Castellano, Sergey V. Novoselov, Alexey V. Lobanov, Omid Zehtab, Roderic Guigó et Vadim N. Gladyshev, « Characterization of Mammalian Selenoproteomes », Science, vol. 300, no 5624, , p. 1439-1443 (PMID 12775843, lire en ligne).
- (en) Yoshiharu Shimomura, Taro Murakami, Naoya Nakai, Masaru Nagasaki et Robert A. Harris, « Exercise Promotes BCAA Catabolism: Effects of BCAA Supplementation on Skeletal Muscle during Exercise », Journal of Nutrition, vol. 134, no 6 Suppl, , p. 1583S-1587S (PMID 15173434, lire en ligne).
- (en) W. Sakami et H. Harrington, « Amino Acid Metabolism », Annual Review of Biochemistry, vol. 32, , p. 355-398 (PMID 14144484, DOI 10.1146/annurev.bi.32.070163.002035, lire en ligne).
- (en) Vernon R. Young et Alfred M. Ajami, « Glutamine: The Emperor or His Clothes », Journal of Nutrition, vol. 131, no 9 Suppl., , p. 2449S-2459S (PMID 11533293, lire en ligne).
- (en) John T. Brosnan, « Glutamate, at the Interface between Amino Acid and Carbohydrate Metabolism », Journal of Nutrition, vol. 130, no 4S Supplement, , p. 988S-990S (PMID 10736367, lire en ligne).
- (en) P. Fürst et P. Stehle, « What Are the Essential Elements Needed for the Determination of Amino Acid Requirements in Humans? », Journal of Nutrition, vol. 134, no 6, , p. 1558S-1565S (ISSN 0022-3166, PMID 15173430, lire en ligne).
- L'arginine est souvent présentée comme essentielle, ce qui n'est pas tout à fait exact : elle dérive métaboliquement de la citrulline, dont le métabolisme est lié à celui de la proline et de la glutamine, deux acides aminés non essentiels ; en revanche, sa biosynthèse chez l'humain peut ne pas couvrir les besoins de l'organisme, et un apport alimentaire complémentaire est alors nécessaire.
- (en) Arne Schousboe et Helle S. Waagepetersen, « GABA: Homeostatic and pharmacological aspects », Progress in Brain Research, vol. 160, , p. 9-19 (PMID 17499106, DOI 10.1016/S0079-6123(06)60002-2, lire en ligne).
- (en) Katerina V. Savelieva, Shulei Zhao, Vladimir M. Pogorelov, Indrani Rajan, Qi Yang, Emily Cullinan et Thomas H. Lanthorn, « Genetic Disruption of Both Tryptophan Hydroxylase Genes Dramatically Reduces Serotonin and Affects Behavior in Models Sensitive to Antidepressants », PLoS One, vol. 3, no 10, , e3301 (PMID 18923670, PMCID 2565062, DOI 10.1371/journal.pone.0003301, lire en ligne).
- (en) David Shemin et D. Rittenberg, « The biological utilization of glycine for the synthesis of the protoporphyrin of hemoglobin », Journal of Biological Chemistry, vol. 166, no 2, , p. 621-625 (PMID 20276176, lire en ligne).
- (en) Jesús Tejero, Ashis Biswas, Zhi-Qiang Wang, Richard C. Page, Mohammad Mahfuzul Haque, Craig Hemann, Jay L. Zweier, Saurav Misra et Dennis J. Stuehr, « Stabilization and Characterization of a Heme-Oxy Reaction Intermediate in Inducible Nitric-oxide Synthase », Journal of Biological Chemistry, vol. 283, no 48, , p. 33498-33507 (PMID 18815130, PMCID 2586280, DOI 10.1074/jbc.M806122200, lire en ligne).
- (en) Carlos Rodríguez-Caso, Raúl Montañez, Marta Cascante, Francisca Sánchez-Jiménez et Miguel A. Medina, « Mathematical Modeling of Polyamine Metabolism in Mammals », Journal of Biological Chemistry, vol. 281, no 31, , p. 21799-21812 (PMID 16709566, DOI 10.1074/jbc.M602756200, lire en ligne).
- (en) John W. Hylin, « Toxic peptides and amino acids in foods and feeds », Journal of Agricultural and Food Chemistry, vol. 17, no 3, , p. 492-496 (DOI 10.1021/jf60163a003, lire en ligne).
- (en) B. L. Turner et J. B. Harborne, « Distribution of canavanine in the plant kingdom », Phytochemistry, vol. 6, no 6, , p. 863-866 (DOI 10.1016/S0031-9422(00)86033-1, lire en ligne).
- (en) S. Ekanayake, K. Skog et N.-G. Asp, « Canavanine content in sword beans (Canavalia gladiata): Analysis and effect of processing », Food and Chemical Toxicology, vol. 45, no 5, , p. 797-803 (PMID 17187914, DOI 10.1016/j.fct.2006.10.030, lire en ligne).
- (en) G. A. Rosenthal, « L-Canavanine: a higher plant insecticidal allelochemical », Amino Acids, vol. 21, no 3, , p. 319-330 (PMID 11764412, DOI 10.1007/s007260170017, lire en ligne).
- (en) A. C. Hammond, « Leucaena toxicosis and its control in ruminants », Journal of Animal Science, vol. 73, no 5, , p. 1487-1492 (PMID 7665380, lire en ligne).
- (en) Sanjit Konar, Kevin Gagnon, Abraham Clearfield, Charles Thompson, Jennifer Hartle, Clayton Ericson et Chad Nelson, « Structural determination and characterization of copper and zinc bis-glycinates with X-ray crystallography and mass spectrometry », Journal of Coordination Chemistry, vol. 63, no 19, , p. 3335-3347 (DOI 10.1080/00958972.2010.514336, lire en ligne).
- (en) Alex Gutteridge et Janet M. Thornton, « Understanding nature's catalytic toolkit », Trends in Biochemical Sciences, vol. 30, no 11, , p. 622-629 (PMID 16214343, DOI 10.1016/j.tibs.2005.09.006, lire en ligne).
- Louis-Nicolas Vauquelin et Pierre Jean Robiquet, « The discovery of a new plant principle in Asparagus sativus », Annales de chimie, vol. 57, no 2, , p. 1.
- (en) William Hyde Wollaston, « On Cystic Oxide, a New Species of Urinary Calculus », Philosophical Transactions of the Royal Society of London, vol. 100, , p. 223-230 (JSTOR 107222, lire en ligne).
- Henri Braconnot, « Sur la conversion des matières animales en nouvelles substances par le moyen de l’acide sulfurique », Annales de physique et de chimie, vol. 2, , p. 13.
- (en) Robert D. Simoni, Robert L. Hill et Martha Vaughan, « The Discovery of the Amino Acid Threonine: the Work of William C. Rose », Journal of Biological Chemistry, vol. 277, no 37, , E25 (PMID 12218068, lire en ligne).
- (en) Richard H. McCoy, Curtis E. Meyer et William C. Rose, « Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid », Journal of Biological Chemistry, vol. 112, , p. 283-302 (lire en ligne).
Annexes
modifierArticles connexes
modifier- Classement thématique des neurosciences
- Maladie génétique du métabolisme des acides aminés
- Nutriments essentiels, acide aminé essentiel
- Pierre Jean Robiquet, Louis-Nicolas Vauquelin
- Acide pidolique