Ricine
La ricine /ʁisin/ est une glycoprotéine et une toxine végétale produite par une plante de la famille des Euphorbiaceae, le ricin commun (Ricinus communis). Il s'agit d'un hétérodimère constitué de deux chaînes polypeptidiques, où la chaîne B est une lectine et la chaîne A agit comme une protéine inactivatrice de ribosome[5]. Son mécanisme d'action lui confère une forte cytotoxicité, qui fait de la ricine l'une des substances les plus toxiques connues par l'homme.
| Ricine | ||
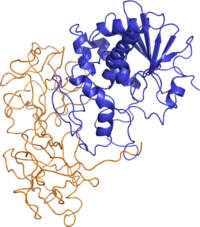 Structure de la ricine. La chaîne A est représentée en bleu et la chaîne B en orange. (PDB 2AAI[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | RCOM_2159910 | |
| Synonymes | R. communis agglutinin II RT ; RTX ; RCA II ; RCA 60 |
|
| Fonction | toxine végétale | |
| Distribution | albumen de la graine | |
| N° EC | 3.2.2.22 | |
| Ricinus communis | ||
| Localisation | génome complet : 0 - 0,01 Mb | |
| Masse moléculaire | ~64 000 Da[2] | |
| Entrez | 8287993 | |
| UniProt | P02879 | |
| RefSeq (ARNm) | XM_002534603.1 | |
| RefSeq (protéine) | XP_002534649.1 | |
| Ricine | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No RTECS | VJ2625000 | ||
| PubChem | 4564 | ||
| Précautions | |||
| NFPA 704[3] | |||
| Transport[3] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 30 mg·kg-1 (souris, oral)[4] 5-10 μg·kg-1 (souris, i.v.)[4] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
La dose létale médiane (DL50) de la ricine chez la souris est d'environ 5 microgrammes par kilogramme de poids corporel par injection intraveineuse. La dose létale orale de la ricine chez l'homme a été estimée entre 1 et 20 µ g/kg de poids corporel (environ 5 à 10 graines de ricin)[6],[4].
La ricine est considérée comme une arme biologique potentielle[7]. Elle est classée comme « agent biologique de catégorie B » par le CDC d'Atlanta[8] et comme « Select Agent » par le HHS[9] et inscrite au tableau 1A (Schedule 1) de la Convention sur l'interdiction des armes chimiques[10]. Plusieurs cas de son utilisation comme poison ont été rapportés, le plus notoire étant l'assassinat du journaliste bulgare Guéorgui Markov[11].
Étymologie et dénominations
modifierLa ricine est une toxalbumine découverte en 1888 par le scientifique allemand Peter Hermann Stillmark, le fondateur de la lectinologie[11]. Le nom donné par Stillmark à la toxine est dérivé du nom de la plante d'où elle est extraite, le ricin – nom lui-même dérivé du latin ricinus (« tique, ricin ») – avec le suffixe -ine (désignant un produit extrait d’une plante).
L'armée britannique assigne à la toxine le code "W" (Agent W) durant la Seconde Guerre mondiale[11].
Plusieurs dénominations spécifiques sont trouvées dans la littérature scientifique anglophone : lectine ou RIP de type 2 de Ricinus communis et l'acronyme "RT" (pour "Ricinus toxin") afin de distinguer les deux chaînes de la ricine, "RTA" et "RTB".
Biochimie
modifierLa ricine est une glycoprotéine de poids moléculaire 64 kDa, formée de deux chaînes polypeptidiques A et B, reliées entre elles par un pont disulfure. La chaîne B permet à la toxine de se fixer à la paroi cellulaire et la chaîne A, responsable des propriétés toxiques, est capable d’inhiber la synthèse des protéines en attaquant l'ARN des ribosomes, entraînant la mort cellulaire. La ricine est ainsi classée comme une protéine inactivant les ribosomes (en anglais Ribosome-inactivating protein aussi désigné par l'acronyme RIP) de type 2. Alors que les RIP de type 1 sont composées d'une seule chaîne protéique qui possède une activité catalytique, les RIP de type 2, également connues sous le nom d'holotoxines, sont composées de deux chaînes protéiques différentes qui forment un complexe hétérodimérique. Les RIP de type 2 sont constitués d'une chaîne A fonctionnellement équivalente à un RIP de type 1, reliée de manière covalente par une seule liaison disulfure à une chaîne B qui est catalytiquement inactive, mais qui sert de médiateur pour le transport du complexe protéique A-B de la surface de la cellule, via des vésicules porteuses, vers la lumière du réticulum endoplasmique (RE). Les RIP de type 1 et de type 2 sont fonctionnellement actifs contre les ribosomes in vitro ; cependant seuls les RIP de type 2 présentent une cytotoxicité in vivo en raison des propriétés de la chaîne B qui s'apparentent à celles d'une lectine[12],[13],[14].
Biosynthèse
modifierLa ricine est synthétisée dans l'albumen[a] des graines de ricin[15],[16],[17]. Une autre protéine similaire à la ricine, l'agglutinine I du ricin commun, se trouve également produite par la plante. Le précurseur protéique de la ricine (proricine ou préproricine) a une longueur de 576 résidus d'acides aminés et contient un peptide signal (résidus 1-35), la chaîne A de la ricine (36-302), un peptide de liaison (303-314) et la chaîne B de la ricine (315-576)[18]. La séquence signal N-terminale transmet le prépolypeptide au réticulum endoplasmique (RE), puis le peptide signal est clivé. Dans le lumen du RE, le propolypeptide est glycosylé et une protéine disulfure isomérase catalyse la formation de liaisons disulfure entre les cystéines 294 et 318. Le propolypeptide est ensuite glycosylé dans l'appareil de Golgi et transporté vers les corps de stockage des protéines. Le propolypeptide est clivé dans les corps protéiques par une endopeptidase pour produire la protéine de ricine mature, composée d'une chaîne A de 267 résidus et d'une chaîne B de 262 résidus, liées par une seule liaison covalente disulfure[15].
Structure
modifier
En termes de structure, la ricine ressemble beaucoup à l'abrine. La structure quaternaire de la ricine est un hétérodimère globulaire glycosylé d'environ 60-65 kDa. La chaîne A et la chaîne B de la toxine ont des poids moléculaires similaires, d'environ 32 kDa et 34 kDa, respectivement.
- La chaîne A de la ricine (RTA) est une N-glycoside hydrolase composée de 267 acides aminés[19]. Elle possède trois domaines structuraux avec environ 50 % du polypeptide arrangé en hélices alpha et en feuillets bêta[20]. Les trois domaines forment une fente prononcée qui est le site actif de la RTA.
- La chaîne B de la ricine (RTB) est une lectine composée de 262 acides aminés capable de se lier aux résidus de galactose terminaux sur les surfaces cellulaires[21]. La RTB forme une structure bilobée, en forme d'haltère, dépourvue d'hélice alpha ou de feuillet bêta, dont les lobes individuels contiennent trois sous-domaines. Au moins un de ces trois sous-domaines dans chaque lobe homologue possède une poche de liaison aux sucres qui confère à la RTB son caractère fonctionnel.
Mécanisme d'action
modifier| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |

La chaîne B de la ricine se lie à des glucides complexes à la surface des cellules eucaryotes contenant soit des résidus terminaux de N-acétylgalactosamine, soit des résidus de bêta-1,4-galactose. En outre, les glycanes de type mannose de la ricine sont capables de se lier aux cellules qui expriment des récepteurs de mannose (une lectine type-C)[22]. Il a été démontré que la RTB se lie à la surface cellulaire à raison de 106-108 molécules de ricine par cellule[23].
La liaison abondante de la ricine aux membranes de surface permet l'internalisation avec tous les types d'invaginations membranaires. L'holotoxine peut être absorbée par des puits recouverts de clathrine, ainsi que par des voies indépendantes de la clathrine, notamment par les cavéoles et la macropinocytose[24],[25]. Les vésicules intracellulaires transportent la ricine vers les endosomes qui sont acheminés vers l'appareil de Golgi. On pense que l'acidification active des endosomes a peu d'effet sur les propriétés fonctionnelles de la ricine. La ricine étant stable dans une large gamme de pH, la dégradation dans les endosomes ou les lysosomes n'offre que peu ou pas de protection contre la ricine[26]. On pense que les molécules de ricine suivent un transport rétrograde via les endosomes précoces, le réseau trans-golgien et l'appareil de Golgi pour pénétrer dans la lumière du réticulum endoplasmique (RE)[27].
Pour que la ricine fonctionne de manière cytotoxique, la RTA doit être clivée par réduction[28] à partir de la RTB afin de libérer un bloc stérique du site actif de la RTA. Ce processus est catalysé par la protéine PDI (protéine disulfure isomérase) qui réside dans la lumière du RE[29],[30]. La RTA libre dans la lumière du RE se déplie alors partiellement et s'enfouit partiellement dans la membrane du RE, où l'on pense qu'elle imite une protéine mal repliée associée à la membrane[31]. Des rôles pour les protéines chaperons du RE GRP94[32], EDEM[33] et BiP[34] ont été proposés avant la "dislocation" de RTA de la lumière du RE vers le cytosol d'une manière qui utilise des composants de la voie de dégradation des protéines associée au réticulum endoplasmique (ERAD). La voie de dégradation des protéines associée au réticulum endoplasmique (ERAD) évacue normalement les protéines mal repliées du réticulum endoplasmique vers le cytosol afin qu'elles soient détruites par les protéasomes cytosoliques. La dislocation de RTA nécessite des complexes E3 ubiquitine ligase intégrés à la membrane du RE[35], mais RTA évite l'ubiquitination qui se produit habituellement avec les substrats ERAD en raison de sa faible teneur en résidus lysine, qui sont les sites d'attachement habituels de l'ubiquitine[36]. Ainsi, la RTA évite le sort habituel des protéines disloquées (destruction qui est médiée par le ciblage des protéines ubiquitinylées vers les protéasomes cytosoliques). Dans le cytosol des cellules de mammifères, la RTA subit ensuite un triage par les chaperons moléculaires cytosoliques Hsc70 et Hsp90 et leurs co-chaperons, ainsi que par une sous-unité (RPT5) du protéasome lui-même, ce qui entraîne son repliement dans une conformation catalytique[32],[37], qui dépurine les ribosomes, stoppant ainsi la synthèse des protéines.
La RTA possède une activité ARNr N-glycosylase qui est responsable du clivage d'une liaison glycosidique dans le grand ARNr de la sous-unité 60S des ribosomes eucaryotes[38]. La RTA hydrolyse de manière spécifique et irréversible la liaison N-glycosidique du résidu adénine en position 4324 (A4324) dans l'ARNr 28S, mais laisse intact le squelette phosphodiester de l'ARN[39]. La ricine cible A4324 qui est contenu dans une séquence hautement conservée de 12 nucléotides que l'on trouve universellement dans les ribosomes eucaryotes. La séquence 5'-AGUACGAGAGGA-3', appelée boucle sarcine-ricine, est importante pour la liaison des facteurs d'élongation pendant la synthèse des protéines[40]. L'événement de dépurination inactive rapidement et complètement le ribosome, ce qui entraîne une toxicité due à l'inhibition de la synthèse des protéines. Une seule molécule de RTA dans le cytosol est capable de dépuriner environ 1 500 ribosomes par minute. Ainsi on estime qu'une seule molécule de ricine est capable de tuer une seule cellule.
Le site actif de RTA contient plusieurs résidus d'acides aminés invariants impliqués dans la dépurination de l'ARN ribosomal[26]. Bien que le mécanisme exact de l'événement soit inconnu, les résidus d'acides aminés clés identifiés comprennent la tyrosine aux positions 80 et 123, l'acide glutamique à la position 177, et l'arginine à la position 180. En particulier, il a été démontré que Arg180 et Glu177 sont impliqués dans le mécanisme catalytique, et non dans la liaison au substrat, grâce à des études de cinétique enzymatique impliquant des mutants de RTA. Un modèle de réaction proposé est le suivant[41] :
- Le substrat de la boucle sarcine-ricine se lie au site actif de RTA avec l'adénine cible empilée contre tyr80 et tyr123.
- Arg180 est positionné de manière à pouvoir protoner N-3 de l'adénine et rompre la liaison entre N-9 de l'anneau adénine et C-1' du ribose.
- La rupture de la liaison entraîne la formation d'un ion oxycarbonium sur le ribose, stabilisé par le Glu177.
- La protonation N-3 de l'adénine par Arg180 permet la déprotonation d'une molécule d'eau voisine.
- L'hydroxyle résultant attaque l'ion carbonium du ribose.
- La dépurination de l'adénine donne un ribose neutre sur un squelette d'ARN phosphodiester intact.
Rôle évolutif
modifierLe rôle de la ricine et des autres RIP dans la nature, et plus largement dans l'évolution des plantes, est encore mal compris. Une hypothèse assez répandue est que les RIP pourraient constituer une défense contre les prédateurs et/ou les parasites. Il est possible que l'activité antivirale des RIP prévienne ou au moins limite les infections virales chez certaines plantes. En outre, il est probable que les RIP de type 2 toxiques dissuadent les animaux de manger les plantes qui les contiennent, ce qui est moins probable dans le cas des RIP de type 1, qui sont présents dans les plantes comestibles. Comme l'expression des RIP est renforcée dans les plantes ou les feuilles en état de sénescence ou soumises à divers stress biotiques et abiotiques, ils pourraient également jouer un rôle dans la résistance des plantes au stress, peut-être via la réorganisation du métabolisme des protéines par l'inhibition de la synthèse des protéines[42].
Propriétés physico-chimiques
modifierLa ricine purifiée est une poudre blanche soluble dans l'eau et stable dans une large gamme de pH. Elle est inactivée par la chaleur, à 80°C dans une solution aqueuse pendant une heure, et nécessite des températures plus élevées ou des périodes d'inactivation plus longues lorsqu'elle se présente sous forme de poudre ou de produit brut (non purifié)[4]. La ricine est également inactivée par une exposition de 30 minutes à des concentrations d'hypochlorite de sodium (NAClO) de 0,1 % à 2,5 % (eau de javel diluée)[7].
Toxicologie
modifierLa toxicité de la ricine dans les modèles animaux comme la souris est relativement bien documentée. Les valeurs de toxicocinétique et toxicodynamique chez l'homme sont souvent extrapolées à partir des données obtenues par l'étude de la toxine chez l'animal et au travers des cas d'intoxication occasionnels. La section présente fait le résumé des connaissances sur la toxicité de la ricine[6],[4],[43],[7].
Ingestion
modifierLa littérature ne fait état d'aucun cas d'empoisonnement dû à l'ingestion de ricine purifiée. Tous les rapports cliniques concernant l'empoisonnement font référence à l'ingestion de graines de ricin[44]. La dose létale médiane orale (DL50) chez la souris est de 30 mg/kg, soit environ 1000 fois plus élevée que par injection ou inhalation (donc la ricine est mille fois plus toxique par voie pulmonaire ou parentérale). Cette toxicité plus faible par voie orale est due à la dégradation de la toxine dans le tractus gastro-intestinal. Dans des rapports sur l'ingestion de graines de ricin chez l'homme, la dose orale létale chez l'homme a été estimée à 1-20 mg/kg de poids corporel (ce qui correspond à environ 8 graines de ricin). Mais les doses de ricine estimées à partir du nombre de graines ingérées peuvent donner des estimations inexactes en raison de la variation de la taille, du poids et de la teneur en eau des graines ; de la région, de la saison et de la période de croissance de la plante au moment de la récolte des graines ; ainsi que du degré de mastication, de l'âge et des comorbidités[45],[6],[46],[47],[48]. Les symptômes (de légers à mortels) se manifestent, selon les cas, après l'ingestion d'un nombre de graines variant entre 0,5 et 30. Dans un cas, il a été rapporté que l'ingestion de 2 graines seulement a suffit à causer la mort[46]. Dans les modèles animaux, la ricine ingérée est absorbée dans les 2 heures par les vaisseaux lymphatiques et sanguins, et elle s'accumule principalement dans le foie et la rate.
Injection
modifierIl existe peu de données publiées sur l'exposition humaine à la ricine par voie parentérale. La DL50 chez la souris est d'environ 5 à 10 μg/kg[49],[50]. Les doses létales minimales varient de 0,7 à 2 μg/kg chez la souris et de 1 à 1,75 μg/kg chez le chien[51].
Inhalation
modifierLe dépôt pulmonaire et la létalité après inhalation de ricine sont fortement influencés par la taille des particules (diamètre aérodynamique équivalent)[52]. Les particules de faible taille peuvent se déposer plus profondément dans les voies respiratoires, ce qui entraîne une mortalité plus élevée[53]. Les particules d'un diamètre de plus en plus grand se déposent généralement plus haut dans les voies respiratoires et peuvent être balayées par le système mucociliaire, puis avalées[54]. La DL50 chez les souris exposées à une forme de ricine, de taille particulaire inférieure à 5 μm, est d'environ 3 à 5 μg/kg. Des singes exposés à la ricine inhalée ont développé une dyspnée progressive 20 à 24 heures après l'administration de 21 à 42 μg/kg de particules de 1 à 2 μm de diamètre[55]. Trois des cinq singes sont morts, respectivement après 36, 40 et 48 heures. L'autopsie a révélé un œdème pulmonaire diffus avec des zones multifocales de nécrose et d'inflammation. Les lésions étaient significativement plus graves dans les voies aériennes distales et les alvéoles. La toxicité résulte de l'inhibition de la synthèse des protéines, de la libération de cytokines et de lésions directes de la membrane épithéliale. La cible principale de la toxicité après inhalation de ricine sont les pneumocytes de type I et II[53],[55],[56],[57]. Il n'y a pas eu d'absorption systémique significative après une exposition par inhalation et la toxicité était principalement limitée aux voies respiratoires dans ces études sur les animaux[54],[58],[53].
Contact dermatologique ou ophtalmologique
modifierLa ricine ne traverse pas la barrière de la peau. Toutefois, une réaction allergique urticarienne à médiation IgE peut se produire après manipulation de la plante de ricin ou exposition à la poussière ou au tourteau de ricin[59],[60],[61],[62],[63],[64]. Une irritation et le développement d'une conjonctivite pseudomembraneuse après exposition oculaire à de très faibles concentrations de ricine ont été rapportées chez les animaux[65]. L'allergénicité de la plante est due à l'activité, non pas de la ricine, mais des protéines de la fraction allergène, constituée principalement des albumines 2S.
Méthodes de détection et d'analyse
modifier
De nombreuses méthodes de détection et de quantification de la ricine ont été mises au point[66],[67]. Ces méthodes se répartissent en quatre catégories selon le type : activité/toxicité, instrumentation chimique, immunodétection et détection indirecte. La référence standard pour la détection de la ricine est la toxicité chez la souris[68].
Tests d'activité biologique et de toxicité
modifierL'inhibition in vivo de la biosynthèse des protéines dans les cultures cellulaires[69] et l'inhibition in vitro de la synthèse des protéines[70] se sont révélées être des méthodes fiables pour détecter la ricine sans avoir recours à l'expérimentation animale et à la biopsie. Lorsque des cellules Vero transduites avec un adénovirus portant un gène de protéine fluorescente verte sont exposées à la ricine, la perte de la synthèse protéique est mesurée par la réduction de la fluorescence. Cette méthode permet de détecter la ricine jusqu'au seuil de 200 pg/mL[69]. Une autre méthode d'une sensibilité similaire mesure la perte de luminescence des échantillons traités à la ricine dans un système de biosynthèse protéique in vitro auquel est ajouté l'ARNm de la luciférase[70] Cette méthode repose directement sur l'action enzymatique de la sous-unité A de la ricine (RTA), à savoir la N-glycosidase qui libère une adénine de l'ARN 28S, entraînant la dysfonction du ribosome. Ce test est efficace pour détecter les RIP de type 1 et de type 2. Un autre test utilise des cellules Vero et contrôle le nombre de cellules viables (test de viabilité) restantes après traitement à la ricine ou à l'agglutinine de R. communis (RCA)[71]. La spécificité de ces systèmes in vivo et in vitro a été assurée par la démonstration de la perte d'activité de la ricine après ajout d'un anticorps à la toxine. Un autre test reposant sur la détection de l'adénine libérée de l'ARN a également été mis au point et permet de détecter les deux types de RIP[72]. La méthode utilise une réaction enzymatique couplée qui convertit l'adénine libérée en ATP, qui à son tour provoque l'émission de luminescence par la luciférase.
Détection physique
modifierLa détection directe par des méthodes instrumentales a été limitée à la détection par spectrométrie de masse à temps de vol avec désorption-ionisation laser assistée par matrice (MALDI-TOF MS)[73],[74],[75]. La ricine est séparée des autres matières présentes dans les échantillons par chromatographie d'exclusion stérique, puis elle est hydrolysée avec de la trypsine. L'hydrolysat est analysé par MALDI-TOF MS et les peptides de ricine sont identifiés par comparaison des ions de masse avec une base de données en ligne et par comparaison des peptides identifiés avec ceux d'un échantillon de référence.
Tests immunologiques
modifierLes approches les plus largement utilisées et les plus sensibles pour la détection spécifique de la ricine sont basées sur l'immunodétection. Les premiers travaux ont utilisé l'immunodiffusion radiale (IDR). Bien que cette technique ne soit pas très sensible, elle est reproductible et s'est avérée efficace pour identifier et sélectionner des variétés de ricin à faible teneur en ricine[76],[77]. La mise au point d'anticorps monoclonaux contre la ricine a permis la détection spécifique de la ricine et de l'agglutinine[78] sans interférence de la partie glucidique de la protéine, qui peut entraîner la détection de protéines autres que la ricine. Des anticorps monoclonaux qui distinguent la ricine et la RCA ont été mis au point[79]. Les anticorps monoclonaux anti-ricine se sont révélés efficaces pour détecter la ricine dans le lait[80] ainsi que dans d'autres aliments, et ont contribué à l'effort de sélection du ricin en identifiant des cultivars à faible teneur en ricine[81].
Le test le plus sensible pour la ricine était basé sur l'immunoPCR (IPCR)[82]. L'ADN est libéré par voie enzymatique, puis amplifié et quantifié par PCR en temps réel (RT-PCR). Ce test est 10 à 1000 fois plus sensible que les tests ELISA pour détecter la ricine dans les échantillons alimentaires. Grâce à sa sensibilité, il est possible de contrôler les niveaux de ricine dans le sang de souris traitées à la ricine[82].
Détection indirecte
modifierLes méthodes de détection indirecte de la ricine ont analysé les échantillons à la recherche de composants présents dans les extraits de graines de ricin, en particulier l'ADN de ricin et l'alcaloïde ricinine[73]. Bien que la simple PCR soit efficace pour détecter l'ADN de ricin, en utilisant la RT-PCR, le niveau d'ADN peut être quantifié pour obtenir une indication du niveau de contamination[83]. L'alcaloïde ricinine est présent dans toute la plante de ricin depuis le début de la germination jusqu'à la maturation des graines[84]. La ricinine est couramment utilisée pour détecter l'empoisonnement à la ricine[85], car elle est éliminée de l'organisme dans les urines et facilement identifiée par GC-MS ou LC-MS.
Gestion médicale de l'intoxication
modifierL'intoxication à la ricine est très rare et souvent d'origine accidentelle[44]. La section présente fait état des recommandations provenant d'instituts américains de biodéfense[86] et de médecine militaire[87] sur son diagnostic et sa prise en charge.
Signes et symptômes
modifierLa pathologie dépend de la voie d'exposition. Après une exposition par aérosol, les signes et symptômes dépendent de la dose inhalée. Les expositions accidentelles sublétales à des aérosols, qui se sont produites chez l'homme dans les années 1940, étaient caractérisées par l'apparition de fièvre, d'oppression thoracique, de toux, de dyspnée, de nausées et d'arthralgies dans un délai de 4 à 8 heures[88],[6]. L'apparition d'une transpiration abondante quelques heures plus tard coïncidait généralement avec la disparition de la plupart des symptômes. Bien que des expositions létales à des aérosols chez l'homme n'ont jamais été décrites, les changements physiopathologiques graves observés dans les voies respiratoires des animaux, y compris la nécrose et l'inondation sévère des alvéoles, ont été suffisants pour provoquer la mort par syndrome de détresse respiratoire aigu (SDRA) et insuffisance respiratoire. Le délai avant la mort chez les animaux de laboratoire dépend de la dose et se situe entre 36 et 72 heures après l'inhalation[89]. On peut s'attendre à ce que les humains exposés développent une inflammation pulmonaire grave accompagnée d'une toux progressive, d'une dyspnée, d'une cyanose et d'un œdème pulmonaire.
Par d'autres voies d'exposition, la ricine n'est pas un irritant direct des poumons ; cependant, l'injection intraveineuse (IV) peut provoquer un œdème périvasculaire pulmonaire minime dû à une lésion de l'endothélium vasculaire. L'ingestion (intoxication orale) provoque une nécrose de l'épithélium gastro-intestinal, une hémorragie locale et une nécrose hépatique, splénique et rénale. Seuls 13 décès ont été enregistrés depuis la fin des années 1880 sur les 875 cas accidentels d'ingestion de graines de ricin signalés[44]. L'ingestion de ricine est rarement mortelle en raison de la dégradation de la toxine par le faible pH de l'acide gastrique. L'injection intramusculaire (IM) provoque une nécrose locale grave des muscles et des ganglions lymphatiques régionaux, avec une atteinte modérée des organes viscéraux.
Diagnostic
modifierUne attaque à la ricine en aérosol serait principalement diagnostiquée par l'observation des caractéristiques cliniques dans le contexte épidémiologique approprié. Une lésion pulmonaire aiguë affectant un grand nombre de cas géographiquement regroupés devrait faire suspecter une attaque avec un irritant pulmonaire tel que la ricine, bien que d'autres agents pulmonaires puissent présenter des signes et des symptômes similaires. D'autres menaces biologiques, telles que l'entérotoxine B staphylococcique (SEB), la fièvre Q, la tularémie, la peste et certains agents chimiques de guerre comme le phosgène, doivent être pris en compte dans le diagnostic différentiel. L'œdème pulmonaire induit par la ricine devrait survenir beaucoup plus tard (1 à 3 jours après l'exposition) que celui induit par le SEB (environ 12 heures après l'exposition) ou le phosgène (environ 6 heures après l'exposition). L'intoxication à la ricine évolue malgré un traitement antibiotique, contrairement à un processus infectieux. L'intoxication à la ricine ne provoque pas de médiastinite comme dans le cas de l'anthrax par inhalation. Les patients atteints d'une intoxication à la ricine n'atteignent pas un plateau clinique comme dans le cas d'une intoxication au SEB. Les autres caractéristiques cliniques ou diagnostiques après une exposition à la ricine par aérosol sont les suivantes : infiltrats bilatéraux sur la radiographie du thorax, hypoxémie artérielle, leucocytose neutrophile et aspirat bronchique riche en protéines par rapport au plasma, ce qui est caractéristique d'un œdème pulmonaire de haute perméabilité.
Des immunodosages spécifiques du sérum et des sécrétions respiratoires, des prélèvements cutanés et/ou nasaux, ou des colorations immunohistochimiques de tissus peuvent être utilisés lorsqu'ils sont disponibles. En raison de l'absorption cellulaire et de la distribution rapides de la toxine, une détection précoce est essentielle pour les soins et la survie du patient[90]. La ricine a une demi-vie biphasique, une phase alpha et une phase bêta, ce qui limite la détection à 24 heures après l'intoxication[91]. Plusieurs méthodes et plates-formes biochimiques sont utilisées pour la détection de la ricine : billes magnétiques marquées liées à des anticorps, anticorps de capture et de détection, ou par chromatographie en phase liquide-spectrométrie de masse (LC-MS)[88].
Traitement
modifierLa prise en charge des patients intoxiqués par la ricine varie en fonction de la voie d'exposition. Les patients présentant une intoxication pulmonaire sont pris en charge par le niveau approprié d'assistance respiratoire (oxygène, intubation, ventilation, pression expiratoire positive et surveillance hémodynamique) et par le traitement de l'œdème pulmonaire, le cas échéant. L'intoxication gastro-intestinale est traitée au mieux par un lavage gastrique, suivi de l'utilisation de cathartiques. L'administration de charbon suractivé au patient peut être utilisée pour neutraliser la toxine non liée. Il est important de remplacer les pertes de liquide gastro-intestinal par des fluides. Les anticorps anti-ricine peuvent atténuer les dommages causés s'ils sont administrés dès les premiers stades de l'intoxication[92],[93]. Les AINS peuvent être utilisés pour limiter les effets inflammatoires associés à la toxine. En cas d'exposition percutanée, le traitement est avant tout un traitement de soutien.
Prophylaxie
modifierLes masques à gaz sont efficaces pour prévenir l'exposition aux aérosols de toxine. Bien qu'aucun vaccin approuvé et commercialisé ne soit actuellement disponible, des vaccins candidats sont en cours de développement (voir la section Développement de contre-mesures médicales).
Développement de contre-mesures médicales
modifierInhibiteurs chimiques
modifier
En 2010, une équipe[b] a annoncé avoir découvert une molécule dite Rétro-2, qui — in vivo — protège, préventivement, des souris contre la ricine[94]. Cette molécule semble également protéger des toxines AB produites par le choléra ou des shigatoxines de la bactérie Shigella, cause de dysenteries (shigellose). Ces chercheurs avaient antérieurement identifié une autre molécule (dite Rétro-1), mais qui ne semble active que in vitro contre la toxicité de la ricine. Le mécanisme de protection est l'inhibition de l'entrée de la chaîne A de la ricine (RTA) dans les cellules cibles, entre les endosomes précoces et l'appareil de Golgi. Les souris exposées à un empoisonnement à la ricine par voie nasale ont toutes survécu (contre 15 % pour le groupe témoin).
Vaccins anti-ricine
modifierL'USAMRIID (United States Army Medical Research Institute of Infectious Diseases) dispose actuellement d'un vaccin à base de chaîne A (RTA) de la ricine, RVEc™, qui fait l'objet d'essais cliniques. Ce vaccin est bien toléré et immunogène, conférant une protection contre les expositions létales par aérosol chez les animaux[95]. La société biopharmaceutique américaine Soligenix, Inc. a obtenu une licence pour un vaccin anti-ricine appelé RiVax développé par l'University of Texas Southwestern Medical School. RiVax est construit à partir d'une autre chaîne RTA recombinante[93]. Le vaccin s'est avéré sûr et immunogène chez la souris, le lapin et l'homme. Deux essais cliniques ont été réalisés avec succès[96]. Le vaccin candidat a obtenu le statut de médicament orphelin aux États-Unis et dans la CEE. Des subventions du National Institute of Allergy and Infectious Diseases et de la Food and Drug Administration des États-Unis ont soutenu son développement[97].
Risque criminel
modifier
En 1978, l’épisode du « parapluie bulgare » visait un opposant bulgare par les services secrets soviétiques de l’époque. À l’aide d’un parapluie muni d’un système permettant l’injection de ricine, l’opposant fut éliminé. Compte tenu de son pouvoir particulièrement toxique, la ricine pourrait être employée dans le cadre d'attaques terroristes (voir bioterrorisme et Plan Biotox) ou de crime d'État. Ainsi, le , le ministre de l'Intérieur français Gérard Collomb a annoncé qu’un attentat impliquant une personne projetant une attaque à la ricine aurait été déjoué en France[98].
Le , la police allemande annonce avoir déjoué un attentat à la bombe à la ricine après avoir arrêté un Tunisien à Cologne ayant commencé à synthétiser le poison[99].
Le , l'hebdomadaire tchèque Respekt rapporte qu'un agent secret russe muni d'un passeport diplomatique serait arrivé à Prague avec de la ricine dans sa mallette. Accueilli sur place par l'ambassade de Russie, cet agent aurait pour mission d'empoisonner le préfet de Prague 6 Ondřej Kolář et le maire de la ville Zdeněk Hřib. Les deux hommes seraient visés, l'un pour avoir démonté dans son district la statue du maréchal soviétique Ivan Koniev, et l'autre pour avoir baptisé la place devant l'ambassade russe du nom de Boris Nemtsov, opposant de Poutine assassiné en 2015[100],[101]. Finalement, cette histoire de ricine s'avère être une pure invention et débouche sur l'expulsion du pays de deux employés de l'ambassade russe dont l'un serait à l'origine de la fausse alerte, selon le service de renseignement tchèque BIS[102].
Le , dans un courrier adressé au Sénat des États-Unis. Le lendemain, le président américain Barack Obama reçoit une lettre contenant également de la ricine[103].
En , une enveloppe contenant de la ricine est adressée à la Maison-Blanche et interceptée avant d’atteindre le président Donald Trump[104]. Le FBI (USA) demande la collaboration de la GRC (Canada) afin d’enquêter. Cela mène à l’arrestation de Pascale Ferrier, une résidente de Longueuil au Québec. Elle qui est d’origine française a obtenu sa citoyenneté canadienne en 2015. Elle aurait aussi envoyé des lettres dans cinq destinations adressées à des institutions du Texas. Tous contenaient de la ricine selon l’enquête. Elle aurait eu plusieurs démêlés avec la justice américaine précédemment. Les lettres auraient été envoyées à partir de Montréal.
La ricine a été utilisée comme poison dans les années 1970, par les services secrets bulgares («parapluie bulgare») ou pour des suicides.
Dans la fiction
modifierDans son roman La Vengeance du Kremlin (2013), l'écrivain Gérard de Villiers met en scène une équipe de tueurs qui tentent d'assassiner Malko Linge en le piquant à l'aide d'un dard empoisonné à la ricine. Un autre produit chimique létal est employé dans le roman pour assassiner avec succès Boris Berezovsky, le fluorure de sodium.
Dans la série télévisée Breaking Bad, la ricine est un élément central de l'intrigue du début de la saison 2 et des saisons 3, 4 et 5[105].
La popularité de Breaking Bad a inspiré plusieurs affaires criminelles réelles impliquant de la ricine ou des substances similaires. À Londres, une femme tente d'empoisonner sa mère avec de l'abrine après que cette dernière ait interféré avec ses projets de mariage[106]. En Angleterre, un homme de Liverpool est condamné après avoir tenté d'acheter 500 mg de ricine sur le dark web auprès d'un agent du FBI sous couverture. Il est condamné en 2015 à huit ans d'emprisonnement[107].
Dans la nouvelle La Maison de la mort d'Agatha Christie, la ricine est utilisée comme élément de l'intrigue.
Dans la dernière saison de Walker, Texas Ranger, la ricine est utilisée par Emil Lavocat pour assassiner le meilleur ami et ancien partenaire du Texas Ranger titulaire, C.D. Parker, afin de se venger d'eux et de tous les Rangers de leur compagnie pour son emprisonnement. Bien que le meurtre ait été maquillé en crise cardiaque vers la fin de "The Avenging Angel", la vérité sur la mort de C.D. est révélée dans le final, "The Final Show/Down", lorsque Walker et Trivette font exhumer et autopsier le corps de C.D. Parker.
Dans le film The Good Mother (2013), une mère injecte de la ricine à ses filles et les nourrit dans un cas de syndrome de Münchhausen par procuration ; elle est arrêtée après la mort d'une de ses filles.
Dans le film The Interview (2014), un timbre transdermique contenant de la ricine est utilisé dans le cadre d'un complot de la CIA visant à assassiner le dictateur nord-coréen Kim Jong-un par une poignée de main.
Notes et références
modifierNotes
modifier- Le terme utilisé en anglais est endosperm, qu'il ne faut pas traduire par le mot français endosperme dont l'usage est différent dans la botanique francophone.
- Équipe associant le CEA, l'Institut Curie, le CNRS, l'Afssaps et l'Université de Montpellier, dans le cadre du programme interministériel de R&D NRBC-E (nucléaire, radiologique, biologique, chimique et explosifs) confié au CEA en 2005 par le SGDSN ; résultats publiés en ligne par la revue Cell.
Références
modifier- (en) Earl Rutenber, Betsy J. Katzin, Stephen Ernst, Edward J. Collins, Debra Mlsna, Michael P. Ready et Jon D. Robertus, « Crystallographic refinement of ricin to 2.5 Å », Proteins, vol. 10, no 3, , p. 240-250 (PMID 1881880, DOI 10.1002/prot.340100308, lire en ligne).
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- CDC NIOSH, « Ricin: Biotoxin », sur cdc.gov (consulté le )
- Audi 2005.
- Olsnes et Pihl 1982.
- Bradberry 2003.
- Millard et LeClaire 2008.
- (en) Centers for Disease Control and Prevention, « Bioterrorism Agents/Diseases », sur emergency.cdc.gov (consulté le )
- (en) Federal Select Agent Program, « Select Agents and Toxins List », sur selectagents.gov (consulté le )
- Organisation pour l'interdiction des armes chimiques, « Convention sur l'Interdiction de la Mise au Point, de la Fabrication, du Stockage et de l'Emploi des Armes Chimiques et sur leur Destruction » [PDF], sur opcw.org (consulté le )
- Olsnes 2004.
- Sharon et Lis 2007.
- Mantis 2008.
- Stirpe et Lappi 2014.
- J. Michael Lord et Lynne M. Roberts, « Ricin: structure, synthesis, and mode of action », dans Microbial Protein Toxins, vol. 11, Springer Berlin Heidelberg, , 21ệ5–233 (ISBN 978-3-540-23562-0, DOI 10.1007/b100198, lire en ligne)
- (en) Lynne M. Roberts et J. M. Lord, « Protein biosynthetic capacity in the endosperm tissue of ripening castor bean seeds », Planta, vol. 152, no 5, , p. 420–427 (ISSN 1432-2048, DOI 10.1007/BF00385358, lire en ligne, consulté le )
- (en) Grace Q. Chen, Xiaohua He et Thomas A. McKeon, « A Simple and Sensitive Assay for Distinguishing the Expression of Ricin and Ricinus communis Agglutinin Genes in Developing Castor Seed (R. communis L.) », Journal of Agricultural and Food Chemistry, vol. 53, no 6, , p. 2358–2361 (ISSN 0021-8561 et 1520-5118, DOI 10.1021/jf040405t, lire en ligne, consulté le )
- « P02879 Ricin precursor – Ricinus communis (Castor bean) », sur UniProtKB, UniProt Consortium
- (en) Sjur Olsnes et Alexander Pihl, « Different biological properties of the two constituent peptide chains of ricin a toxic protein inhibiting protein synthesis », Biochemistry, vol. 12, no 16, , p. 3121–3126 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi00740a028, lire en ligne, consulté le )
- (en) Simon A. Weston, Alec D. Tucker, David R. Thatcher et Dean J. Derbyshire, « X-ray Structure of Recombinant Ricin A-Chain at 1.8 Å Resolution », Journal of Molecular Biology, vol. 244, no 4, , p. 410–422 (DOI 10.1006/jmbi.1994.1739, lire en ligne, consulté le )
- (en) R. Wales, P.T. Richardson, L.M. Roberts et H.R. Woodland, « Mutational analysis of the galactose binding ability of recombinant ricin B chain. », Journal of Biological Chemistry, vol. 266, no 29, , p. 19172–19179 (DOI 10.1016/S0021-9258(18)54978-4, lire en ligne, consulté le )
- (en) Sigurdur Magnusson, Rune Kjeken et Trond Berg, « Characterization of Two Distinct Pathways of Endocytosis of Ricin by Rat Liver Endothelial Cells », Experimental Cell Research, vol. 205, no 1, , p. 118–125 (DOI 10.1006/excr.1993.1065, lire en ligne, consulté le )
- (en) Nathalie Sphyris, J. Michael Lord, Richard Wales et Lynne M. Roberts, « Mutational Analysis of the Ricinus Lectin B-chains », Journal of Biological Chemistry, vol. 270, no 35, , p. 20292–20297 (DOI 10.1074/jbc.270.35.20292, lire en ligne, consulté le )
- (en) M Moya, A Dautry-Varsat, B Goud et D Louvard, « Inhibition of coated pit formation in Hep2 cells blocks the cytotoxicity of diphtheria toxin but not that of ricin toxin. », The Journal of cell biology, vol. 101, no 2, , p. 548–559 (ISSN 0021-9525 et 1540-8140, PMID 2862151, PMCID PMC2113662, DOI 10.1083/jcb.101.2.548, lire en ligne, consulté le )
- (en) Benjamin J Nichols et Jennifer Lippincott-Schwartz, « Endocytosis without clathrin coats », Trends in Cell Biology, vol. 11, no 10, , p. 406–412 (DOI 10.1016/S0962-8924(01)02107-9, lire en ligne, consulté le )
- (en) Michael J Lord, Nicholas A Jolliffe, Catherine J Marsden et Cassandra S C Pateman, « Ricin: Mechanisms of Cytotoxicity », Toxicological Reviews, vol. 22, no 1, , p. 53–64 (ISSN 1176-2551, DOI 10.2165/00139709-200322010-00006, lire en ligne, consulté le )
- (en) Robert A Spooner, Daniel C Smith, Andrew J Easton et Lynne M Roberts, « Retrograde transport pathways utilised by viruses and protein toxins », Virology Journal, vol. 3, no 1, (ISSN 1743-422X, PMID 16603059, PMCID PMC1524934, DOI 10.1186/1743-422X-3-26, lire en ligne, consulté le )
- (en) H. Tonie Wright et Jon D. Robertus, « The intersubunit disulfide bridge of ricin is essential for cytotoxicity », Archives of Biochemistry and Biophysics, vol. 256, no 1, , p. 280–284 (DOI 10.1016/0003-9861(87)90447-4, lire en ligne, consulté le )
- (en) Robert A. Spooner, Peter D. Watson, Catherine J. Marsden et Daniel C. Smith, « Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum », Biochemical Journal, vol. 383, no 2, , p. 285–293 (ISSN 0264-6021 et 1470-8728, PMID 15225124, PMCID PMC1134069, DOI 10.1042/BJ20040742, lire en ligne, consulté le )
- (en) Giuseppe Bellisola, Giulio Fracasso, Rodolfo Ippoliti et Gianfranco Menestrina, « Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase », Biochemical Pharmacology, vol. 67, no 9, , p. 1721–1731 (DOI 10.1016/j.bcp.2004.01.013, lire en ligne, consulté le )
- (en) Peter U. Mayerhofer, Jonathan P. Cook, Judit Wahlman et Teresa T.J. Pinheiro, « Ricin A Chain Insertion into Endoplasmic Reticulum Membranes Is Triggered by a Temperature Increase to 37 °C », Journal of Biological Chemistry, vol. 284, no 15, , p. 10232–10242 (PMID 19211561, PMCID PMC2665077, DOI 10.1074/jbc.M808387200, lire en ligne, consulté le )
- (en) Robert A. Spooner, Philip J. Hart, Jonathan P. Cook et Paola Pietroni, « Cytosolic chaperones influence the fate of a toxin dislocated from the endoplasmic reticulum », Proceedings of the National Academy of Sciences, vol. 105, no 45, , p. 17408–17413 (ISSN 0027-8424 et 1091-6490, PMID 18988734, PMCID PMC2580750, DOI 10.1073/pnas.0809013105, lire en ligne, consulté le )
- (en) Monika Slominska-Wojewodzka, Tone F. Gregers, Sébastien Wälchli et Kirsten Sandvig, « EDEM Is Involved in Retrotranslocation of Ricin from the Endoplasmic Reticulum to the Cytosol », Molecular Biology of the Cell, vol. 17, no 4, , p. 1664–1675 (ISSN 1059-1524 et 1939-4586, PMID 16452630, PMCID PMC1415288, DOI 10.1091/mbc.e05-10-0961, lire en ligne, consulté le )
- (en) Tone Gregers, Sigrid Skånland, Sébastien Wälchli et Oddmund Bakke, « BiP Negatively Affects Ricin Transport », Toxins, vol. 5, no 5, , p. 969–982 (ISSN 2072-6651, PMID 23666197, PMCID PMC3709273, DOI 10.3390/toxins5050969, lire en ligne, consulté le )
- (en) Shuyu Li, Robert A. Spooner, Stuart C. H. Allen et Christopher P. Guise, « Folding-competent and Folding-defective Forms of Ricin A Chain Have Different Fates after Retrotranslocation from the Endoplasmic Reticulum », Molecular Biology of the Cell, vol. 21, no 15, , p. 2543–2554 (ISSN 1059-1524 et 1939-4586, PMID 20519439, PMCID PMC2912342, DOI 10.1091/mbc.e09-08-0743, lire en ligne, consulté le )
- (en) Emma D. Deeks, Jonathan P. Cook, Philip J. Day et Daniel C. Smith, « The Low Lysine Content of Ricin A Chain Reduces the Risk of Proteolytic Degradation after Translocation from the Endoplasmic Reticulum to the Cytosol », Biochemistry, vol. 41, no 10, , p. 3405–3413 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi011580v, lire en ligne, consulté le )
- (en) Paola Pietroni, Nishi Vasisht, Jonathan P. Cook et David M. Roberts, « The proteasome cap RPT5/Rpt5p subunit prevents aggregation of unfolded ricin A chain », Biochemical Journal, vol. 453, no 3, , p. 435–445 (ISSN 0264-6021 et 1470-8728, PMID 23617410, PMCID PMC3778710, DOI 10.1042/BJ20130133, lire en ligne, consulté le )
- (en) Y Endo et K Tsurugi, « RNA N-glycosidase activity of ricin A-chain. Mechanism of action of the toxic lectin ricin on eukaryotic ribosomes. », Journal of Biological Chemistry, vol. 262, no 17, , p. 8128–8130 (DOI 10.1016/S0021-9258(18)47538-2, lire en ligne, consulté le )
- (en) Y Endo et K Tsurugi, « The RNA N-glycosidase activity of ricin A-chain. The characteristics of the enzymatic activity of ricin A-chain with ribosomes and with rRNA. », Journal of Biological Chemistry, vol. 263, no 18, , p. 8735–8739 (DOI 10.1016/S0021-9258(18)68367-X, lire en ligne, consulté le )
- (en) Simonetta Sperti, Lucio Montanaro, Alessandro Mattioli et Fiorenzo Stirpe, « Inhibition by ricin of protein synthesis in vitro : 60S ribosomal subunit as the target of the toxin (Short Communication) », Biochemical Journal, vol. 136, no 3, , p. 813–815 (ISSN 0306-3283, PMID 4360718, PMCID PMC1166019, DOI 10.1042/bj1360813, lire en ligne, consulté le )
- (en) Simon A. Weston, Alec D. Tucker, David R. Thatcher et Dean J. Derbyshire, « X-ray Structure of Recombinant Ricin A-Chain at 1.8 Å Resolution », Journal of Molecular Biology, vol. 244, no 4, , p. 410–422 (DOI 10.1006/jmbi.1994.1739, lire en ligne, consulté le )
- Stirpe et Lappi 2014, p. 4-5.
- Gupta et Salem 2020.
- Worbs 2011.
- Balint 1974.
- Kathryn R Challoner et Margaret M McCarron, « Castor bean intoxication », Annals of Emergency Medicine, vol. 19, no 10, , p. 1177–1183 (ISSN 0196-0644, DOI 10.1016/s0196-0644(05)81525-2, lire en ligne, consulté le )
- A. Rauber et J. Heard, « Castor bean toxicity re-examined: a new perspective », Veterinary and Human Toxicology, vol. 27, no 6, , p. 498–502 (ISSN 0145-6296, PMID 4082461, lire en ligne, consulté le )
- (en) J. Kopferschmitt, F. Flesch, A. Lugnier et Ph. Sauder, « Acute Voluntary Intoxication by Ricin », Human Toxicology, vol. 2, no 2, , p. 239–242 (ISSN 0144-5952, DOI 10.1177/096032718300200211, lire en ligne, consulté le )
- (en) Aslak Godal, Øystein Fodstad, Kristian Ingebrigtsen et Alexander Pihl, « Pharmacological studies of ricin in mice and humans », Cancer Chemotherapy and Pharmacology, vol. 13, no 3, , p. 157–163 (ISSN 1432-0843, DOI 10.1007/BF00269021, lire en ligne, consulté le )
- (en) Ø Fodstad, S. Olsnes et A. Pihl, « Toxicity, distribution and elimination of the cancerostatic lectins abrin and ricin after parenteral injection into mice », British Journal of Cancer, vol. 34, no 4, , p. 418–425 (ISSN 1532-1827, PMID 974006, PMCID PMC2025264, DOI 10.1038/bjc.1976.187, lire en ligne, consulté le )
- (en) ø. Fodstad, J. V. Johannessen, L. Schjerven et A. Pihl, « Toxicity of abrin and ricin in mice and dogs », Journal of Toxicology and Environmental Health, vol. 5, no 6, , p. 1073–1084 (ISSN 0098-4108, DOI 10.1080/15287397909529815, lire en ligne, consulté le )
- Henderson 2016.
- (en) Gareth D. Griffiths, Paul Rice, Anthony C. Allenby et Stephen C. Bailey, « Inhalation Toxicology and Histopathology of Ricin and Abrin Toxins », Inhalation Toxicology, vol. 7, no 2, , p. 269–288 (ISSN 0895-8378 et 1091-7691, DOI 10.3109/08958379509029098, lire en ligne, consulté le )
- (en) Chad J. Roy, Martha Hale, Justin M. Hartings et Louise Pitt, « Impact of Inhalation Exposure Modality and Particle Size on the Respiratory Deposition of Ricin in BALB/c Mice », Inhalation Toxicology, vol. 15, no 6, , p. 619–638 (ISSN 0895-8378 et 1091-7691, DOI 10.1080/08958370390205092, lire en ligne, consulté le )
- (en) C. L. Wilhelmsen et M. L. M. Pitt, « Lesions of Acute Inhaled Lethal Ricin Intoxication in Rhesus Monkeys », Veterinary Pathology, vol. 33, no 3, , p. 296–302 (ISSN 0300-9858 et 1544-2217, DOI 10.1177/030098589603300306, lire en ligne, consulté le )
- (en) R. F. R. Brown et D. E. White, « Ultrastructure of rat lung following inhalation of ricin aerosol », International Journal of Experimental Pathology, vol. 78, no 4, , p. 267–276 (ISSN 0959-9673 et 1365-2613, PMID 9505938, PMCID PMC2694539, DOI 10.1046/j.1365-2613.1997.300363.x, lire en ligne, consulté le )
- Gareth D. Griffiths, Chrostopher D. Lindsay et David G. Upshall, « Examination of the toxicity of several protein toxins of plant origin using bovine pulmonary endothelial cells », Toxicology, vol. 90, no 1, , p. 11–27 (ISSN 0300-483X, DOI 10.1016/0300-483X(94)90201-1, lire en ligne, consulté le )
- Jeffrey A. Doebler, Norman D. Wiltshire, Thomas W. Mayer et James E. Estep, « The distribution of [125I]ricin in mice following aerosol inhalation exposure », Toxicology, vol. 98, no 1, , p. 137–149 (ISSN 0300-483X, DOI 10.1016/0300-483X(94)02978-4, lire en ligne, consulté le )
- (en) D. M. Kemeny, A. W. Frankland, Z. I. Fahkri et A. K. Trull, « Allergy to castor bean in The Sudan: measurement of serum IgE and specific IgE antibodies », Clinical & Experimental Allergy, vol. 11, no 5, , p. 463–471 (ISSN 0954-7894 et 1365-2222, DOI 10.1111/j.1365-2222.1981.tb01620.x, lire en ligne, consulté le )
- G. Metz, D. Böcher et J. Metz, « IgE-mediated allergy to castor bean dust in a landscape gardener », Contact Dermatitis, vol. 44, no 6, , p. 366 (DOI 10.1034/j.1600-0536.2001.440609-2.x, lire en ligne, consulté le )
- S. C. Thorpe, R. D. Murdoch et D. M. Kemeny, « The effect of the castor bean toxin, ricin, on rat IgE and IgG responses », Immunology, vol. 68, no 3, , p. 307–311 (ISSN 0019-2805, PMID 2592006, PMCID 1385440, lire en ligne, consulté le )
- S.C. Thorpe, D.M. Kemeny, R. Panzani et M.H. Lessof, « Allergy to castor bean », Journal of Allergy and Clinical Immunology, vol. 82, no 1, , p. 62–66 (ISSN 0091-6749, DOI 10.1016/0091-6749(88)90052-8, lire en ligne, consulté le )
- S.C. Thorpe, D.M. Kemeny, R.C. Panzani et B. McGurl, « Allergy to castor bean », Journal of Allergy and Clinical Immunology, vol. 82, no 1, , p. 67–72 (ISSN 0091-6749, DOI 10.1016/0091-6749(88)90053-x, lire en ligne, consulté le )
- Lasse Kanerva, Tuula Estlander et Ritta Jolanki, « Long-lasting contact urticaria from castor bean », Journal of the American Academy of Dermatology, vol. 23, no 2, , p. 351–355 (ISSN 0190-9622, DOI 10.1016/0190-9622(90)70220-c, lire en ligne, consulté le )
- (en) Walter M. Grant et Joel S. Schuman, Toxicology of the eye : Effects on the Eyes and Visual System From Chemicals, Drugs, Metals and Minerals, Plants, Toxins and Venoms, Springfield, Illinois, Charles C Thomas Publisher, , 4e éd. (ISBN 9780398082154), p. 1245
- Bozza 2015.
- Foster 2020.
- Jinbiao Zhan et Peiheng Zhou, « A simplified method to evaluate the acute toxicity of ricin and ricinus agglutinin », Toxicology, vol. 186, no 1, , p. 119–123 (ISSN 0300-483X, DOI 10.1016/S0300-483X(02)00726-6, lire en ligne, consulté le )
- Reuven Rasooly et Xiaohua He, « Sensitive Bioassay for Detection of Biologically Active Ricin in Food », Journal of Food Protection, vol. 75, no 5, , p. 951–954 (ISSN 0362-028X, DOI 10.4315/0362-028x.jfp-11-448, lire en ligne, consulté le )
- Xiaohua He, Sixin Lu, Luisa W. Cheng et Reuven Rasooly, « Effect of Food Matrices on the Biological Activity of Ricin », Journal of Food Protection, vol. 71, no 10, , p. 2053–2058 (ISSN 0362-028X, DOI 10.4315/0362-028X-71.10.2053, lire en ligne, consulté le )
- (en) Diana Pauly, Sylvia Worbs, Sebastian Kirchner et Olena Shatohina, « Real-Time Cytotoxicity Assay for Rapid and Sensitive Detection of Ricin from Complex Matrices », PLOS ONE, vol. 7, no 4, , e35360 (ISSN 1932-6203, PMID 22532852, PMCID PMC3330811, DOI 10.1371/journal.pone.0035360, lire en ligne, consulté le )
- (en) Matthew B. Sturm et Vern L. Schramm, « Detecting Ricin: Sensitive Luminescent Assay for Ricin A-Chain Ribosome Depurination Kinetics », Analytical Chemistry, vol. 81, no 8, , p. 2847–2853 (ISSN 0003-2700 et 1520-6882, PMID 19364139, PMCID PMC2692192, DOI 10.1021/ac8026433, lire en ligne, consulté le )
- S. M. Darby, M. L. Miller et R. O. Allen, « Forensic determination of ricin and the alkaloid marker ricinine from castor bean extracts », Journal of Forensic Sciences, vol. 46, no 5, , p. 1033–1042 (ISSN 0022-1198, PMID 11569541, lire en ligne, consulté le )
- (en) Elodie Duriez, François Fenaille, Jean-Claude Tabet et Patricia Lamourette, « Detection of Ricin in Complex Samples by Immunocapture and Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry », Journal of Proteome Research, vol. 7, no 9, , p. 4154–4163 (ISSN 1535-3893 et 1535-3907, DOI 10.1021/pr8003437, lire en ligne, consulté le )
- (en) Craig S. Brinkworth, Eloise J. Pigott et David J. Bourne, « Detection of Intact Ricin in Crude and Purified Extracts from Castor Beans Using Matrix-Assisted Laser Desorption Ionization Mass Spectrometry », Analytical Chemistry, vol. 81, no 4, , p. 1529–1535 (ISSN 0003-2700 et 1520-6882, DOI 10.1021/ac802240f, lire en ligne, consulté le )
- (en) Scott D. Pinkerton, Rial Rolfe, Dick L. Auld et Victor Ghetie, « Selection of Castor for Divergent Concentrations of Ricin and Ricinus communis Agglutinin », Crop Science, vol. 39, no 2, , p. 353–357 (ISSN 0011-183X et 1435-0653, DOI 10.2135/cropsci1999.0011183X003900020008x, lire en ligne, consulté le )
- (en) D.L. Auld, S.D. Pinkerton, E. Boroda et K.A. Lombard, « Registration of TTU‐LRC Castor Germplasm with Reduced Levels of Ricin and RCA 120 », Crop Science, vol. 43, no 2, , p. 746–747 (ISSN 0011-183X et 1435-0653, DOI 10.2135/cropsci2003.746a, lire en ligne, consulté le )
- (en) David L. Brandon et Bradley J. Hernlem, « Development of monoclonal antibodies specific for Ricinus agglutinins », Food and Agricultural Immunology, vol. 20, no 1, , p. 11–22 (ISSN 0954-0105 et 1465-3443, DOI 10.1080/09540100802626487, lire en ligne, consulté le )
- (en) David L. Brandon, Thomas A. McKeon, Stephanie A. Patfield et Qiulian Kong, « Analysis of Castor by ELISAs that Distinguish Ricin and Ricinus communis agglutinin (RCA) », Journal of the American Oil Chemists' Society, vol. 93, no 3, , p. 359–363 (ISSN 0003-021X et 1558-9331, DOI 10.1007/s11746-015-2773-6, lire en ligne, consulté le )
- (en) David L. Brandon, Anna M. Korn et Lily L. Yang, « Immunosorbent analysis of ricin contamination in milk using colorimetric, chemiluminescent and electrochemiluminescent detection », Food and Agricultural Immunology, vol. 25, no 2, , p. 160–172 (ISSN 0954-0105 et 1465-3443, DOI 10.1080/09540105.2012.753515, lire en ligne, consulté le )
- (en) Thomas A. McKeon, Dick Auld, David L. Brandon et Shai Leviatov, « Toxin Content of Commercial Castor Cultivars », Journal of the American Oil Chemists' Society, vol. 91, no 9, , p. 1515–1519 (ISSN 0003-021X et 1558-9331, DOI 10.1007/s11746-014-2505-3, lire en ligne, consulté le )
- (en-US) XIAOHUA HE, STEPHANIE McMAHON, THOMAS A. McKEON et DAVID L. BRANDON, « Development of a Novel Immuno-PCR Assay for Detection of Ricin in Ground Beef, Liquid Chicken Egg, and Milk », Journal of Food Protection, vol. 73, no 4, , p. 695–700 (ISSN 0362-028X et 1944-9097, DOI 10.4315/0362-028x-73.4.695, lire en ligne, consulté le )
- (en) Xiaohua He, John Mark Carter, David L. Brandon et Luisa W. Cheng, « Application of a Real Time Polymerase Chain Reaction Method to Detect Castor Toxin Contamination in Fluid Milk and Eggs », Journal of Agricultural and Food Chemistry, vol. 55, no 17, , p. 6897–6902 (ISSN 0021-8561 et 1520-5118, DOI 10.1021/jf0707738, lire en ligne, consulté le )
- George R. Waller et K. Nakazawa, « Nicotinic Acid-Ricinine Relationship in Sterile Cultures of Ricinus communis L. », Plant Physiology, vol. 38, no 3, , p. 318–322 (ISSN 0032-0889 et 1532-2548, PMID 16655790, PMCID PMC549924, DOI 10.1104/pp.38.3.318, lire en ligne, consulté le )
- Elizabeth I. Hamelin, Rudolph C. Johnson, John D. Osterloh et David J. Howard, « Evaluation of Ricinine, a Ricin Biomarker, from a Non-Lethal Castor Bean Ingestion », Journal of Analytical Toxicology, vol. 36, no 9, , p. 660–662 (ISSN 1945-2403 et 0146-4760, PMID 23014889, PMCID PMC4561852, DOI 10.1093/jat/bks077, lire en ligne, consulté le )
- USAMRIID 2020.
- Roxas-Duncan 2018.
- (en) Frank Musshoff et Burkhard Madea, « Ricin poisoning and forensic toxicology », Drug Testing and Analysis, vol. 1, no 4, , p. 184–191 (ISSN 1942-7603 et 1942-7611, DOI 10.1002/dta.27, lire en ligne, consulté le )
- Hans Bigalke et Andreas Rummel, « Medical aspects of toxin weapons », Toxicology, the Toxicologist and the Response to Incidents with Chemical and Biological Warfare Agents, vol. 214, no 3, , p. 210–220 (ISSN 0300-483X, DOI 10.1016/j.tox.2005.06.015, lire en ligne, consulté le )
- C. S. Ramsden, M. T. Drayson et E. B. Bell, « The toxicity, distribution and excretion of ricin holotoxin in rats », Toxicology, vol. 55, no 1, , p. 161–171 (ISSN 0300-483X, DOI 10.1016/0300-483X(89)90183-2, lire en ligne, consulté le )
- (en) Xiaohua He, Stephanie McMahon, Thomas D. Henderson Ii et Stephen M. Griffey, « Ricin Toxicokinetics and Its Sensitive Detection in Mouse Sera or Feces Using Immuno-PCR », PLOS ONE, vol. 5, no 9, , e12858 (ISSN 1932-6203, PMID 20877567, PMCID PMC2943921, DOI 10.1371/journal.pone.0012858, lire en ligne, consulté le )
- (en) Gareth D. Griffiths, « Understanding Ricin from a Defensive Viewpoint », Toxins, vol. 3, no 11, , p. 1373–1392 (ISSN 2072-6651, PMID 22174975, PMCID PMC3237001, DOI 10.3390/toxins3111373, lire en ligne, consulté le )
- Rasetti-Escargueil et Avril 2023.
- Bahne Stechmann, Siau-Kun Bai, Emilie Gobbo et Roman Lopez, « Inhibition of Retrograde Transport Protects Mice from Lethal Ricin Challenge », Cell, vol. 141, no 2, , p. 231–242 (ISSN 0092-8674, DOI 10.1016/j.cell.2010.01.043, lire en ligne, consulté le )
- Marsden 2005.
- (en) Soligenix, « RiVax® to Prevent Ricin Poisoning », sur Soligenix (consulté le )
- (en) Robert Carlson, MD, « Ricin Vaccine Candidate RiVax® Awarded Patent Protection », sur Precision Vaccinations, (consulté le )
- « Nouvel attentat déjoué en France : l'un des deux Égyptiens mis en examen, l'autre relâché », sur lefigaro.fr, (consulté le ).
- « Allemagne : la police dit avoir déjoué un attentat à la bombe à la ricine », Europe 1, (lire en ligne, consulté le ).
- (cs) Ondřej Kundra, « Muž s ricinem », sur Respekt, (consulté le ).
- (ru) Кристина Сизова, « Покушение на мэра Праги: в Чехии ищут российского шпиона », sur Газета.ru, (consulté le ).
- (ru) « Чехия выслала двух российских дипломатов в связи с "рициновым скандалом" », sur Винегрет, (consulté le ).
- Anne-Laure Frémont, « Une lettre contenant de la ricine envoyée à Barack Obama », sur lefigaro.fr, (consulté le ).
- Agence France-Presse, « La Maison-Blanche a reçu une lettre empoisonnée qui proviendrait du Canada », sur ici.radio-canada.ca, (consulté le ).
- « Things You Should Know About Ricin Before Watching the 'Breaking Bad' Finale » [archive du ], sur National Geographic, National Geographic Society, (consulté le )
- « Woman tried to poison mother in plot inspired by Breaking Bad, court told », The Guardian, London, (lire en ligne, consulté le )
- « Breaking Bad fan guilty of Dark Web ricin plot », BBC News, (lire en ligne, consulté le )
Annexes
modifierBibliographie
modifier![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
Ouvrages
modifier- [Olsnes et Pihl 1982] (en) Sjur Olsnes et Alexander Pihl, « Chapter 3 - Toxic lectins and related proteins », dans Philip Cohen et Simon van Heyningen (eds.), Molecular Action of Toxins and Viruses, Elsevier Biomedical Press, coll. « Molecular Aspects of Cellular Regulation » (no 2), (ISBN 0-444-80400-5, DOI 10.1016/B978-0-444-80400-6.50008-3
 , lire en ligne [PDF]), p. 51–105.
, lire en ligne [PDF]), p. 51–105. 
- [Sharon et Lis 2007] (en) Nathan Sharon et Halina Lis, Lectins, Springer Dordrecht, (ISBN 978-1-4020-6953-6, DOI 10.1007/978-1-4020-6953-6
 , lire en ligne [PDF]).
, lire en ligne [PDF]). 
- [Stirpe et Lappi 2014] (en) Fiorenzo Stirpe et Douglas A. Lappi, Ribosome-inactivating Proteins : Ricin and Related Proteins, John Wiley & Sons, (ISBN 978-1-118-12565-6, lire en ligne).

- [Mantis 2012] (en) Nicholas J. Mantis, Ricin and Shiga Toxins : Pathogenesis, Immunity, Vaccines and Therapeutics, vol. 357, Springer Berlin, Heidelberg, coll. « Current Topics in Microbiology and Immunology », (ISBN 978-3-642-27470-1, ISSN 2196-9965, DOI 10.1007/978-3-642-27470-1
 , lire en ligne).
, lire en ligne). 
- [Millard et LeClaire 2008] (en) Charles B. Millard et Ross D. LeClaire, « Ricin and Related Toxins: Review and Perspective », dans Brian J. Lukey, James A. Romano Jr., James A. Romano, Harry Salem, Brian J Lukey et Harry Salem (eds.), Chemical warfare agents : Chemistry, Pharmacology, Toxicology, and Therapeutics, CRC Press, , 2e éd. (ISBN 978-1-4200-4661-8, DOI 10.1201/9781420046625), p. 423–467.

- [Gupta et Salem 2020] (en) Ramesh C. Gupta et Harry Salem, « Chapter 28 - Ricin », dans Ramesh C. Gupta (ed.), Handbook of Toxicology of Chemical Warfare Agents, Academic Press, , 3e éd. (ISBN 978-0-12-819090-6, DOI 10.1016/B978-0-12-819090-6.00028-3
 , lire en ligne [PDF]), p. 413–426.
, lire en ligne [PDF]), p. 413–426. 
- [Henderson et al. 2016] (en) Terry J. Henderson et al., « The Structural Biology and Biochemistry of the Ricin Toxin and the Military Use and Inhalation Toxicology of Ricin Aerosols », dans Harry Salem et Sidney Katz (eds.), Aerobiology: The Toxicology of Airborne Pathogens and Toxins, Royal Society of Chemistry, coll. « Issues in Toxicology » (no 25), (ISBN 978-1-84973-594-0, DOI 10.1039/9781849737913
 , lire en ligne), p. 186–218.
, lire en ligne), p. 186–218. 
- [Roxas-Duncan et al. 2018] (en) Virginia I. Roxas-Duncan et al., « Ricin », dans Medical Aspects of Biological Warfare, Fort Sam Houston, Texas, Office of The Surgeon General, Borden Institute, US Army Medical Department Center and School Health Readiness Center of Excellence, coll. « Textbooks of Military Medicine », , 2e éd. (ISBN 978-0-16-094159-7, lire en ligne [PDF]), p. 373–401.

- [USAMRIID 2020] (en) USAMRIID, « Ricin », dans USAMRIID’s Medical Management of Biological Casualties Handbook, Fort Detrick, Frederick, Maryland, United States Government Publishing Office, , 9e éd. (ISBN 978-0-16-095526-6, lire en ligne [PDF]), p. 113–117.

- [Roxas-Duncan et Smith 2012] (en) Virginia I. Roxas-Duncan et Leonard A. Smith, « Ricin Perspective in Bioterrorism », dans Virginia I. Roxas-Duncan et Leonard A. Smith (eds.), Bioterrorism, InTech, (ISBN 978-953-51-0205-2, DOI 10.5772/33392
 , lire en ligne [PDF]), p. 133–156.
, lire en ligne [PDF]), p. 133–156. 
- [Foster et al. 2020] (en) Jeffrey T. Foster et al., « Chapter 16 - Ricin forensics: comparisons to microbial forensics », dans Bruce Budowle, Steven Schutzer et Stephen Morse (eds.), Microbial Forensics, Academic Press, , 3e éd. (ISBN 978-0-12-815379-6, DOI 10.1016/B978-0-12-815379-6.00016-7
 , lire en ligne [PDF]), p. 241–250.
, lire en ligne [PDF]), p. 241–250. 
Articles
modifier- [Olsnes 2004] (en) Sjur Olsnes, « The history of ricin, abrin and related toxins », Toxicon, vol. 44, no 4, , p. 361-370 (PMID 15302520, DOI 10.1016/j.toxicon.2004.05.003
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Polito et al. 2019] (en) Letizia Polito et al., « Ricin: An Ancient Story for a Timeless Plant Toxin », Toxins, vol. 11, no 6, (PMID 36828415, PMCID PMC9966136, DOI 10.3390/toxins15020100
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Balint 1974] (en) G.A. Balint, « Ricin: the toxic protein of castor oil seeds », Toxicology, vol. 2, no 1, , p. 77-102 (ISSN 1879-3185, PMID 4823740, DOI 10.1016/0300-483X(74)90044-4
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Nielsen et Boston 2001] (en) Kirsten Nielsen et Rebecca S. Boston, « RIBOSOME-INACTIVATING PROTEINS: A Plant Perspective », Annual Review of Plant Physiology and Plant Molecular Biology, vol. 52, , p. 785-816 (PMID 11337416, DOI 10.1146/annurev.arplant.52.1.785
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Bradberry et al. 2003] (en) Sally M. Bradberry et al., « Ricin Poisoning », Toxicological Reviews, vol. 22, no 1, , p. 65-70 (PMID 14579548, DOI 10.2165/00139709-200322010-00007
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Worbs et al. 2011] (en) Syvia Worbs et al., « Ricinus communis Intoxications in Human and Veterinary Medicine — A Summary of Real Cases », Toxins, vol. 3, no 10, , p. 1332-1372 (PMID 22069699, PMCID PMC3210461, DOI 10.3390/toxins3101332
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Audi et al. 2005] (en) Jennifer Audi et al., « Ricin poisoning: a comprehensive review », JAMA, vol. 294, no 18, , p. 2342-2351 (PMID 16278363, DOI 10.1001/jama.294.18.2342
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Schep et al. 2009] (en) Leo J. Schep et al., « Ricin as a weapon of mass terror — Separating fact from fiction », Environment International, vol. 35, no 8, , p. 1267-1271 (PMID 19767104, DOI 10.1016/j.envint.2009.08.004
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Bozza et al. 2014] (en) William P. Bozza et al., « Ricin detection: Tracking active toxin », Biotechnology Advances, vol. 33, no 1, , p. 117-123 (PMID 25481398, DOI 10.1016/j.biotechadv.2014.11.012
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Marsden et al. 2005] (en) Catherine J. Marsden et al., « Ricin: current understanding and prospects for an antiricin vaccine », Expert Review of Vaccines, vol. 4, no 2, , p. 229-237 (PMID 15889996, DOI 10.1586/14760584.4.2.229
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Reisler et Smith 2012] (en) Ronald B. Reisler et Leonard A. Smith, « The Need for Continued Development of Ricin Countermeasures », Advances in Preventive Medicine, vol. 2012, (PMID 22536516, PMCID 149737, DOI 10.1155/2012/149737
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Rasetti-Escargueil et Avril 2023] (en) Christine Rasetti-Escargueil et Arnaud Avril, « Medical Countermeasures against Ricin Intoxication », Toxins, vol. 15, no 2, (PMID 36828415, PMCID PMC9966136, DOI 10.3390/toxins15020100
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
Articles connexes
modifier- Ricin commun (Ricinus communis)
- Phytotoxine
- Toxalbumine
- Protéine inactivatrice de ribosome (Ribosome-inactivating protein, RIP)
- Lectine
- Abrine
- Arme biologique
- Bioterrorisme
- Convention sur l'interdiction des armes chimiques
Liens externes
modifier
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Ricin: Biotoxin, National Institute for Occupational Safety and Health
- [vidéo] Un poison à portée de main : la ricine | L'Histoire nous le dira # 205
- [vidéo] Bioterrorisme : un traitement contre l'empoisonnement à la ricine - Le Magazine de la santé
- [vidéo] (en) Ricin: The Perfect Poison

